一株芽孢杆菌对球形棕囊藻的溶藻效果
黄思明, 尹平河, 赵 玲
(暨南大学1.生命科学技术学院化学系;2.理工学院 环境工程系,广东 广州 510632)
球形棕囊藻是我国东南沿海典型高发的赤潮藻种之一,近几年来发生频率不断上升,受灾面积不断扩大,带来的经济、环境损失不可估量[1-4].球形棕囊藻大量繁殖时会产生巨大数目的胶质、糖和溶血毒素,同时消耗大量溶解氧,造成鱼类大面积死亡;其释放的二甲基丙磺酸和二甲基硫醚对海洋生态环境产生较大的影响[3-9].因而选择一种有效的治理球形棕囊藻赤潮的方法势在必行.
根据国际上对赤潮防治剂“高效、低毒、价廉、易得”的要求,赤潮治理在采用物理和化学防治方法不甚理想的情况下,人们越来越多地把目光投向了生物方法,其中生物方法中的细菌防治赤潮既可去除赤潮藻细胞,使得海洋环境保持长期可靠的生态平衡,又可以避免赤潮毒素可能在其他生物体中富集的缺陷,已成为当前国内外研究的趋势[10-15].目前,在淡水领域藻菌关系的研究比较深入[16-18],但对海水中的藻菌关系和溶藻细菌治理赤潮的研究工作相对较少,尤其对赤潮藻中球形棕囊藻的报道较为鲜见.因此开展溶藻细菌治理球形棕囊藻的研究具有重要的科学价值.环境因子是重要生态平衡因素,目前的研究大多是探讨对藻生长的影响以及对溶藻细菌生长的影响,而环境因子对细菌溶藻过程中影响的报道相对较少.
本研究考察了海水介质中芽孢杆菌B1对球形棕囊藻生长的影响,研究了环境因子对细菌溶藻效果的影响,以期探索出细菌在抑制藻类生长时的环境影响规律,为赤潮的微生物防治提供科学依据.
1 材料与方法
1.1 藻种
供试藻种为球形棕囊藻(Phaeocystis globosa),来源于暨南大学赤潮与水环境研究中心藻种室.藻类培养液选用 F/2改良配方(Guillard)[19],培养温度(20±1)℃,光照强度为4 000 lx,光暗比为12 h∶12 h.
1.2 溶藻细菌
从珠海香洲码头赤潮发生海水中采集水样,经过分离、纯化和筛选得到溶藻细菌B1,经上海生物工程有限公司鉴定为芽孢杆菌属(Bacillus sp.),PCR扩增产物的长度为1 542 bp,序列在GenBank中的菌株编号为 Bankit 1465471,登录号为JN228893.菌种以 2216E 斜面培养基[20]4 ℃ 冷藏保存.
1.3 球形棕囊藻干质量测定实验
将20 mL的藻液加入烘干至恒重的离心管中,3 000 r/min离心30 min,倒去上清,敞口放置于60℃干燥箱中烘干至恒重,放于干燥器中冷却30 min,准确称量,离心管增量就是球形棕囊藻的干质量,平行3次,取平均值.
1.4 色素和叶绿素a色谱分析方法[3,20]
色素提取:取球形棕囊藻藻液20 mL,以转速4 000 r/min离心20 min,弃上清液,加入5 mL质量分数95%丙酮,放置在4℃的冰箱中静置24 h,以4 000 r/min离心15 min,上清液用分光光度法测定叶绿素a含量,亦可用高效液相色谱进行色素分析.
色谱条件:流动相 A(V甲醇∶V0.5mol/L醋酸铵=80∶20,pH 7.2)流动相 B(V乙睛∶V水=90∶10),流动相 C(V乙酸乙醋);梯度洗脱条件:0~5 min,流动相 A 线性梯度变化到流动相B;5~10 min,流动相B:20%,流动相C增加到80%;10~15 min,流动相B梯度上升到100%;18~25 min,流动相B按线性梯度变化过渡到流动相A,保持100%流动相A的浓度到洗脱完毕.流速为 0.8 mL/min,进样量为 20 μL,检测波长为436 nm,质量分数95%丙酮溶液做空白,测定岩藻黄素、硅甲藻黄素、叶绿素a、别藻黄素和叶黄素5种色素.
1.5 溶藻实验
分别在100 mL藻液中加入一定量不同生长期的菌液,测定球形棕囊藻细胞密度,计算细菌对藻细胞生长的影响.设空白对照,3份平行实验,定时取样测定藻细胞密度,判断细菌溶藻效果.
1.6 不同环境因子下的溶藻实验
实验选取不同藻密度、温度、光照、盐度、藻培养基中N和P含量等环境因子,探讨不同环境因子对细菌溶藻效果的影响.藻密度分别选择处于调整期、对数期、稳定期的藻液;控制温度为:15、20、25、30℃;根据光照时间并将其延伸至极端条件,选择光暗比分别为:24 h/0 h、15 h/9 h、12 h/12 h、9 h/1 h、0 h/24 h;棕囊藻为盐度适应范围非常广的藻类,选择盐度为:20‰、25‰、30‰、35‰、40‰、45‰;藻培养基中N和P的含量分别用硝酸钠和磷酸二氢钠表示:硝酸钠加倍(++)、硝酸钠减半(-)、磷酸二氢钠加倍(++)、磷酸二氢钠减半(-).实验中,在100 mL藻液中加入1.0 mL处于稳定期的菌液,设空白对照,3份平行实验,定时通分光光度法测定叶绿素a含量,判断环境因子对菌液溶藻效果的影响.
1.7 数据处理
实验所有数据均用SPSS 13.0统计软件进行样品显著性分析,P>0.05表明差异不显著,P<0.05表明差异显著,P<0.01表明差异极显著.
2 结果与讨论
2.1 不同生长期细菌对球形棕囊藻溶藻的影响
研究表明,细菌B1在2216E培养基中培养,0~6 h为生长调整期,10~24 h为对数期,24 h之后为稳定期,选取t=4、14、32 h时的细菌 B1分别检测其溶藻能力,结果见图1.从图1中可以看出,与对照组相比,调整期(t检验,P>0.05)溶藻效果不显著,藻细胞密度与对照组相近,藻去除率为22.6%;对数期(t检验,P <0.05)溶藻效果显著,藻去除率为72.1%;稳定期(t检验,P <0.01)溶藻效果极显著,藻去除率达到93.9%.实验表明采用稳定期的B1菌株溶藻能力最强,在控制赤潮的实际应用中,应采用处于稳定期菌液的控藻策略,以获得更好的溶藻效果.

图1 不同生长期细菌B1对藻细胞数的影响Fig.1 The effects of bacteria B1 in different growth periods on algal cell number
不同生长时期的细菌B1对球形棕囊藻干重影响试验见图2,图1和图2对比可见,与藻细胞密度变化表现出相同的趋势,随着藻细胞密度减少,藻干重也随着减小.实验第6 d,与对照组相比较,调整期、对数期、稳定期以干质量表示的去除率分别为:31.8%、76.1%、94.7%.与测量藻细胞密度得出的结论相近.
2.2 菌液添加量对球形棕囊藻生长的影响
在 100 mL 藻液中分别加入 0.1、0.5、1.0、3.0、5.0、7.0、9.0 mL B1 菌液,并通过稀释平板计数法得到细菌数,检测溶藻效果,结果见图3.由图3可见,空白对照组藻细胞密度呈持续增长,与之相比,加入菌液后,藻细胞生长受到不同程度的抑制,当加入菌液为0.1、0.5 mL(t检验,P >0.05)时,抑制作用不明显,直至实验第4天,藻细胞密度呈上升趋势,与对照组相近,溶藻效果不显著.当加入B1菌液为1.0、3.0、5.0、7.0 mL(t检验,P <0.01),藻细胞密度从第1天起呈明显的下降趋势,溶藻第4天去除率分别达 92.7%、94.8%、95.1%、95.2%,表现出极显著的溶藻效果.由此说明B1溶藻效果明显,并且有一定的作用饱和度,在100 mL藻液中加入1.0 mL菌液溶藻效果最好,最佳添加体积比为1%.

图2 不同生长期细菌B1对藻干质量的影响Fig.2 The effects of bacteria B1 in different growth periods on algal dry weight
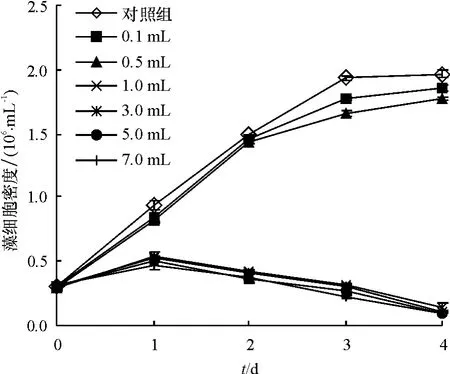
图3 B1菌液添加量对球形棕囊藻生长的影响Fig.3 The lytic effect of addition volumes of bacteria B1 on Phaeocystis globosa
2.3 藻密度对溶藻效果的影响
图4为细菌B1对不同密度的球形棕囊藻去除率变化.藻密度选择了处于调整期、对数期、稳定期的球形棕囊藻藻液,实验第4天,处于调整期、对数期、稳定期球形棕囊藻的去除率分别为97.8%、88.6%、72.8%.这可能是由于处于稳定期的球形棕囊藻,相对于调整期和对数期而言,藻密度高,藻的分泌物增加,对藻起到一定的保护作用,从而使细菌对稳定期球形棕囊藻的去除率低于调整期和对数生长期;调整期藻的去除率高于对数期藻的去除率,可能是由于处于对数期的藻生物量快速增加,藻密度处于上升趋势,弥补了部分细菌去除的藻,从而导致在一定的时间内,对数期藻的去除率低于调整期.由此表明,在利用细菌B1治理球形棕囊藻时,应该选择在藻类密度低的调整期进行治理,效果更为显著.这与晋利等[21]的研究结果相似,他们发现一株芽孢杆菌对处于调整期的铜绿微囊藻的溶藻效果最好.

图4 B1菌液对不同生长阶段的棕囊藻溶藻效果Fig.4 The lytic effect of bacteria B1on the different growthphase of Phaeocystis globosa
2.4 温度对溶藻效果的影响
图5为温度对细菌溶藻效果的影响.如图5所示,温度对细菌B1的溶藻效果有一定的影响,分别对比不同温度下对照组与实验组的叶绿素a含量,在30℃时(t检验,P<0.01),溶藻效果极显著,藻去除率达到96.1%,在15、20、25 ℃时(t检验,P <0.05),溶藻效果表现为显著,藻去除率分别为75.6%、68.1%、78.3%.可能原因是:不同温度下藻的生长状况不同,在温度为15、20、25℃时,球形棕囊藻具有良好的生长状态,抵御外来侵扰的能力较强,在溶藻细菌作用下,藻细胞数目也不会有太大的减少,使得溶藻效果相对较弱.在温度30℃时不利于藻细胞生长,藻细胞的生长状况差,细菌保持着相对较高的繁殖率,使得溶藻效果增强.
温度对色素影响的HPLC分析结果见表1.从表1可见,5种色素岩藻黄素、硅甲藻黄素、叶绿素a、别藻黄素和叶黄素中叶绿素a含量最高.温度对5种色素均产生影响,30℃时,色素信号值最低.在15、20、25、30℃条件下细菌B1对叶绿素a的去除率分别为:79.1%、69.5%、78.2%、95.2%.所得藻去除率与丙酮法测叶绿素a含量得出的去除率相近.
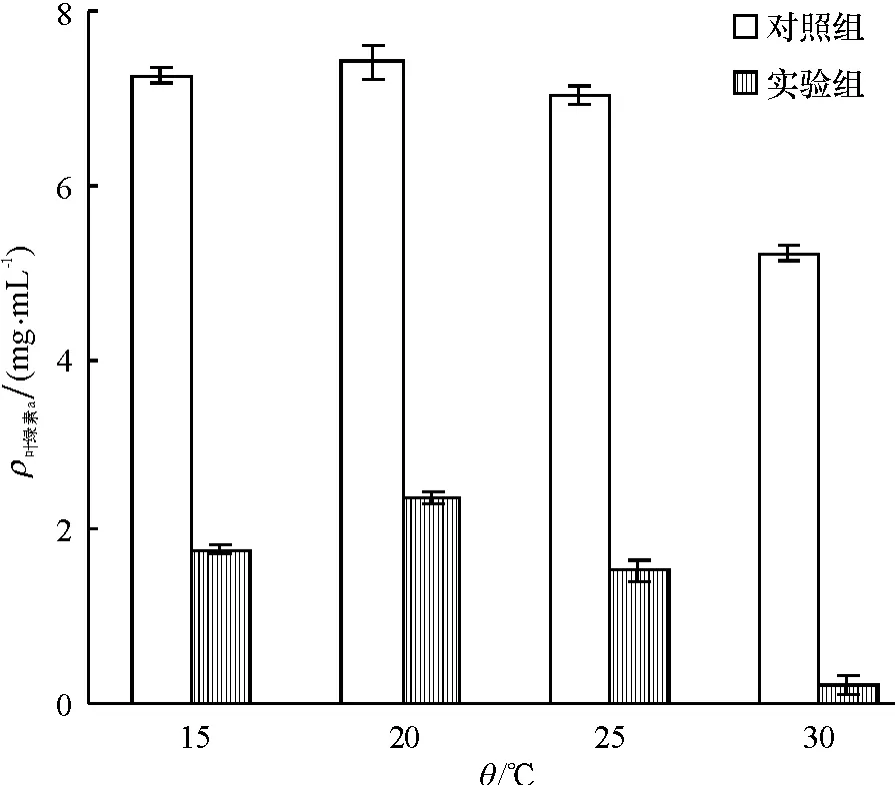
图5 不同温度条件对细菌B1溶藻效果的影响Fig.5 The lytic effect of bacteria B1on Phaeocystis globosa at different temperature

表1 不同温度条件下溶藻实验中藻细胞色素HPLC分析Table1 HPLC traces of pigments of Phaeocystis globosa under different temperature in dissolved algal process
2.5 光照对溶藻效果的影响
光照时间对细菌B1溶藻效果的影响见图6.由图6可知,在光暗比为24 h/0 h时,实验组和对照组叶绿素a含量相近(t检验,P>0.05),细菌的溶藻效果不显著,藻去除率为38.1%.在光暗比分别为15 h/9 h、12 h/12 h和9 h/15 h时,细菌的溶藻效果显著,对照组和实验组叶绿素a含量相差较大(t检验,P < 0.05),藻去除率分别为 82.4%、84.8%、86.4%.在黑暗条件(0 h/24 h)下,实验组中叶绿素a含量接近零(t检验,P<0.01),溶藻效果极显著,计算得溶藻率达到97.4%.光照条件对细菌溶藻效果的影响,主要是对藻生长的影响,而对细菌生长的影响不大.在全黑暗下,藻细胞的光合作用停止,限制了藻对营养元素的吸收,从而抑制了藻细胞的生长,在这种情况下,溶藻细菌更易侵蚀藻细胞,导致藻细胞死亡.而在全光照条件下,藻细胞快速进入生长期,生理状态良好,不易受溶藻细菌的影响.这与史顺玉等[22]的研究结果相似,他们发现一株假单胞菌在全黑暗条件下对绿色微囊藻的溶藻效果最好.

图6 不同光照条件对细菌B1溶藻效果的影响Fig.6 The lytic effect of bacteria B1on Phaeocystis globosa at different light condition
2.6 盐度对溶藻效果的影响
不同海域海水中的盐度是变化的,盐度对细菌溶藻效果的影响见图7.从图7中可以看出在不同的盐度下,对照组的叶绿素a含量相近,盐度对藻细胞的生长基本无限制,这说明球形棕囊藻是盐度适应范围广的赤潮藻,在选定的盐度范围内能正常生长.与对照组相比,实验组中当盐度为35‰时(t检验,P<0.01),叶绿素a含量明显低于其他盐度下叶绿素a的含量,细菌B1溶藻效果极显著,藻去除率达到93.1%.盐度对溶藻效果的影响可能是因为影响了细菌的生理性质,通过破坏其内部的生化反应进程使其不能吸收某些对细菌有益的物质,从而使细菌的生长受到抑制,进而影响其溶藻效果.

图7 盐度对细菌B1溶藻效果的影响Fig.7 Effect of bacteria B1 on growth of Phaeocystis globosa with different salinity
2.7 N和P含量变化对溶藻效果的影响
N和P是微生物生长的重要营养元素,实验采用改变藻培养基中硝酸钠和磷酸二氢钠含量的方法探讨了N、P元素对细菌B1溶藻效果的影响,结果见图8.对比硝酸钠(++)、硝酸钠(-)、磷酸二氢钠(++)、磷酸二氢钠(-)中对照组与实验组叶绿素a含量,通过叶绿素a的降低计算得到藻去除率分别为 56.8%、86.6%、72.6%、90.8%.实验表明,N和P含量加倍时细菌的溶藻效果较弱,减半时溶藻效果增强;这是因为N和P主要影响球形棕囊藻的生长,对细菌的影响相对较小.当培养基中N和P含量增加时,促进了藻的生长,从而降低了细菌的溶藻效果;而当其含量降低时,藻的生长受到一定的抑制,使得溶藻效果增强.
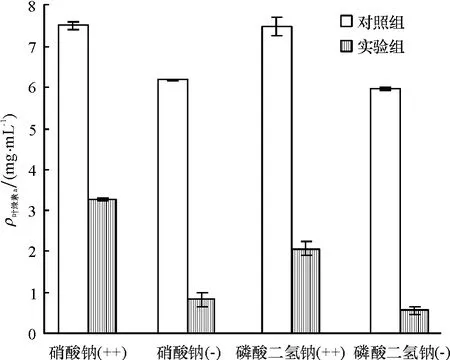
图8 硝酸钠和磷酸二氢钠对细菌B1溶藻效果的影响Fig.8 Effect of B1 on growth of Phaeocystis globosa with different content of NaNO3and NaH2PO4
3 结论
(1)细菌B1对球形棕囊藻有较好的溶藻效果,细菌培养到稳定期时,对球形棕囊藻的溶藻效果最好,菌液的最佳添加量体积比为1%,藻去除率可以达到 92.7%.
(2)球形棕囊藻处于调整期时,藻细胞处于萌发阶段,细菌抑藻效果较好,赤潮治理最佳时机为赤潮爆发初期.温度和光照主要是影响球形棕囊藻的生长对溶藻效果造成一定的影响,在30℃和黑暗条件下细菌的溶藻效果极显著.盐度对球形棕囊藻生长影响不显著,主要通过影响细菌的生理性质影响溶藻效果,当盐度为35‰时细菌溶藻效果极显著,说明在此盐度海域用细菌方法治理赤潮效果更好.N和P含量对藻细胞生长的影响大于对细菌生长的影响,使细菌的溶藻效果在N和P含量较低时效果更好.
[1] BLAUW A N,LOS F J,HUISMAN J,et al.Nuisance foam events and Phaeocystis globosa blooms in Dutch coastal waters analyzed with fuzzy logic[J].Journal of Marine Systems,2010,83(3/4):115-126.
[2] 王 梅,尹平河,赵 玲,等.二氯异氰脲酸钠和三氯异氰脲酸对棕囊藻细胞去除的研究[J].环境科学,2006,27(5):956-959.
[3] 赵 玲,李 蔷,尹平河,等.溶藻细菌的分离鉴定及对球形棕囊藻溶藻作用的环境因子研究[J].海洋环境科学,2011,30(6):853-857.
[4] 颜 天,周名江,钱培元.环境因子对塔玛亚历山综合影响[J].海洋学报,2002,24(2):114-120.
[5] 刘建康,谢 平.揭开武汉东湖蓝藻水华消失之谜[J].长江流域资源与环境,1998,8(3):312-318.
[6] 俞志明,邹 景,马锡年,等.治理赤潮的化学方法[J].海洋与湖沼,1993,24(3):314-318.
[7] JUNG S W,KIM B H,KATANO T,et al.Pseudomonas fluorescens HYK0210-SK09 offers species-specific biological control of winter algal blooms caused by freshwater diatom Stephanodiscus hantzschii[J].Journal of Applied Microbiology,2008,105(1):186-195.
[8] BANIN E,KHARE S K,NAIDER F,et al.Proline-rich peptide form the coral pathogen Vibrio shiloi that inhibits photosynthesis of zooxanthellae[J].Applied and Environmental Microbiology,2001,67(4):1536-1541.
[9] IMAI I,ISHIDA Y,SAKAGUCHI K,et al.Aigicidal marine bacteria isolated from nortbem Hiroshima bya[J].Japsn Fish Sci,1995,61(1):628-636.
[10] LEE S,KATO J,TAKIGUCHI N,et al.Involvement of an extracellular protease in algicidal activity of the marine bacterium Pseudoalteromonas sp.Strain A28[J].Appl Environ Microbiol,2000,66(1):4334-4339.
[11] LOVEJOY C,BOWMAN J P.Algae-lysis effects of a novelmarine Pseudoalter omonas isolate(class proteobacteria gamma subdivision)on harmful algal bloom species of the Genera Chatt onella,Gymnodinium,and Heter oslgma[J].Applied and Environmental Microbiology,1998,64(8):2806-2813.
[12] 林 敏,潘伟斌,张太平,等.三株溶藻细菌溶藻活性代谢产物的初步研究[J].生态环境,2007,16(2):358-362.
[13] 刘 晶,潘伟斌,秦玉洁,等.两株溶藻细菌的分离鉴定及其溶藻特性[J].环境科学与技术,2007,30(2):17-24.
[14] KODANI S,IMOTO A,MITSUTANI A,et al.Isolation and identification of the antialgal compound,harmane(1-methyl-β-carboline),produced by the algicidal bacterium,Pseudomonas sp.K44-1[J].Journal of Applied Phycology,2002,14:109-114.
[15] 杨晓新,尹平河.两株溶藻细菌对棕囊藻溶藻作用的原子力显微镜研究[J].暨南大学学报:自然科学版,2008,29(1):90-94.
[16] NAKAMURA N,NAKANO K,SUGIURA N,et al.A novel cyanobacteriolytic bacterium,Bacillus cereus,isolated from a eutrophic lake[J].Joural of Bioscience and Bioengineering,2003,95(2):179-184.
[17] 吴 刚,席 宇,赵以军.溶藻细菌研究的最新进展[J].环境科学研究,2002,15(5):43-46.
[18] 韩志国,武宝玕,郑解生,等.淡水水体中的蓝藻素研究进展[J].暨南大学学报:自然科学版,2001,22(3):129-135.
[19] SHI S Y,TANG D S,LIU Y D.Effects of an algicidal bacterium Pseudomomas mendocina on the growth and antioxidant system of Aphanizomenon flos-aquae[J].Current Microbiology,2009,59(2):107-122.
[20] 李振国,卢 军,王国祥,等.分光光度法测定浮游植物叶绿素a的比较研究[J].中国环境监测,2006,22(2):21-24.
[21] 晋 利,刘兆普,赵耕毛,等.一株溶藻细菌对铜绿微囊藻生长的影响及其鉴定[J].中国环境科学,2010,30(2):222-227.
[22] 史顺玉,刘永定,沈银武,等.细菌DC10的溶藻作用及环境因子对该作用的影响[J].中国科学C辑生命科学,2004,34(6):564-568.

