BMP信号通路与牙齿发育关系的研究进展
陈贵妙 林陈胜 许 姗
(福建师范大学生命科学学院,福建省发育与神经生物学实验室,福建 福州 350108)
BMP信号通路与牙齿发育关系的研究进展
陈贵妙 林陈胜 许 姗
(福建师范大学生命科学学院,福建省发育与神经生物学实验室,福建 福州 350108)
哺乳动物牙齿发育是一个由多种信号分子进行调控的上皮—间充质相互作用的过程。其中骨形态发生蛋白(BMP)是口腔上皮中最早表达的信号分子之一,它在上皮—间充质相互诱导中起关键的调节作用。BMP信号通路是细胞内外多种因子构成的复杂精细的调控网络,这一网络中各个因子的相互作用对维持牙齿正常发育起重要作用。本文综述了BMP信号通路与牙齿发育的研究进展。
BMP;BMP通路;牙齿发育
哺乳动物牙齿结构相对简单并且具有独特的发育过程,因而被认为是研究哺乳动物器官发生的常用模型之一。牙齿发育过程是由外胚层来源的上皮和神经嵴来源的间充质相互诱导,相互作用而实现的。BMP信号通路在牙齿上皮—间充质的相互诱导中起关键的调节作用。这一通路中的多种因子精确调控可使BMP信号的活性水平达到稳态,这种稳态一旦失衡可能导致严重的牙齿发育异常。因此BMP信号通路与牙齿正常发育中的机制受到国内外学者的广泛研究。
1 牙齿发育
小鼠牙齿发育与包括人类在内的哺乳动物牙齿发育模式和过程相似,因而作为研究牙齿发育的模式生物。在小鼠E9.0(胚胎龄9.0d)时,第一鳃弓还未出现任何形态学变化,但是它已经具备成牙的潜能[1]。E10.5甚至更早牙齿形成的位置已经决定了。至E11.5时,出现口腔上皮的局部增厚形成牙胚发育原基或牙板。E12.5至E13.5,增厚的牙上皮增殖并内陷形成牙蕾,因此该时期被称为蕾状期。E14.5时,牙上皮继续增殖,但牙蕾中心部位形成一个增殖较慢的釉结节,使其外周增殖较快的上皮卷曲包绕间充质形成帽状结构称为帽状期。发育至E16.5,牙上皮继续增殖,进一步向间充质深入形似吊钟,称为钟状期。从帽状期到钟状期的过程基本确定了牙齿的形状。此后,上皮来源的成釉细胞与间充质来源的成牙本质细胞开始形成。
牙齿的形态发生和细胞增殖分化是通过上皮—间充质信号调控来是实现的。上皮和间充质的相互作用涉及许多不同信号分子,这些分子构成了一个复杂的信号网络。参与牙齿早期发育的信号分子可以概括为四大家族:刺猬蛋白(Hedgehog,Hh)、骨形态发生蛋白(bone morphogenetic proteins,BMP)、成纤维细胞生长因子(fibroblast growth factor,FGF)和Wnt[2,3]。其中BMPs是口腔上皮中最早表达的信号分子之一,它在上皮—间充质相互诱导中起关键的调节作用。
2 BMP信号通路
2.1 BMP家族的种类和分子特性
BMPs是一组具有多功能的同源二聚体蛋白,是TGF-β(transforming growth factor β)超家族成员。BMPs是1965年Urist首次发现并从脱钙骨基质中分离出的糖蛋白,它能够诱导体内的异位成骨。随后,这些生长因子被发现广泛表达于脊椎动物的胚胎和胎儿并具有调节发育中的中胚层分化、神经形成、骨化及器官和组织形成的功能。
BMP家族成员被称为成骨蛋白(OP),软骨分化形成蛋白(CDMP),也被称为生长和分化因子(GDF)。它是一类进化高度保守的亚型,目前已知的BMP家族成员有30余种[4]。根据氨基酸序列同源性分析可将它们分为4个组:①Bmp2和Bmp4被归类为dpp亚组,它们的基因序列与果蝇的dpp(decapentaplegic)基因具有75%同源性。②Bmp5,Bmp 6,Bmp 7,Bmp8属于60A亚组;③Bmp3和Bmp3b(GDF10)构成一个独特的亚组;④GDF5,6,7归为一个亚组。在BMP家族中,Bmp1不属于TGF超家族。它的功能是编码水解Ⅰ型前胶原分子的羧基-末端前肽。BMP家族中的许多成员都参与牙齿早期发育,调控牙齿的形态发生、细胞增殖和分化以及牙齿的萌发的过程。
2.2 BMP通路的信号转导
BMPs大多需要与细胞膜上的受体结合才能将信号传递到胞内。BMP的受体有两种亚型:Ⅰ型和Ⅱ型,它们都属于丝氨酸—苏氨酸蛋白激酶(RSTK)跨膜受体。能与BMP配体结合的Ⅰ型受体包括BmpR-Ia (Alk-3)、BmpR-Ib (Alk-6)和ActR- Ia (Alk-2)[5]。Ⅱ型受体中只有BmpRⅡ能与BMP配体结合[6]。BMP的信号传递必须由这两种受体共同介导。只有2个Ⅰ型及2个Ⅱ型受体形成异源四聚复合受体,它们才有较高的亲和力[7]。在信号转导中,BMPs与这种异源四聚复合受体结合后,Ⅱ型受体将诱导Ⅰ型受体的GS区(甘氨酸-丝氨酸区)磷酸化。磷酸化的Ⅰ型受体进而将细胞质中的Smad1/5/8磷酸化,随后,磷酸化的Smad1/5/8与Smad4结合形成复合体,转移到细胞核内调节靶基因的转录和表达[8,9]。此外,BMPs还可以激活MAPK,PI3和PKC等多种激酶信号通路。
BMP信号通路中除了这些正向调控因子的调节外,还受到细胞内外多种信号分子的负向调节(图1):①细胞外的BMP拮抗物如Noggin、Chordin、Gremlin等因子竞争性地与BMP配体结合,使BMPs不能与膜上的BMP受体结合,继而使信号无法传入细胞内[4,10,11]。②细胞内的Smad6能选择性地与BMP的Ⅰ型受体结合,阻断Smad1/5/8的结合和磷酸化[12]。③Tob是一种抗增殖的蛋白,它能选择性地与Smad1/5结合,从而抑制成骨细胞中的BMP信号[13]。④Smurf1是一种E3泛素连接酶,它能与Smad1/5相互作用来介导Smad蛋白的降解[14]。除此之外,Smurf1还可介导Runx2和BmpRI的降解[15,16]。
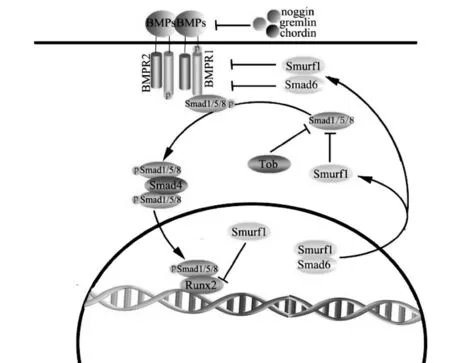
图1 Bmp/Smad信号通路及其调节模式
3 BMPs在牙齿发育中的作用
研究证明,BMP信号通路在牙齿发育的各方面都起着重要作用Bmp4在牙板期表达于牙上皮,随后逐渐转移到牙间充质中表达。它在牙齿早期发育过程中的牙胚位置预定和牙齿形态发生中具有关键作用[17,18]。Bmp2在E11-12表达于牙板上,从E13开始表达于釉结节。它还参与了调节成牙本质细胞的分泌功能。Bmp7在牙板期表达于牙上皮,而后转移至釉结节中表达。Bmp2,4,7的表达模式提示它们在牙齿发育过程中上皮与间充质的相互作用中起重要作用,同时它们在表达模式及表达位置的相似性说明了这几个基因可能存在功能冗余。Bmp3只在牙间充质中表达,它能在可形成成牙骨质细胞的牙囊中表达,推测Bmp3可能参与调节牙槽骨的形成。Bmp5在钟状后期的牙上皮中表达,它具有调节成釉细胞分化或分泌的功能。Bmp6仅在蕾状期和帽状期的间充质中有微弱的表达,它在控制细胞分化的上皮与间充质相互作用中具有重要作用[19]。
稳态是指机体内环境在各种因素的作用下达到一种动态平衡,这种动态平衡是相对的,不是绝对的,一旦稳态遭破坏,就导致机体发育异常。现代生命科学的研究将稳态的概念延伸到信号分子调控水平上。信号通路是由多种信号分子形成的复杂的调控网络,在这个网络结构中基因表达量的动态平衡是维持正常生理机能所必须的[20]。
BMP信号稳态即BMP信号的活性水平通过细胞内外多种因子的精确调控使其达到一个动态平衡的状态,一种信号分子剂量的变化可以通过其他因子剂量的相应变化来挽救这种平衡状态。这种稳态的保持对维持牙齿的正常发育起重要作用,BMP信号的稳态一旦失衡可能导致严重的牙齿发育异常。研究发现BmpR-Ib的缺失不会造成小鼠牙齿的缺陷[21,22]但条件性敲除牙上皮中BmpR-Ia的小鼠,磨牙的发育停滞在蕾状期[23,24];条件性敲除神经嵴来源的间充质中的BmpR-Ia的小鼠,其牙齿发育停滞在蕾状期和帽状早期,并有严重的下颌缺陷;而在间充质中利用ca BmpR-Ib代替BmpR-Ia能部分挽救磨牙和上切牙的缺陷,但并不能挽救下颌缺陷及下切牙的缺失[25]。这一系列的研究表明BMP受体作为BMP信号传导的首要环节,在牙齿发育中起重要作用。在磨牙间充质中BmpR-Ia和BmpR-Ib具有部分功能互补,其中一者的缺失可通过另一方的互补作用挽救这种信号的失衡。敲除Bmp6或Bmp7的小鼠牙胚的发育并没有收到显著的影响[26],推断它们的表达可能协同其他BMPs发挥作用,或其他信号分子的剂量变化调节了它们的活性水平。Bmp5和Bmp7双敲除发现小鼠的鳃弓发育不全[27]。对BMP拮抗物对牙齿发育的影响的研究显示Noggin敲除小鼠的下切牙和上下磨牙发育正常,而上切牙发生融合[28],推测不同类型牙齿对维持BMP信号稳态的机制存在差异。Gremlin过表达抑制Bmp4介导DSPP分泌,导致转基因小鼠的牙釉质缺陷,提示BMP拮抗剂与激动剂相互作用使BMP信号达到稳态对牙齿正常发育具有关键的作用[29]。
4 研究展望
口腔疾病是人类最常见的多发疾病之一,严重影响人们的生活质量,对牙齿的发育与再生的研究刻不容缓。BMP信号通路对维持牙齿正常发育具有至关重要的作用。BMPs是口腔上皮中最早表达的信号分子之一,它在上皮-间充质的相互诱导中起关键的调节作用,但目前仅对BMP通路中部分的配体与牙齿发育的关系进行了研究,还有许多在牙齿发育过程中起重要作用的因子尚未研究。同时,BMP通路在正常牙齿发育达到一个稳态,稳态一旦破坏可能导致严重的牙齿发育异常,因此进一步研究BMP信号稳态对牙齿发育的影响机制是非常有必要的。目前还有几个重要的问题有待进一步研究:①BMP信号稳态对不同类型牙齿的作用机制;②还有一些BMP配体在维持BMP信号稳态的机制仍未被研究;③BMP拮抗物的负向调控在牙齿发育中所起的作用。相信随着转基因小鼠构建和体外添加生长因子等实验技术日趋成熟,BMP信号通路对牙齿发育的影响将进一步得到解答,这些机制在小鼠实验中的研究也将有助于人们对人类牙齿疾病的进一步研究。
[1] Zhang Y,Wang S,Song Y,et al.Timing of odontogenic neural crest cell migration and tooth-forming capability in mice[J].Developmental dynamics,2003,226(4):713-718.
[2] Thesleff I.Epithelial-mesenchymal signalling regulating tooth morphogenesis[J].J Cell Sci,2003,116(9):1647-1648.
[3] Zhang YD,Zhi C,Yi Qiang S,et al.Making a tooth: growth factors, transcription factors,and stem cells[J].Cell Res,2005,15(5):301-316.
[4] Chen D,Zhao M,Mundy GR.Bone morphogenetic proteins[J]. Growth factors,2004,22(4):233-241.
[5] Fujii M,Takeda K,Imamura T,et al.Roles of bone morphogenetic protein type I receptors and Smad proteins in osteoblast and chondroblast differentiation[J].Molecular biology of the cell,1999,10 (11):3801-3813.
[6] Thomson JR,Machado RD,Pauciulo MW,et al.Sporadic primary pulmonary hypertension is associated with germline mutations of the gene encoding BMPR-II,a receptor member of the TGF-β family[J].J Med Gene,2000,37(10):741-745.
[7] Canalis E,Economides AN,Gazzerro E.Bone morphogenetic proteins,their antagonists,and the skeleton[J].Endocrine reviews,2003, 24(2):218-235.
[8] Nohe A,Keating E,Knaus P,et al.Signal transduction of bone morphogenetic protein receptors[J].Cellular signalling,2004,16(3): 291-299.
[9] Sieber C,Kopf J,Hiepen C,et al.Recent advances in BMP receptor signaling[J].Cytokine & growth factor reviews,2009,20(5):343-355.
[10] Zimmerman LB,De Jesús-Escobar JM,Harland RM.The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4[J].Cell,1996,86(4):599-606.
[11] Groppe J,Greenwald J,Wiater E,et al.Structural basis of BMP signalling inhibition by the cystine knot protein Noggin[J].Nature, 2002,420(6916):636-642.
[12] Imamura T,Takase M,Nishihara A,et al.Smad6 inhibits signalling by the TGF-ß superfamily[J].Nature,1997,389(6651):622.
[13] Yoshida Y,Tanaka S,Umemori H,et al.Negative regulation of BMP/ Smad signaling by Tob in osteoblasts[J].Cell,2000,103(7):1085-1097.
[14] Zhu H,Kavsak P,Abdollah S,et al.A SMAD ubiquitin ligase targets the BMP pathway and affects embryonic pattern formation[J]. Nature,1999,400(6745):687-693.
[15] Zhao M,Qiao M,Oyajobi BO,et al.E3 ubiquitin ligase Smurf1 mediates core-binding factor α1/Runx2 degradation and plays a specific role in osteoblast differentiation[J].J Biological Chemistry, 2003,278(30):27939-27944.
[16] Zhao M,Qiao M,Harris SE,et al.Smurf1 inhibits osteoblast differentiation and bone formation in vitro and in vivo[J].J Biological Chemistry,2004,279(13):12854-12859.
[17] Neubüser A,Peters H,Balling R,et al.Antagonistic interactions between FGF and BMP signaling pathways: a mechanism for positioning the sites of tooth formation[J].Cell,1997,90(2):247-255.
[18] Tucker AS,Matthews KL,Sharpe PT.Transformation of tooth type induced by inhibition of BMP signaling[J].Science,1998,282(5391): 1136-1138.
[19] Åberg T,Wozney J,Thesleff I.Expression patterns of bone morphogenetic proteins (Bmps) in the developing mouse tooth suggest roles in morphogenesis and cell differentiation[J].Developmental dynamics,1998,210(4):383-396.
[20] Heath JK.Chapter Four-Transcriptional Networks and Signaling Pathways that Govern Vertebrate Intestinal Development[J]. Current topics in developmental biology,2010,90:159-192.
[21] Baur ST,Mai JJ,Dymecki SM.Combinatorial signaling through BMP receptor IB and GDF5: shaping of the distal mouse limb and the genetics of distal limb diversity[J].Development,2000,127(3): 605-619.
[22] Yi SE,Daluiski A,Pederson R,et al.The type I BMP receptor BMPRIB is required for chondrogenesis in the mouse limb[J].Development,2000,127(3):621-630.
[23] Andl T,Ahn K,Kairo A,et al. Epithelial Bmpr1a regulates differentiation and proliferation in postnatal hair follicles and is essential for tooth development[J].Development,2004,131(10):2257-2268.
[24] Liu W,Sun X,Braut A,et al. Distinct functions for Bmp signaling in lip and palate fusion in mice[J].Development,2005,132(6):1453-1461.
[25] Li L,Lin M,Wang Y,et al.< i> BmprIa</i> is required in mesenchymal tissue and has limited redundant function with< i> BmprIb</i> in tooth and palate development[J].Developmental biology, 2011,349(2):451-461.
[26] Helder M,Karg H,Bervoets T,et al.Bone morphogenetic protein-7 (osteogenic protein-1,OP-1) and tooth development[J].J Dental Research,1998,77(4):545-554.
[27] Solloway MJ,Robertson EJ.Early embryonic lethality in Bmp5; Bmp7 double mutant mice suggests functional redundancy within the 60A subgroup[J].Development,1999,126(8):1753-1768.
[28] Hu X,Wang Y,He F,et al.Noggin Is Required for Early Development of Murine Upper Incisors[J].J Dental Research,2012,91(4): 394-400.
[29] Nagatomo KJ,Tompkins KA,Fong H,et al.Transgenic overexpression of gremlin results in developmental defects in enamel and dentin in mice[J].Connective tissue research,2008,49(6):391-400.
R78
A
1671-8194(2013)17-0071-03

