甲砜霉素在松浦镜鲤体内的药物代谢动力学研究
杨洪波,王荻,卢彤岩
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
甲砜霉素在松浦镜鲤体内的药物代谢动力学研究
杨洪波1、2,王荻1,卢彤岩1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
采用液相色谱与质谱连用技术 (LC-MS),研究了以30 mg/kg(体质量)的药量在单次口灌给药条件下,甲砜霉素在松浦镜鲤Cynipus carpio L.体内的药物代谢动力学。试验水温为 (20±0.2)℃,试验鲤(1+龄) 体质量为 (84.84±17.45)g。在给药后 0.25、0.50、0.75、1.00、1.50、2.00、4.00、6.00、8.00、12.00、24.00、36.00、48.00、72.00 h采集鲤的肌肉、血浆、肝胰脏和肾脏,测定各组织中甲砜霉素的浓度,用药动学3P97软件进行数据分析和处理。结果表明,甲砜霉素在鲤体内吸收分布迅速,符合一级吸收二室开放模型,但消除缓慢。甲砜霉素在鲤血浆、肝胰脏、肾脏和肌肉中的主要药代动力学参数如下:消除半衰期 (T1/2β) 分别为 77.292、24.625、79.966、25.600 h;分布半衰期 (T1/2α) 分别为7.317、0.454、7.409、1.376 h;药时曲线下总面积(AUC)分别为 782.641 μg/(mL·h)、544.756 μg/(g·h)、3 616.060 μg/(g·h)和158.634 μg/(g·h)。鉴于甲砜霉素在鲤血浆和肾脏中的消除半衰期长,消除缓慢,建议使用该类药物时应相对延长给药间隔时间。
鲤;甲砜霉素;药物代谢动力学
甲砜霉素 (Thiamphenicol,简称TAP)目前主要以人工方法合成,是一种有效的广谱抗菌药。其结构与氯霉素非常相似,将氯霉素分子中的对位硝基用甲磺酰基取代即可制成TAP,TAP的抗菌和应用范围与氯霉素基本相同,但毒性有所降低[1]。氯霉素在水产品中的残留对生物体的健康构成了巨大的威胁[2],且水产动物体内残留的该类药物随食物链能进入人体,诱导人类致病菌对该药产生耐药性,不利于该药对人类疾病的治疗。在水产养殖中,氯霉素类药物还会以原型或代谢物形式经粪便等排泄物污染生态环境,威胁公共卫生安全[3]。因此,TAP作为氯霉素的替代药物,在水产疾病防控及治疗方面已得到广泛应用[4]。但目前关于TAP在水产动物体内的药代动力学研究较少,国外仅见对鲷[5]和鲈[6]有关方面的研究报道,而国内仅见对凡纳滨对虾[7]有关方面的研究报道。
松浦镜鲤Cynipus carpio L.是中国水产科学院黑龙江水产研究所在德国镜鲤选育系F4代基础上培育的新品种,具有背部高而厚、体表基本无鳞、体型好、抗寒力强、生长快、繁殖力高等特点[8]。
液相色谱与质谱连用技术 (LC-MS)是分析生物样品中痕量物质的重要方法之一,具有液相色谱和质谱两种技术的优点,具有高灵敏度和专一性,并且能大大缩短分析时间[9-12]。本研究中,作者采用LC-MS技术,研究了在单次口灌给药条件下,甲砜霉素在松浦镜鲤体内的药物代谢动力学规律,旨在为甲砜霉素在水产养殖中的合理用药提供科学依据。
1 材料与方法
1.1 材料
松浦镜鲤 (1+龄)体质量为 (84.84±17.45) g,由黑龙江省呼兰冷水性鱼类试验站提供。
TAP标准品 (批号01103)含量98.5%,德国DR.Ehrenstorfer产品;TAP原粉 (批号 P-047-WS11062101)含量98.9%,购自浙江海翔药业股份有限公司;乙酸乙酯、正己烷和甲醇均为色谱纯试剂,Merck KGaA公司产品;其他试剂均为分析纯。
液相色谱-质谱联用仪为ACQuity,美国Waters公司产品。
1.2 方法
1.2.1 试验条件及养殖管理 试验鱼暂养7 d后,选择规格相近、体质健康的鱼进行试验,给药前停饲24 h,给药后4 h投饵[13]。试验期间水温保持在 (20±0.2)℃。试验在方形自动循环水鱼缸中进行,试验期间持续给氧。
1.2.2 液相色谱-质谱联用及分析条件
1)色谱条件。Discovery C18色谱柱 [5 μm, 150 mm×2.1 mm(内径)],流动相为甲醇+水[φ(甲醇)∶φ(水)=40∶60],流速为 0.30 mL/min,柱温为40℃,进样量为20 μL[14]。
2)质谱条件。电喷雾离子源,负离子扫描,多反应监测 (MRM),电喷雾电压为-1 750 V;雾化气、气帘气、辅助加热气、碰撞气均为高纯度氮气及其他合适气体,使用前应调节各气体流量以保证质谱灵敏度达到检测要求;辅助气温为500℃,定性离子对质荷比 (m/z) 为 354.0/290.0和354.0/185.0,定量离子对 m/z为 354.0/185.0,采集时间为200 ms,去簇电压为-55 V,碰撞能量为-18 V和-27 V[14]。
1.2.3 给药方式及样品采集 试验用鲤84尾,随机分成14组,每组6尾。以30 mg/kg(体质量)的药量给鲤单次口灌TAP,口灌时将软管插入鱼胃部,注意插入的深度,防止将胃部捅破[15]。分别于给药后0.25、0.50、0.75、1.00、1.50、2.00、4.00、 6.00、 8.00、 12.00、 24.00、 36.00、48.00、72.00 h采集鲤的血液,先将注射器用0.3%的肝素钠润洗,然后从试验鱼尾静 (动)脉采血,将血液以4 000 r/min离心10 min,分离血浆。采血后将鱼处死,取肾脏、肝胰脏和肌肉样品。采集的所有样品全部放入超低温冰箱 (-80℃)中冷冻保存。
1.2.4 样品的处理 用移液管准确量取200 μL待测血浆样品,置于50 mL聚丙烯离心管中,加入10 mL碱化乙酸乙酯[φ(乙酸乙酯)∶φ(氨水)= 97∶3,下同],漩涡振荡30 s,以4 000 r/min离心5 min,上清转移至鸡心瓶中。在原管中再加入10 mL碱化乙酸乙酯,用玻璃棒搅动残渣,于漩涡振荡器上涡旋提取30 s,以4 000 r/min离心5 min,上清合并至鸡心瓶中,在45℃下旋转蒸发至干。鸡心瓶残渣用2 mL体积分数为10%的甲醇溶液溶解,再加入2 mL正己烷旋涡混合30 s,以4 000 r/min离心5 min,移取1 mL下层溶液于15 mL聚丙烯离心管中,用体积分数为10%的甲醇溶液稀释至10倍体积,经0.22 μm有机相滤膜过滤,供液相色谱-串联质谱测定。
分别称取1 g(精确至0.01 g)待测的肝胰脏、肾脏和肌肉样品,置于50 mL聚丙烯离心管中,加入10 mL碱化乙酸乙酯,匀质提取30 s,其余处理同上。
1.2.5 标准曲线的制备 用流动相将TAP标准品配制成0、2、5、10、20、50、100、200 ng/mL的标准液,经0.22 μm有机相滤膜过滤,对进样瓶中的过滤液进行LC-MS测定。以TAP浓度为横坐标,峰面积为纵坐标绘制标准曲线,求得回归方程和相关系数。
1.2.6 相对回收率和精密度 取鲤的空白血浆200 μL,肝胰脏、肾脏和肌肉各1 g,向样品中分别加入浓度为5 μg/mL的TAP标准液,至终浓度达到10、20、50、100、200、500 ng/mL,混匀静置,使药物充分渗入组织中。按照试验样品处理方法处理后,用液相色谱-串联质谱测定鲤各空白组织中的药物浓度。按照样品处理方法处理后测定各组织中的药物浓度,并按下式计算:

在1 d内分别重复测定上述6个浓度梯度的同一样品3次,在1周内重复测定3次,计算样品在不同浓度梯度下的相对标准偏差,再计算出日内和日间精密度。
1.3 数据处理
采用药代动力学3P97软件对试验数据进行处理和模型拟合,计算药物代谢动力学方程和主要药物代谢动力学参数,并确认ATP在鲤体内的药物代谢动力学模型。
2 结果
2.1 色谱行为
TAP标准曲线回归方程为 y=61.7879x+ 405.833(r=0.9988),呈线性关系。在优化的色谱条件下,以m/z 354.0作为母离子,选取峰度最强的m/z 185.0和m/z 290.0作为TAP的监测离子,测得TAP保留时间约为2.64 min,在保留时间内没有干扰峰出现,并且色谱峰峰形较佳,均为基线分离峰。
2.2 相对回收率和精密度
本试验条件下,鲤血浆、肾脏、肝胰脏和肌肉的相 对 回 收 率 分 别 为 89.21% ~98.18%、84.53%~96.34%、96.54% ~97.86%和97.68%~99.19%。鲤各组 织的 回收 率为 84.53% ~99.19%,日内精密度为1.188%±0.354%,日间精密度为3.522%±0.479%,可满足试验要求。
2.3 TAP在鲤体内的药代动学参数和药时曲线
使用药动学3P97软件进行数据拟合,结果显示:TAP在鲤体内的药动学模型符合一级吸收二室开放模型,各组织的药物代谢动力学方程分别为
血浆C=43.436e-0.095(t-0.234)+ 3.068e-0.009(t-0.234)-46.504e-2.580(t-0.234);
肝胰脏C=84.318e-1.525(t-0.143)+ 15.039e-0.028(t-0.143)-109.357e-2.218(t-0.143);
肾脏C=111.957e-0.094(t-0.017)+ 23.821e-0.09(t-0.017)-135.778e-0.413(t-0.017);
肌肉C=26.479e-0.504(t-0.017)+ 3.582e-0.027(t-0.017)-30.061e-1.146(t-0.017)。主要药物代谢动力学参数见表1。在 (20± 0.2)℃水温下,以30 mg/kg(体质量)的剂量单次给鲤口灌TAP后,药物在鲤血浆、肝胰脏、肾脏和肌肉中的浓度随时间变化的规律见图1。
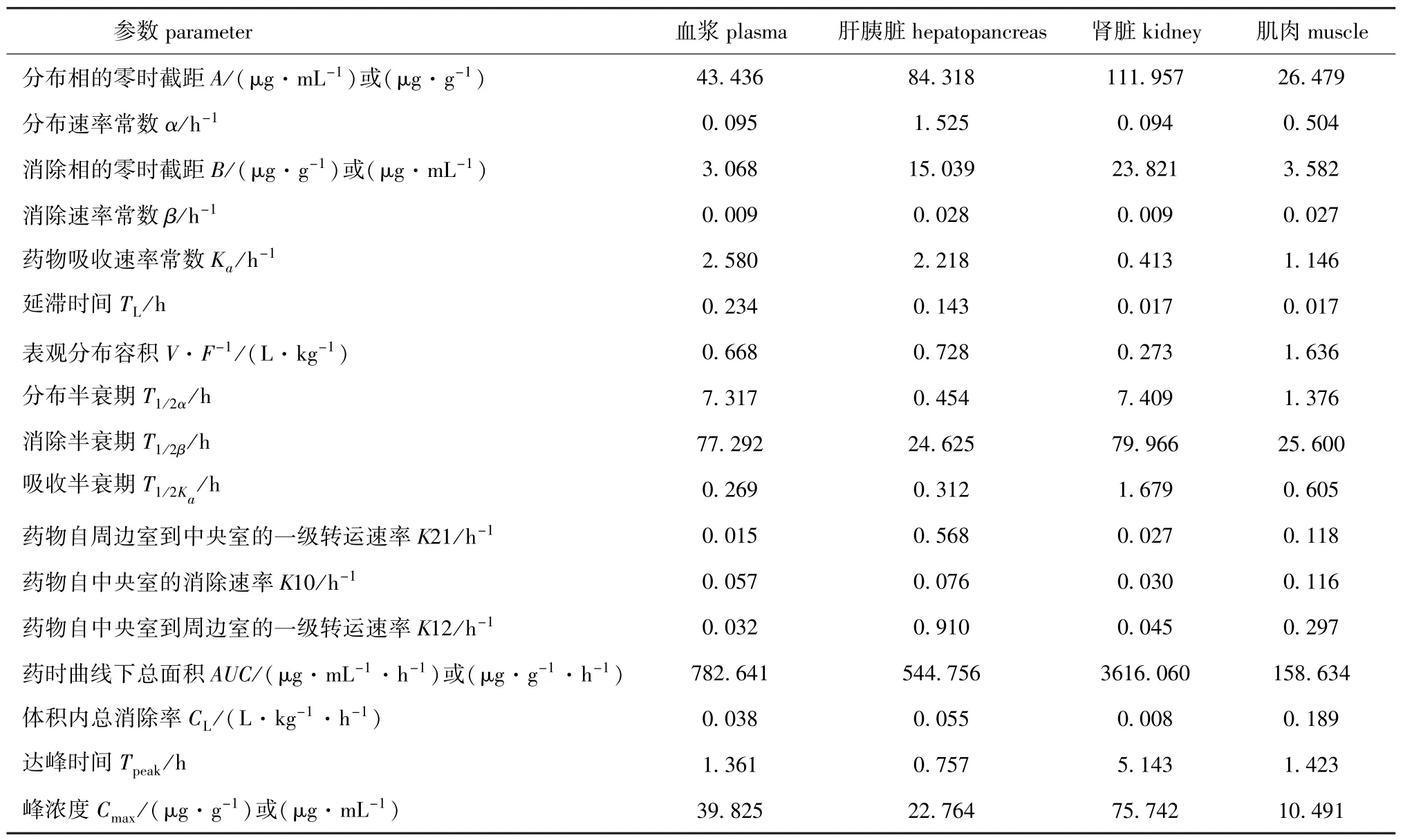
表1 单次口灌TAP后药物在鲤体内的药代动力学参数Tab.1 The pharmacokinetic parameters of TAP in Songpu common carp

图1 TAP在鲤血浆、肾脏、肝胰脏和肌肉中的药物浓度Fig.1 Concentrations of TAP in plasma,hepatopancreas,kidney and muscle of Songpu common carp
3 讨论
TAP在鲤体内的药物动力学试验结果表明,在(20±0.2)℃的水温条件下,以30 mg/kg(体质量)的剂量单次给鲤口灌TAP,血药浓度用一级吸收二室开放模型描述最为合适。杨先乐等[16]以50 mg/kg剂量的氯霉素对1龄和2龄尼罗罗非鱼Tilapia nilotica进行单次口灌给药;李爱华[17]在水温 (20±2)℃下,以100 mg/kg剂量的氯霉素对草鱼和复合四倍体异育银鲫Carassiusauratus gibelio进行单次腹腔注射;陈玲珍等[18]在水温17℃下,分别以5.0、10.0、20.0 mg/kg剂量的氟苯尼考对中华绒螯蟹Eriocheir sinensis进行单次肌肉注射给药;林茂等[19]以30 mg/kg剂量的氟苯尼考对日本鳗鲡Anguilla japonica Temminck et Schlegel和欧洲鳗鲡Anguilla anguilla进行混饲口灌给药。由上述文献可知,在不同剂量、温度、给药方式和发育阶段等条件下,氯霉素类药物在水产动物体内的药代动力学多数适合用二室模型来描述。
达峰时间 (Tpeak)和药物的峰浓度 (Cmax)是衡量药物在机体内的吸收速度和程度的重要参数,药时曲线下总面积 (AUC)用于衡量药物在机体内的吸收及血浆和各组织器官对药物的吸收程度。本研究结果表明,TAP进入鲤体内后迅速扩散,鲤血浆中的 Tpeak为1.361 h,肝胰脏、肾脏和肌肉的Tpeak为0.757、5.743、1.423 h,TAP在鲤肾脏中的达峰时间最长。AUC在鲤血浆、肝胰脏、肾脏和肌肉中分别为782.641 μg/(mL·h)、544.756 μg/(g·h)、3 616.060 μg/(g·h)和 158.634 μg/(g·h),这表明TAP在鲤肾脏中的吸收量明显高于血浆、肝胰脏和肌肉,TAP在渗透性好、血管丰富的组织 (如肾脏)中吸收量较多[20]。由此推测,血浆、肌肉、肝胰脏和肾脏中的TAP分布量可能与血流量有关,两者具有动态同步性。
本试验中,血浆、肝胰脏、肾脏、肌肉中的T1/2Ka分别为0.269、0.312、1.679、0.605 h,表明TAP在鲤体内吸收迅速,不同部位的吸收速率不同可能是由血液循环速度差异引起的[21]。给鲤单次口灌TAP后,T1/2β从大到小依次为肾脏 (79.966 h)、血浆 (77.292 h)、肌肉 (25.600 h)和肝胰脏 (24.625 h),表明TAP在血浆和肾脏中的消除半衰期较长,可能是因为TAP在血浆中吸收,经肾脏排泄所致,而肝胰脏和肌肉中的消除半衰期相似,消除半衰期相对较短。本研究结果显示,TAP在松浦镜鲤体内消除缓慢,平均滞留时间较长。由以上药代动力学参数可知,TAP在鲤体内分布快,吸收迅速,且吸收效果较好,但在肾脏和血浆中消除较缓慢。鲤各组织中K21均小于K12,比值均大于1,说明从周边室到中央室的分布速率小于从中央室到周边室的分布速率。
综上可以看出,TAP在松浦镜鲤体内吸收快且完全,达峰时间短,分布较广泛,这与其他氯霉素类药物的特征十分相似,但血浆和肾脏中的消除半衰期长,消除缓慢,因此,在使用该类药物时,应相对延长给药间隔时间。但是,由于种属[22-27]、性别[23,28]、 水温[29-30]、 给药方式[24,31]和给药剂量[32-33]等复杂原因造成水产动物之间药动学特征存在显著差异,因此,确定合理的给药方案时需慎重分析其差异。
[1]李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002.
[2]蒋定国,杨大进.动物性食品中氯霉素残留检测技术的研究概况[J].中国食品卫生杂志,2002,14(2):44-47.
[3]Wu Y B,Wang Z S,Liao X T,et al.Effects of enroflixacin on microorganisms in wet lands[J].Acta Ecologica Sinica,2006,26 (8):2640-2645.
[4]郝凯,过世东,胥传来.水产品中甲砜霉素残留的ELISA检测方法研究[J].食品工业科技,2006(2):186-189.
[5]Castells G,Intorre L,Bertini S,et al.Oral single-dose pharmacokinetics of thiamphenicol in the sea-bass(Dicentrarchus labrax) [J].Journal of Veterinary Pharmacology and Therapeutics,2000, 23(1):53-54.
[6]Della Rocca G,Anfossi P,Tomasi L,et al.In-feed administration of thiamphenicol in sea-bream(Sparus aurata(Pagrus aurata)) tissue distribution and residues[J].Journal of Veterinary Pharmacology and Therapeutics,1997,20(11):316-317.
[7]陈玉露.甲砜霉素和氟甲砜霉素在凡纳滨对虾体内的药代动力学和对药敏影响的研究[D].雅安:四川农业大学,2009.
[8]王洋,徐奇友,许红,等.维生素K3对松浦镜鲤体成分、肉质和抗氧化能力的影响[J].动物营养学报,2011,23(6):1058-1064.
[9]Fu I,Woolf E J,Matuszew Ski B K.Effect of the sample matrix on the determination of indinavir in human urine by HPLC with turboion spray tandem mass spectrometric detection[J].Pharm Biomed Anal,1998,18(3):347.
[10]Matuszew Ski B K,Constanzer M L,Chavezeng C M.Matrix effect in quantitative LC/MS/MS analyses of biological fluids a method for determination of finasteride in human plasma at picogram per milliliter concentrations[J].Anal Chem,1998,70(5):882-889.
[11]Sutherland F C,De Jager A D,Swart K J,et al.Determination of linsidomine in human plasma by tandem LC-MS with ESI[J]. Pharm Biomed Anal,2000,22(3):461-467.
[12]Ito S,Tsukada K.Matrix effect and correction by standard addition in quantitative liquid chromatographic-mass spectrometric analysis of diarrhetic shellfish poisoning toxins[J].Chromatogr A, 2002,943(1):39-46.
[13]王贤玉,宋洁,王伟利,等.氧氟沙星在吉富罗非鱼体内的药代动力学及残留的研究[J].大连海洋大学学报,2011,26(2): 144-148.
[14]庞国芳.林海丹.林峰,等.可食动物肌肉、肝脏和水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定——液相色谱-串联质谱法[S].北京:中国标准出版社,2007.
[15]郭娇娇,潘红艳,杨虎,等.恩诺沙星在杂交鲟体内的药物代谢动力学[J].大连海洋大学学报,2011,26(4:)362-366.
[16]杨先乐,湛嘉,胡鲲.氯霉素在尼罗罗非鱼血浆中的药代动力学研究[J].水产学报,2005,29(1):60-65.
[17]李爱华.氯霉素在草鱼和复合四倍体异育银鲫体内的比较药代动力学[J].中国兽医学报,1998,18(4):372-374.
[18]陈玲珍,杨洪生,吴光红,等.给药剂量对氟苯尼考在中华绒螯蟹体内的药代动力学影响[J].动物学杂志,2010,45(4): 102-109.
[19]林茂,纪荣兴,陈政强,等.氟苯尼考在日本鳗鲡和欧洲鳗鲡体内的药代动力学[J].安徽农业科学,2011,39(36):22341-22343,22517.
[20]Avise J C.Phylogeography the History and Formation of Species [M].Cambridge,Massachusetts London,England:Harvard University Press,2000.
[21]邓树海,张秀珍,邹立家.药物动力学与生物药剂学[M].天津:天津科技翻译出版公司,1992:436-479.
[22]Feng J B,Jia X P,Li L D.Tissue distribution and elimination of florfenicol in tilapia(Oreochromis niloticus×O.aureus)after a single oral administration in freshwater and seawater at 28℃[J]. Aquacult,2008,276:29-35.
[23]Park B K,Lim J H,Kim M S,et al.Pharmacokinetics of florfenicol and its metabolite,florfenicol amine,in the Korean catfish(Silurus asotus)[J].Vet Pharmacol Ther,2006,29:37-40.
[24]Yanong R P E,Curis E W.Pharmacokinetic studies of florfenicol in koi carp and threepot gourami Trichogaster trichopterus after oral and intramuscular treatment[J].J Aquatic Animal Health,2005, 17(2):129-137.
[25]Martinsen B,Horsberg T E,Varma K J,et al.Single dose pharmacokinetic study of florfenicol in Atlantic salmon(Salmo salar)in seawater at 11℃[J].Aquacult,1993,112(1):1-11.
[26]Lim J H,Kim M S,Hwang Y H,et al.Plasma and tissue depletion of florfenicol in olive flounder(Paralichthys olivaceus)after oral administration[J].Aquacult,2010,307:71-74.
[27]Samuelsen O B,Bergh O,Ervik A.Pharmacokinetics of florfenicol in cod Gadus morhua and in vitro antibacterial activity against Vibrio anguillarum[J].Dis Aquat Organ,2003,56:127-133.
[28]Tang J,Yang X L,Zheng Z L,et al.Pharmacokinetics and the active metabolite of enrofloxacin in Chinese mitten-handed crab(Eriocheir sinensis)[J].Aquacult,2006,260:69-76.
[29]刘永涛,艾晓辉,杨红.不同水温下甲砜霉素在斑点叉尾鮰体内的药代动力学研究[J].水生生物学报,2009,33(1):1-6.
[30]艾晓辉,刘长征,周运涛.不同水温和给药方式下磺胺甲恶唑在草鱼体内的药动学研究[J].水生生物学报,2005,29(2): 210-214.
[31]陈菊芳,周孝治,聂湘平,等.不同给药方式下环丙沙星在模拟水生态系统中的归趋[J].生态学报,2007,27(12):5307.
[32]刘海侠,刘晓强,张振龙,等.氟苯尼考单剂量腹腔注射和灌服后在鲫鱼体内的药代动力学[J].西北农业学报,2011,20 (5):54-58.
[33]岳刚毅,吴志新,杨倩,等.氟苯尼考及氟苯尼考胺在克氏原螯虾体内的药物代谢动力学[J].水生生物学报,2011,35(2): 307-312.
Pharmacokinetics of thiamphenicol in Songpu common carp Cyprinus carpio L.
YANG Hong-bo1,2,WANG Di1,LU Tong-yan1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
The pharmacokinetics of thiamphenicol(TAP)was studied in 1+year old Songpu common carp Cyprinus carpio L.administrated orally,with body weight of(84.84±17.45)g,by liquid chromatography-mass spectrography(LC-MS)at 30 mg/kg(body weight)at water temperature of(20±0.2)℃.The drug concentrations in plasma,hepatopancreas,kidney and muscle were monitored 0.25,0.50,0.75,1.00,1.50,2.00,4.00,6.00, 8.00,12.00,24.00,36.00,48.00,and 72.00 h after drug administration,and analyzed by 3P97 software.The thiamphenicol absorption was found as a two-compartment open model with 1 st order absorption in plasma,hepatopancreas,kidney and muscle,with T1/2αof 7.317 h in plasma,0.454 h in hepatopancreas,7.409 h in kidney and 1.376 h in muscle,and T1/2βof 77.292 h in plasma,24.625 h in hepatopancreas,79.966 h in kidney and 25.600 h in muscle.The AUC was found to be 782.641 μg/(mL·h)in plasma,544.756 μg/(g·h)in hepatopancreas,3 616.060 μg/(g·h)in kidney and 158.634 μg/(g·h)in muscle.The findings reveal that the drug is suggested to be administrated at a long interval every delivery time due to long period of TAP toxin and slow elimination in plasma and kidney.
Cyprinus carpio L.;thiamphenicol;pharmacokinetics
S948
A
2012-10-29
公益性行业 (农业)科研专项 (201203085);现代农业产业技术体系建设专项资金资助项目 (CARS-46)
杨洪波 (1987-),女,硕士研究生。E-mail:yanghongbohao@126.com
卢彤岩 (1967-),女,博士,研究员。E-mail:lutongyan@hotmail.com
2095-1388(2013)03-0298-05

