苦荞发芽过程中不同部位的黄酮合成动态研究
王静波,赵 钢,赵江林,彭镰心,邹 亮,向达兵
(1.成都大学生物产业学院,四川成都610106;2.西华大学生物工程学院,四川成都610039)
荞麦又名乌麦、三角麦、花麦,是蓼科双子叶植物,主要栽培种有甜荞麦(Fagopyrum esculentum,也叫普通荞麦)和苦荞麦(Fagopyrum tataricum,也叫鞑靼荞麦)[1]。苦荞麦营养丰富,特别是含有其他粮食作物所没有的黄酮类化合物(如芦丁、槲皮素、山奈酚等),其营养价值和药用价值远高于甜荞[2-3]。但是由于其籽粒中含有高活性的胰蛋白酶抑制剂和芦丁降解酶等抗营养因子以及大量的抗性淀粉和过敏原等,从而降低了苦荞麦的营养价值[4-5]。已有研究表明,苦荞经过萌发后,营养价值大幅提高,胰蛋白酶抑制剂的活性降低,脂肪酸营养价值提高,芦丁降解酶活性在胚为子叶完全吸收后活性消失,氨基酸更为均衡,特别是黄酮类物质的含量有明显的提高[6-7]。现代研究证实,黄酮类物质具有很高的食用价值和药用价值,具有抗氧化及抗自由基、抗癌、防癌、调节心血管系统、内分泌系统、免疫系统以及护肝、抑菌、抗病毒等多种生理功能[8-9]。苦荞喜欢凉爽而湿润的气候,成熟健全的苦荞种子,在适宜的温度、足够的水分和充足的氧气的条件下,即可萌发。本文研究了苦荞在发芽过程中胚根、胚轴、子叶三个部位总黄酮含量的合成动态并对其进行分析比较,证实了苦荞芽子叶中总黄酮含量显著提高,为苦荞芽深加工中原料的选择利用提供理论依据,同时为黄酮类物质含量高的营养保健产品的研究开发提供参考依据。
1 材料与方法
1.1 材料与仪器
苦荞 西荞二号,成都大学实验田;芦丁、槲皮素 生化试剂,中国药品生物制品检定所;乙腈 HPLC级;磷酸 天津市科密欧化学试剂有限公司;甲醇分析纯。
AP-01P型真空泵 天津奥特赛恩斯仪器有限公司;DHG-9246A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;ESJ120-4型电子分析天平 沈阳龙腾电子有限公司;KH5200DE型数控超声波清洗器 昆山禾创超声仪器有限公司;岛津LC-20A型高效液相色谱仪,岛津SPD-20A型检测器,AT-330型柱温箱,N2000型色谱工作站 浙江大学智达信息工程有限公司;Diamonsil-C18色谱柱 规格4.6mm×250mm,5μm。
1.2 实验方法
1.2.1 苦荞的发芽 选择当年优质的苦荞种子,用0.1%的高锰酸钾溶液消毒2min,蒸馏水洗净,分别均匀置于铺有三层滤纸的发芽盒中,每天补充水分,在25℃,光照强度为100μmol·m-2·s-1的条件下萌发[10-11]。第3d起,每天同一时间取样,将胚根、胚轴、子叶分类,洗净,测定其长度以及干重。同时将样品烘干,粉碎,备用,取样至第11d。
1.2.2 总黄酮含量的测定 采用三氯化铝法(在420nm处比色)测定苦荞芽不同部位的总黄酮含量[12]。以芦丁为标准品绘制标准曲线。得到吸光值A与芦丁浓度C(mg/mL)的关系曲线的回归方程:A=33.865C-0.0203,R2=0.9987。根据回归方程由吸光度计算出苦荞芽不同部位提取物总黄酮含量。
1.2.3 芦丁、槲皮素含量的测定
1.2.3.1 不同部位提取液的制备 精密称取样品0.1g,加入25mL、70%的甲醇溶液,55℃条件下超声提取25min,静置放冷,经0.45μm微孔膜过滤,即得。
1.2.3.2 芦丁、槲皮素含量的测定 用反向高效液相色谱法(RP-HPLC)测定不同部位中主要黄酮类物质(芦丁、槲皮素)的含量[13-14]。色谱条件为:色谱柱:Diamonsil-C18柱(4.6mm×250mm,5μm);流动相:乙腈-0.2%磷酸溶液线性梯度洗脱(洗脱程序见表1);流速:1.0mL/min;检测波长:365nm;进样量:20μL;柱温30℃。
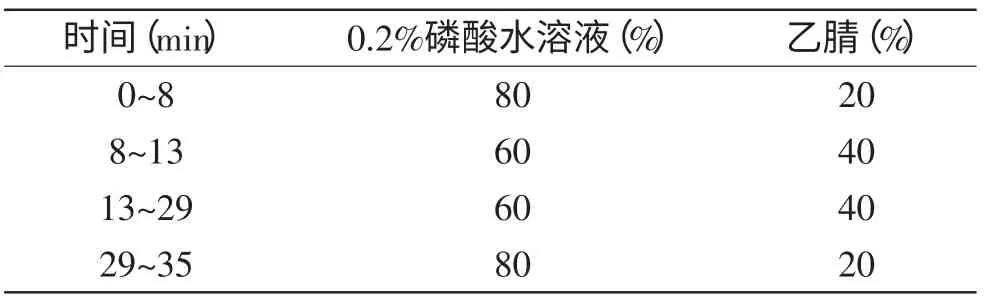
表1 梯度洗脱程序Table 1 Gradient elution program
2 结果与分析
2.1 苦荞发芽过程中不同部位长度的变化
苦荞芽生长过程中胚根、胚轴的长度变化见图1。
从图1可以看出,苦荞芽胚根和胚轴的长度,在第3~7d范围内,增加幅度较大;在第7~11d范围内,变化平稳。同时在发芽过程中,测得胚根、胚轴的长度最大值分别为:10.20、9.70cm。
2.2 苦荞发芽过程中不同部位干重的变化
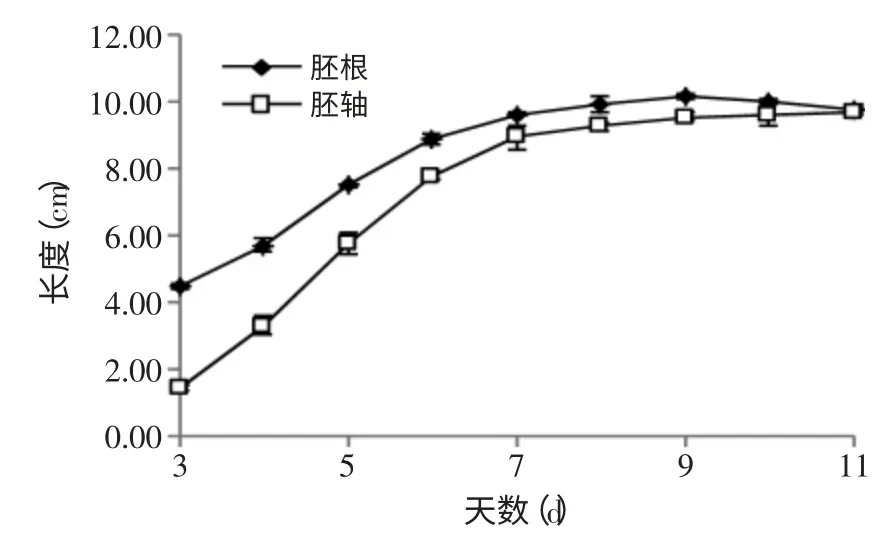
图1 苦荞发芽过程中胚根、胚轴长度的变化动态Fig.1 Kinetic Studies on the length of radicle,hypocotyl during germination process
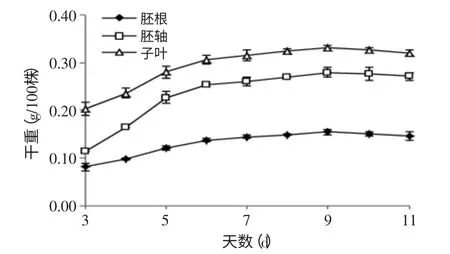
图2 苦荞发芽过程中不同部位干重的变化动态Fig.2 Kinetic Studies on dry weight of different parts during germination process
苦荞芽生长过程中不同部位的干重变化见图2。
从图2可以看出,苦荞发芽过程中胚根、胚轴、子叶的干重均在第3~6d范围内,增加幅度较大,差异性显著(p<0.05),在第7~11d范围内,变化平稳,在第9d达到最大值。苦荞芽胚根、胚轴、子叶的干重最大值分别为:0.15、0.28、0.33g/100株。且在发芽过程中,同一发芽时间,三个部位的干重含量存在显著性差异(p<0.05),且子叶的干重最大,其次是胚轴、胚根。
2.3 苦荞发芽过程中不同部位总黄酮合成动态
按1.2.2总黄酮含量的测定方法,测定苦荞芽发芽过程中不同部位的总黄酮含量,结果见图3。
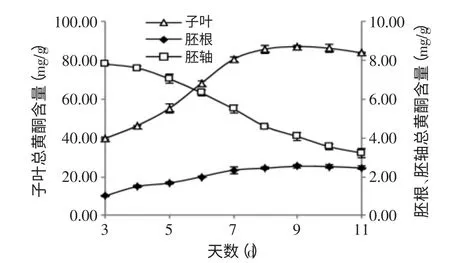
图3 苦荞发芽过程中不同部位的总黄酮合成动态Fig.3 Kinetic Studies on flavonoids of different parts during germination process
从图3中可以看出,苦荞发芽过程中,胚根、子叶的总黄酮含量在第3~9d范围内增加幅度较大,其含量存在显著性差异(p<0.05),增加至第9d时达到最大值,然后处于相对稳定水平,其总黄酮含量最大值分别为2.54、87.08mg/g;苦荞胚轴的总黄酮含量变化趋势为:随着发芽天数的增加,总黄酮含量降低。且在第4~10d范围内其含量存在显著性差异(p<0.05)。苦荞发芽过程中,在同一发芽时间,总黄酮含量子叶中最高,其次是胚轴,胚根中含量最低。且在相同发芽时间,三个部位的总黄酮含量存在显著性差异(p<0.05)。胚根总黄酮含量的变化范围为:1.01~2.54mg/g;胚轴总黄酮含量的变化范围为:3.24~7.80mg/g;子叶总黄酮含量的变化范围为:39.72~87.08mg/g。实验测得苦荞种子的总黄酮含量为:20.24mg/g,可见发芽后苦荞子叶的总黄酮含量显著提高,为种子中总黄酮含量的4.30倍。
2.4 苦荞发芽过程中不同部位芦丁、槲皮素的合成动态
按1.2.3芦丁、槲皮素的测定方法,测定苦荞发芽过程中不同部位的芦丁、槲皮素含量,结果见图4、图5。
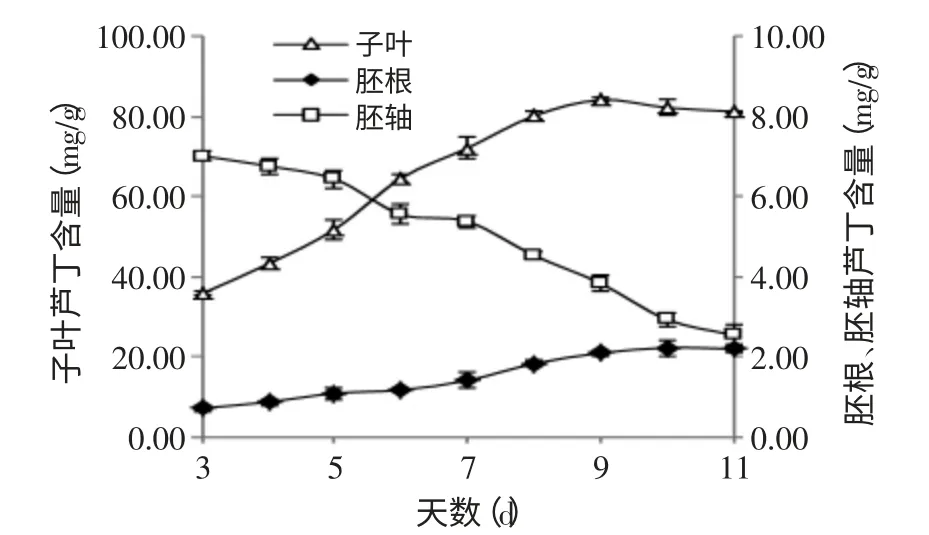
图4 苦荞发芽过程中不同部位的芦丁合成动态Fig.4 Kinetic Studies on rutin of different parts during germination process
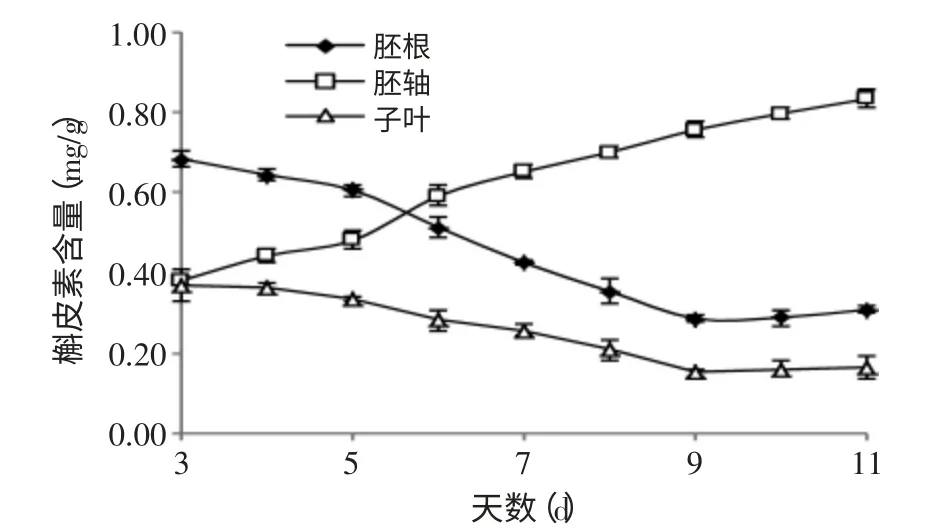
图5 苦荞发芽过程中不同部位的槲皮素合成动态Fig.5 Kinetic Studies on quercetin of different parts during germination process
从图4可以看出,苦荞发芽过程中,三个部位的芦丁含量变化趋势与总黄酮含量变化趋势相同。胚根、子叶的芦丁含量在第3~9d范围内增加幅度较大,其含量存在显著性差异(p<0.05),胚轴中的芦丁含量在3~11d范围内逐渐降低,且其含量存在显著性差异(p<0.05)。苦荞发芽过程中,在同一发芽时间,芦丁含量子叶中最高,其次是胚轴,胚根中含量最低。且在相同发芽时间,第11d时,胚根、胚轴的芦丁含量无显著性差异(p<0.05),其余时间三个部位的芦丁含量存在显著性差异(p<0.05)。其胚根的芦丁含量变化范围为0.71~2.23mg/g、胚轴的芦丁含量的变化范围为2.54~7.02mg/g、子叶的芦丁含量的变化范围为35.84~84.23mg/g。
从图5可知,胚根、子叶中的槲皮素含量在3~9d范围内逐渐降低,且在第4~9d范围内降低幅度较大,含量存在显著性差异(p<0.05)。第9d后处于相对稳定水平;胚轴中的槲皮素含量逐渐升高,且其含量存在显著性差异(p<0.05)。苦荞发芽过程中,在同一发芽时间,第3d时,胚轴、子叶中的槲皮素含量无显著性差异(p<0.05),其余时间三个部位的槲皮素含量存在显著性差异(p<0.05)。其胚根的槲皮素含量变化范围为:0.29~0.68mg/g,胚轴的槲皮素含量的变化范围为0.38~0.83mg/g,子叶槲皮素含量的变化范围为0.15~0.37mg/g。由以上结果可知,苦荞芽中的黄酮类物质以芦丁为主,因而对芦丁的有效保持和利用具有重要的意义。
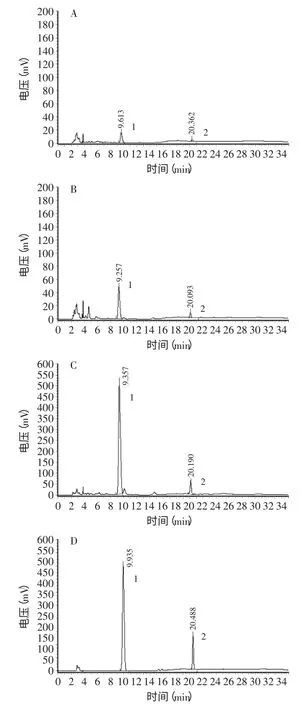
图6 芦丁、槲皮素的色谱图Fig.6 HPLC profiles for rutin and quercetin analysis
苦荞芽胚根、胚轴、子叶提取液的芦丁、槲皮素的色谱图以及芦丁、槲皮素标准品的色谱图见图6。
3 结论
本文对苦荞发芽过程中不同部位的长度、干重变化以及总黄酮含量和主要黄酮类物质芦丁、槲皮素合成动态进行了研究。实验结果表明,胚根、胚轴、子叶的干重均在第9d达到最大值,分别为:0.15、0.28、0.33g/100株,且在同一发芽时间,胚根、胚轴、子叶的干重,子叶中最高,胚根中最低。苦荞发芽过程中,胚根、子叶的总黄酮含量,在第3~9d范围内增加幅度较大,逐渐升高至第9d时达到最大值,之后处于相对稳定水平。其总黄酮最大值分别为2.54、87.08mg/g;苦荞胚轴的总黄酮含量变化趋势为:随着发芽天数的增加,总黄酮含量降低。苦荞发芽过程中,三个部位的芦丁含量变化趋势和总黄酮含量变化趋势相同;胚根、子叶中的槲皮素含量在3~9d范围内逐渐降低,第9d后处于相对稳定水平,而胚轴中的槲皮素含量逐渐升高。苦荞芽子叶的总黄酮含量明显高于胚根和胚轴,且其含量为苦荞种子中总黄酮含量的4.30倍,其黄酮类物质以芦丁为主。苦荞芽子叶颜色为绿色,具有清香味,感官品质优良,可进行进一步的深加工研究,用于制备苦荞茶、酒等一系列保健产品,满足消费者对保健产品越来越高的要求。因而对苦荞子叶的有效利用具有重要的意义。
[1] 赵钢. 中国苦荞[M]. 北京:科学出版社,2009:1-10.
[2] 张璟,欧仕益. 荞麦的营养价值和保健作用[J]. 粮食与饲料工业,2000(11):44-45.
[3] 唐丽华,王登良. 苦荞茶的功能研究进展[J]. 广东茶业,2011(6),15-17.
[4] Ikeda K,Kusano T. Purification and properties of trypsin inhibitors from buckwheat seed[J]. Agric Biol Chem,1983,47(7):1481-1486.
[5] 孙军涛,任顺成,查磊. 萌发对荞麦籽粒营养成分的影响研究进展[J]. 河南农业科学,2008(3):17-19.
[6] 蔡马. 萌发对荞麦营养成分的影响研究[J]. 西北农业学报,2004,13(3):18-21.
[7] 张美莉,吴继红,赵镭,等. 苦荞和甜荞萌发后脂肪酸营养评价[J]. 中国粮油学报,2006,20(3):44-47.
[8] 王小芳,董晓宁,付威君,等. 苦荞化学成分分析及药理作用的研究进展[J]. 国外畜牧学-猪与禽,2011,31(1):81-83.
[9] 赵钢,唐宇,马荣. 苦荞麦的营养和药用价值及其开发利用[J]. 农牧产品开发,1999(7):17-18.
[10] 贾婷,赵钢,彭镰心,等. PEG-6000引发对苦荞种子萌发及幼苗生长的影响[J]. 成都大学学报:自然科学版,2012,31(1):1-3.
[11] 牛保山. 浅谈苦荞麦的栽培技术及其开发利用[J]. 科技情报开发与经济,2011,21(12):145-147.
[12] 李为喜,朱志华,李国营,等. AlCl3分光光度法测定荞麦种质资源中黄酮的研究[J]. 植物遗传资源学报,2008,9(4):502-505.
[13] 穆春旭,孙兰凤,张振秋. 高效液相色谱波长切换法同时测定桑叶中多指标成分的含量 [J]. 黑龙江医药,2012,25(3):339-341.
[14] 黄兴富,黎其万,刘宏程,等. 高效液相色谱法同时测定苦荞中芦丁、槲皮素和山柰酚的含量[J]. 中成药,2011,33(2):345-347.

