液体发酵生产古尼虫草多糖的营养条件优化
刘晓翠,朱振元,孙会轻,李园园,代丽翠,张静怡,吕 茜,高 辉
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
古尼虫草[Cordyceps gunnii(Berk.)Berk.]是寄生于蝙蝠蛾幼虫的一种较大型虫草[1],1983年我国首次报道了古尼虫草[2]。实验证明古尼虫草与冬虫夏草的95%乙醇浸液在紫外下光谱基本一致;虫草与发酵所得的虫草菌丝体具有相同的药理作用[3-4],并且古尼虫草菌丝体含有较多的虫草多糖,因此继冬虫夏草之后,古尼虫草逐渐成为另一种重要的虫草资源[5-10]。虫草多糖是虫草中重要的活性物质,当前主要研究其提取纯化方法、结构、生物活性及作用机理[11-14]。李连德等[15]和许建明等[16]研究证明了古尼拟青霉小孢变种菌丝体胞内多糖具有延缓果蝇成虫的寿命作用,还可以减轻肝细胞坏死和肝脏炎症。本实验室在前期研究中,从古尼虫草菌丝体中得到两种分子量分别约为10ku和3700ku的单一成分多糖;体内抗肿瘤活性研究表明,这两种多糖均具有抗肿瘤作用,但大分子的虫草多糖对肿瘤细胞的抑制率高于较小分子的虫草多糖[17-20]。长期以来人们很重视通过优化发酵条件提高真菌菌丝生长,近年来国内外的科技工作者开始初步涉及到发酵条件影响真菌多糖的形成。Chi-Hsein Chao等[21]研究了培养基的不同碳源和初始pH影响榆硬孔菌菌丝体多糖的理化性质;Chin-Hang Shu等[22]研究了pH条件影响牛樟菇菌丝体发酵胞外多糖产量和分子量。有关古尼虫草的深层发酵的研究已有很多[23-24],但发酵条件对古尼虫草多糖产量影响的研究还未见报道。因此,本文在前期研究的基础上,主要对液体发酵过程中影响古尼虫草多糖产量的营养条件进行优化,属于对现代资源与功能生物的研究,这对多糖产量及其利用率的提高具有显著的意义。
1 材料与方法
1.1 材料与仪器
古尼虫草菌(Cordyceps gunnii) 取自于天津科技大学生物资源与功能食品实验室保藏菌种;斜面培养基 马铃薯琼脂(PDA)培养基;种子培养基 蔗糖2%,蛋白胨1%,KH2PO40.3%,MgSO4·7H2O 0.1%,pH均为自然,121℃灭菌20min;基础发酵培养基 蔗糖4%,蛋白胨1.5%,KH2PO40.05%,MgSO4·7H2O 0.1%,pH均为自然,121℃灭菌20min(注:以上各样品浓度均为质量浓度)。
GHX-9160B-1型隔水式恒温培养箱 上海福玛实验设备有限公司;LS-B50L型立式压力蒸汽灭菌器
上海华线医用核子仪器有限公司;超净工作台 苏净集团安泰公司;ESJ2054型电子分析天平 沈阳龙腾电子称量仪器有限公司;TGL-16B型台式离心机 上海安亭科学仪器厂;HJ6型多头磁力加热搅拌器 常州国华电器有限公司;HH型数显恒温水浴锅 金坛市金城国胜实验仪器厂;电热鼓风干燥箱 余姚市远东数控仪器厂;冷冻干燥机 美国Thermo。
1.2 实验方法
1.2.1 菌种活化 取保存于4℃冷藏冰箱中PDA斜面上的古尼虫草菌种,采用PDA试管斜面培养法进行活化,培养完成后,作为液体发酵种子液的母种供后续实验使用。
1.2.2 种子液的培养 按配方配制种子培养液灭菌晾凉后,无菌操作台中用接种针挑取0.25cm2的古尼虫草斜面菌种到液体种子培养基中。置于170r/min的恒温摇床中25℃培养3d。实验中所有三角瓶的装液量均为100mL/250mL。
1.2.3 碳源单因素实验
1.2.3.1 碳源种类对古尼虫草多糖产量的影响 在基础培养基的基础上,分别加入4%的葡萄糖、蔗糖和可溶性淀粉作为三种不同的碳源,其他成分及含量不变。每组设置三个平行实验。
按8%的接种量接种古尼虫草的种子液后,置于170r/min的恒温摇床中25℃培养5d。培养结束后采集菌丝体,冻干,对其菌丝体生物量及胞内多糖产量进行测量,并求平均值。
1.2.3.2 碳源初始浓度对古尼虫草多糖产量的影响根据1.2.3.1实验结果,选择其中最好的一种作为碳源,进行初始浓度的影响实验。按照基本培养基的要求,配制成碳源质量浓度分别为1%、2%、3%、4%、5%的培养基,其他成分及含量不变。每组设置三个平行实验。接种量、培养条件及对菌丝体的处理同1.2.3.1。
1.2.4 氮源单因素实验
1.2.4.1 氮源种类对古尼虫草多糖产量的影响 在基础培养基的基础上,分别加入1.0%的牛肉膏、酵母膏和蛋白胨作为三种不同的氮源,其他成分及含量不变。每组设置三个平行实验。接种量、培养条件及对菌丝体的处理同1.2.3.1。
1.2.4.2 氮源初始浓度对古尼虫草多糖产量的影响根据1.2.4.1的实验结果,选择则其中最好的一种作为氮源,进行初始浓度影响的实验。按照基本培养基的要求,配制成氮源质量浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%的培养基,其他成分及含量不变。每组设置三个平行实验。接种量、培养条件及对菌丝体的处理同1.2.3.1。
1.2.5 正交实验 在单因素实验的基础上,对影响古尼虫草胞内多糖产量的营养条件进行四因素三水平L9(34)正交实验,各因素的实验水平见表1。其中因素C、D是在本实验室他人研究的基础上确定的。
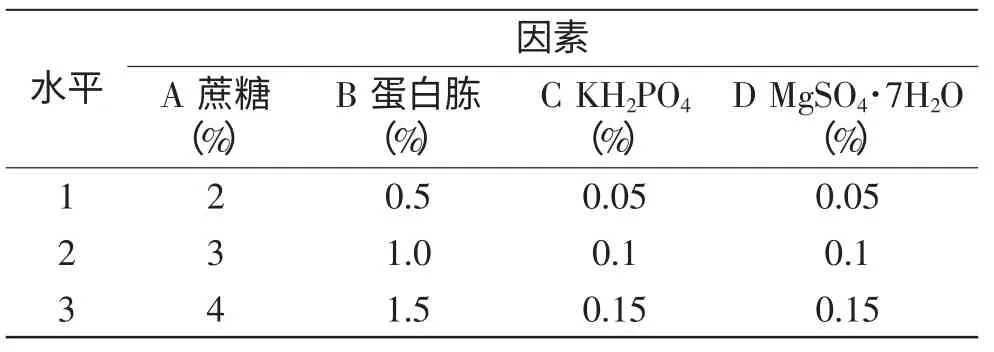
表1 正交设计因素水平表Table 1 Levels and factors table of orthogonal experiment
1.2.6 发酵产物菌丝体的处理 恒温摇床培养后,观察菌丝体生长量和形态。将三角瓶中菌丝体和培养基一起分装到50mL的离心管中,6000r/min离心10min后弃上清液,收集沉淀(即发酵所得的古尼虫草菌丝体)。为避免培养基中多糖等成分对糖含量或干重的影响,再对所得沉淀进行抽滤处理,在抽滤过程中用蒸馏水冲洗沉淀3~4次,将菌体上附着的液体培养基冲洗干净。所得沉淀冷冻干燥。
菌丝体生物量是本实验测量指标之一,因此对冻干后的菌丝体称重。菌丝体生物量的计算公式[25]见式(1):

式中,μ:菌丝体生物量(mg/100mL);m1:100mL培养基产出的干菌丝质量(mg);V:培养液体积(100mL)。
1.2.7 古尼虫草粗多糖的提取制备 取各配方所生产的虫草菌丝粉,放入样品瓶中,加入20倍的水,混匀,80℃沸水浴提取2h。布氏漏斗抽滤,取滤液,滤渣重复提取2次,合并滤液,浓缩后加4倍体积的95%乙醇4℃沉淀过夜;4000r/min离心8min后,收集沉淀,经冷冻干燥得粗多糖。
采用苯酚-硫酸法测定粗多糖样品中总糖的含量,采用3,5-二硝基水杨酸(DNS)法测定样品中还原糖含量。多糖产量计算公式[26]见式(2)。

式中,μ′:多糖产量(mg/100mL);m2:100mL培养基产出的总粗多糖质量(mg);m3:100mL培养基产出的还原糖质量(mg);V′:培养液体积(100mL)。
1.2.8 多糖回收率实验 选择无水葡萄糖作为碳源,采用同一培养基的发酵产物,1、2两组均称取0.3g的古尼虫草菌丝体粉末,2组样品作为实验组在定容时加入烘干至恒重的葡萄糖粉末31.0mg。用苯酚-硫酸法分别测量多糖含量后计算回收率,其公式[27]见式(3)。
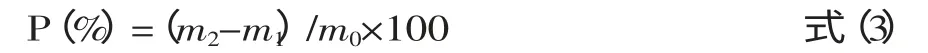
式中,P为样品加标回收率;m1为未加标试样测定质量(mg);m2为加标试样测定质量(mg);m0为加标质量(mg)。
2 结果与分析
2.1 碳源种类对菌丝体生物量及多糖产量的影响
在微生物培养基中,最常用的碳源是葡萄糖、蔗糖、可溶性淀粉,其对古尼虫草菌丝体生物量及多糖产量影响的实验结果如表2所示,当碳源为可溶性淀粉时,菌丝体生物量相对较高,但是在培养基配制过程中发现,淀粉溶于培养基之后,培养基呈浑浊状态,且在摇床培养期间,三角瓶底部有一层白色沉淀,最后在对发酵液进行离心和抽滤处理时,也不能完全保证将沉淀洗净,结果所得胞内多糖产量最低;当碳源为蔗糖时,菌丝体生物量相对较高,且胞内多糖产量达到184.08mg/100mL,因此选择蔗糖作为碳源继续进行碳源浓度实验。

表2 碳源种类对古尼虫草菌丝体生物量及多糖产量的影响Table 2 Effect of Carbon source types on mycelium biomass and polysaccharide production of Cordyceps gunnii
2.2 蔗糖浓度对菌丝体生物量及多糖产量的影响
不同蔗糖浓度对菌丝体生物量及多糖产量影响的实验结果见表3,当蔗糖质量浓度为4%时,菌丝体生物量及胞内多糖产量均达到最高,分别为1732.0、147.40mg/100mL,因此选择蔗糖浓度为4%作为碳源浓度。
碳源单因素优化实验结果为:碳源种类为蔗糖,质量浓度为4%。
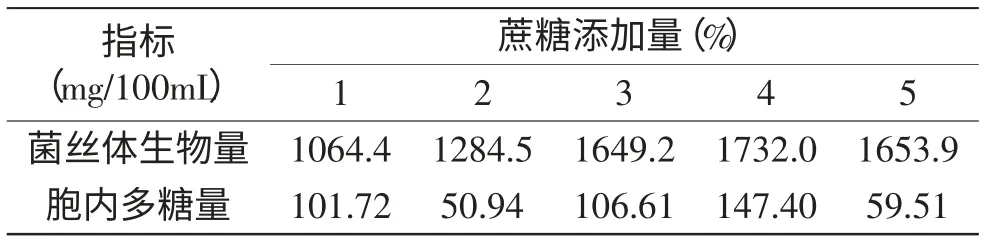
表3 蔗糖浓度对古尼虫草菌丝体生物量及多糖产量的影响Table 3 Effect of sucrose concentration on mycelium biomass and polysaccharide production of Cordyceps gunnii
2.3 氮源种类对菌丝体生物量及多糖产量的影响
本实验室前期研究中,采用了NaNO3和(NH4)2SO4作为氮源培养古尼虫草,其产出的菌丝体生物量分别为:755.2、707.6mg/100mL,胞内多糖产量分别为43.3、50.7mg/100mL,产量都不高,且为了与碳源种类数统一,本实验选择了三种常用有机氮源来进行氮源种类的筛选。实验结果如表4所示,当蛋白胨作为氮源时,菌丝体生物量及胞内多糖的产量最高,分别为1357.7、98.87mg/100mL,因此选择蛋白胨作为氮源继续进行氮源浓度实验。

表4 氮源种类对菌丝体生物量及多糖产量的影响Table 4 Effect of nitrogen source types on mycelium biomass and polysaccharide production of Cordyceps gunnii
2.4 蛋白胨浓度对菌丝体生物量及多糖产量的影响
不同蛋白胨浓度对菌丝体生物量及多糖产量影响的实验结果如表5所示,当蛋白胨质量浓度为1.0%时,菌丝体生物量及胞内多糖产量均达到最高,分别为869.4、102.49mg/100mL,因此选择蛋白胨浓度1.0%作为氮源浓度。
氮源单因素优化实验结果为:氮源种类为蛋白胨,质量浓度为1.0%。

表5 蛋白胨浓度对菌丝体生物量及多糖产量的影响Table 5 Effect of peptone concentration on mycelium biomass and polysaccharide production of Cordyceps gunnii
2.5 正交实验结果
以多糖产量为指标,进行4因素3水平正交实验,结果如表6所示。由极差R值大小可知,各因素作用主次为A>C>B>D,表明蔗糖浓度对胞内多糖产量的影响最大。根据K值比较,以A3B2C1D2组合为胞内多糖产量的最佳工艺条件,即蔗糖4%,蛋白胨1.0%,KH2PO40.05%,MgSO4·7H2O 0.1%。方差分析如表7所示,蔗糖浓度对胞内多糖产量有显著性的影响,因此在发酵条件优化时要首先予以考虑。
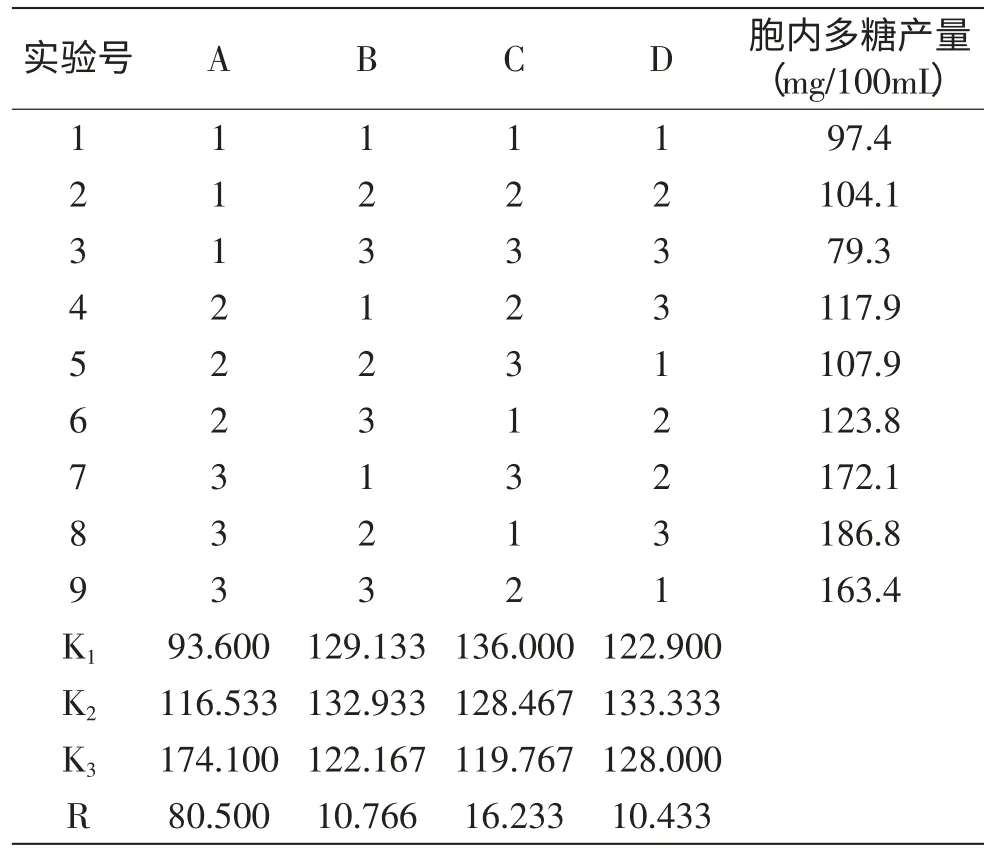
表6 正交实验结果Table 6 The results of orthogonal experiment

表7 方差分析表Table 7 Variance analysis of orthogonal test
2.6 实验验证
为了确定最佳组合的效果,进行了验证实验,将正交实验得到的最佳工艺组合A3B2C1D2与优化前基础培养基(蔗糖4%,蛋白胨1.5%,KH2PO40.05%,MgSO4·7H2O 0.1%)在相同条件下培养,比较胞内粗多糖产量的大小。设置三个平行实验,热水浸提多糖,重复三次,苯酚硫酸比色法测定多糖含量,计算胞内多糖产量,结果如表8所示:

表8 验证实验结果Table 8 Validation test results of orthogonal design
从表8可以看出,当培养基配方为优化培养基A3B2C1D2组合时,古尼虫草胞内多糖产量为(181.5±2.3)mg/100mL,而当培养基配方为基础培养基时,古尼虫草胞内多糖产量为(141.4±2.4)mg/100mL,可得出,优化后的培养基的胞内多糖产量提高了28.36%,优化作用显著(p<0.05)。故最佳工艺条件为:蔗糖4%,蛋白胨1.0%,KH2PO40.05%,MgSO4·7H2O 0.1%。
2.7 回收率测定
回收率实验结果见表9。回收率=99.39%。证明本实验所用方法的系统误差较小,适合本研究。由于菌丝体培养周期较长,本实验只进行了一次回收率测定,理论上最少重复三次实验。
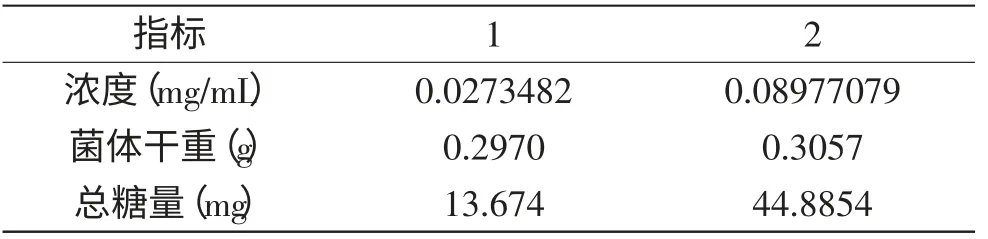
表9 回收率实验结果Table 9 The results of recovery test
3 结论
本文通过单因素实验和正交实验,确定液体发酵古尼虫草多糖的最佳工艺条件为蔗糖4%,蛋白胨1.0%,KH2PO40.05%,MgSO4·7H2O 0.1%。在此条件下,古尼虫草胞内多糖产量为(181.5±2.3)mg/100mL。庶糖浓度对发酵结果具有显著性影响,在对发酵条件进行优化时应首先予以考虑。回收率为99.39%,证明本实验所用方法的系统误差较小,适合本研究。
此外,本研究中,在最佳单因素实验条件下,古尼虫草菌丝体生物量为869.4mg/100mL,胞内多糖产量为102.49mg/100mL,即多糖含量为117.89mg/g菌丝体,与孟祥贤[28]研究结果中多糖含量28.2mg/g及傅岚研究结果中多糖含量41.92mg/g相比较,已有了很大程度的提高,可为大量获得古尼虫草多糖提供理论和技术指导。
通过对菌丝体生物量与多糖产量的对比发现,两者没有相关性(除氮源种类组外),因此古尼虫草菌丝体内除了多糖外,还含有其他活性物质。
本课题存在需进一步解决的问题,如对液体发酵古尼虫草多糖过程中环境条件的优化,有待于进一步研究。
[1] 刘爱英,梁宗琦,曹蕾. 古尼虫草人工培养物的营养成分含量分析[J]. 贵州农业科学,1991,8(2):5-8.
[2] 梁宗琦. 一种国内未见报道的虫草菌--古尼虫草[J]. 菌物学报,1983,3(4):258-260.
[3] 张永明,张倩,梁宗琦. 古尼虫草的研究现状与发展动态[J].贵州农业科学,2006,34(2):121-123.
[4] 王尊生,俞永信,袁勤生. 虫草属真菌的生物活性成分[J].中草药,2004,35(10):8-11.
[5] 肖建辉,方宁,肖瑜,等. 古尼拟青霉胞外多糖的免疫抑制活性[J]. 中药材,2004,27(3):192-195.
[6] 肖建辉,梁宗琦,胡锡阶,等. 古尼虫草多糖及其解聚物的免疫活性[J]. 免疫学杂志,2005,21(1):51-54.
[7] 梅德强,文庭池,梁宗琦. 古尼拟青霉菌丝体多糖(MPPG)对肿瘤细胞产生免疫抑制因子的影响[J].贵州大学学报,2006,23(2):191-195.
[8] Blobe G C,Sch Iemann W P,Lod Ish H F. Role of transforming growth factor in human disease[J]. N Engl J Med,2000,342(18):1350-1358.
[9] Teraoka H,Sawadda T,Yamashita Y,et al. TGF-betal promotes liver metastasis of pancreatic cancer by modulating the capacity of cellular invasion[J].Int J Oncol,2001,19(4):709-715.
[10] 张倩,张永明,陆卫群,等. 古尼虫草多糖改善小鼠学习记忆作用的研究[J]. 营养学报,2007,29(4):393-396.
[11] Kim C S,Lee S Y,Cho S,et al. Cordyceps militaris induces the IL-18 expression via its promoter activation for IFN-γ production[J]. Journal of Ethnopharmacology,2008,120(3):366-371.
[12] Leung P H,Zhao H,Ho K P,et al. Chemical properties and a ntioxidant activity of exopolysaccharides from mycelial culture of Cordyceps sinensis fungus Cs-HK1[J]. Food Chemistry,2009,114(4):1251-1256.
[13] Liu Y S,Leung P H,Wu J Y. Exopolysaccharide production in batch and semi-continuous fermentation of Cordyceps sinensis[J]. Journal of Biotechnology,2008,136(S1):S301-S302.
[14] Wu Y L,Hu N,Pan Y J,et al. Isolation and characterization of a mannoglucan from edible Cordyceps sinensis mycelium[J].Carbohydrate Research,2007,342:870-875.
[15] 李连德,樊美珍,李增智. 14种虫草多糖对果蝇成虫寿命影响的实验[J]. 微生物学通报,2000,27:427-428.
[16] 许建明,丁长海,李连德,等.冬虫夏草多糖保护小鼠免疫性肝损伤的筛选研究[J]. 安徽医科大学学报,1999,34:173-175.
[17] Zhu Z Y,Si C L,Zhong Y R,et al. The purification and antioxidative activities in D-galactose-induced aging mice of a water-soluble polysaccharide from cordyceps gunnii(berk.)berk. mycelium[J]. Journal of Food Biochemistry,2011,35(1):303-322.
[18] Zhu Z Y,Liu N,Si C L,et al. Structure and anti-tumor activity of a high-molecular-weight polysaccharide from cultured mycelium of Cordyceps gunni[J]. Carbohydrate Polymers,2012,88:1072-1076.
[19] Zhu Z Y,Chen J,Si C L,et al. Immunomodulatory effect of polysaccharides from submerged cultured Cordyceps gunnii[J].Pharmaceutical Biology,2012,50(9):1103-1110.
[20] 朱振元,原静,李盛峰,等. 古尼虫草多糖硫酸酯化修饰及其抗氧化活性[J]. 现代食品科技,2011,27(1):1-5.
[21] Chao C H,Wu H J,Lu M K. Promotion of fungal growth and underlying physiochemical changes of polysaccharides in Rigidoporus ulmarius,an edible Basidiomycete mushroom[J].Carbohydrate Polymers,2011,85:609-614.
[22] Shu C H,Lung M Y. Effect of pH on the production and molecular weight distribution of exopolysaccharide by Antrodia camphorata in batch cultures[J]. Process Biochemistry,2004,39:931-937.
[23] 曹蕾,梁宗琦,刘爱英. 营养条件对古尼虫草菌丝体生长量的影响[J]. 贵州农业科学,1991(3):5-8.
[24] 傅岚,黄红英,陈作红. 古尼虫草液体深层发酵条件的研究[J]. 湖南师范大学:自然科学学报,2004,27(2):71-74.
[25] 徐桂香,周广麒,王世龙. 蚕蛹虫草液体培养基的研究[J].大连轻工业学院学报,1997,16(4):14-18.
[26] 王飞,陈柳萌,肖婧,等. 北虫草液体发酵产多糖培养基优化研究[J]. 江西农业学报,2007,19(5):86-87.
[27] 宋树成,郭如侠. 浅谈样品加标回收率[J]. 水科学与工程技术,2011(4):92-93.
[28] 孟祥贤,张志光,刘选明,等. 古尼虫草生理活性物质的检测与分析[J]. 湖南大学学报:自然科学版,2002,29(1):13-17.

