粪肠球菌的群体感应现象
塔 娜,贺银凤
( 内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
乳酸菌是目前世界上公认安全的食品级微生物,且是一种广泛应用于食品工业生产的革兰氏阳性细菌。细菌素是乳酸菌在代谢过程中产生的一类蛋白类抗菌物质,可在体内被蛋白酶消化[1],并对与其遗传关系相近的细菌具有溶菌或杀菌作用[2]。群体感应(quorum sensing,QS),是细菌根据种群密度大小进行胞内或胞间信息传递,调节群体行为和调控基因表达的一种机制[3]。它利用可在细胞间扩散的信号分子来感知菌群的数量变化,在信号分子的浓度到达一定数值时将启动其相关的基因表达,调控与之相关生物学功能[4],是乳酸菌与外界环境进行信息交流的重要调控系统,特别是与细菌素合成有关的QS 机制,因此对它的研究有助于构建食品级基因表达系统并解释发酵调控机理。QS 机制最先在费氏弧菌(Vibrio fischeri)中被发现,其主要组分为LuxI-LuxR 蛋白,并用信号分子N-酰基高丝氨酸内酯(acyl-homoserine lactones,AHLs)进行传递[5]。而在革兰氏阳性菌(G +)中,细胞与细胞间的信号传导是通过分泌修饰后的小分子寡肽类物质(Autoinducing peptides,AIP)完成的[6]。与具有种特异性的AHLs 和AIP 这两类信号分子不同,二型自诱导物(autoinducer 2,AI-2)是种间细胞交流的通用信号分子。本实验研究对象是采样于内蒙古锡林郭勒盟地区牧民家庭自制酸马奶酒中的各株乳酸菌。贺银凤等已对样品进行了乳酸菌的分离和抗菌活性的探究,对其中筛选出的抑菌活性最强的两株菌:肠膜明串珠菌葡聚糖亚种3-3-2 和粪肠球菌4-3-2,研究了其影响抑菌活性物质产生的因素,抑菌谱,细菌素的粗提及粗提物理化特性,并探讨了这两株菌最佳培养基配比、提取与纯化具有抑菌活性的物质及其在巴氏乳中防腐保藏方面的运用,且从乳酸菌与酵母菌共生关系上对发酵产品的发酵机理做了进一步的阐述。但是在实验过程中时有抑菌性消失的现象,因此设计了本实验。
1 材料与方法
1.1 材料与仪器
粪肠球菌4-3-2(enterococcus faecalis):本课题实验用菌,分离于酸马奶酒,用于群体感应现象研究,酸马奶酒课题组提供;枯草芽孢杆菌(bacillus subtilis):用于牛津杯法的指示菌,内蒙古农业大学微生物实验室提供;MRS 培养基[7]用于枯草芽孢杆菌活化的培养液,准确称取蛋白胨1g、牛肉膏1g、酵母提取物0.5g、磷酸氢二钾0.2g、无水乙酸钠0.5g、柠檬酸铵0.2g、碳酸钙0.025g、盐液A 0.5mL,吐温-80 0.1g、将其溶在100mL 蒸馏水中,将pH 调至7~7.2,在121℃,15min 灭菌备用;TPY 培养基[7]用于粪肠球菌的培养,准确称取胰蛋白胨0.8g、大豆蛋白胨0.8g、酵母提取物0.5g、NaCl 0.5g、磷酸二氢钾0.3g、六水合氯化镁0.05g、半胱氨酸盐酸盐0.05g、七水合硫酸亚铁0.001g、吐温-80 0.1g、葡萄糖3g,将其溶在100mL 蒸馏水中,将pH 调至6.5,在121℃,15min 灭菌备用。

表1 实验的9 种不同培养条件Table 1 Nine different kinds of culture conditions in experiment
LXJ1IB 型离心机 上海领成生物科技有限公司;Uvmini-1240 紫外可见分光光度计 北京普析通用仪器有限公司;TOLEDO FE20 酸度计 德国赛多利斯;旋转蒸发仪 上海岛通应用科技有限公司。
1.2 实验方法
1.2.1 样品的制备 按2%的接种量将4-3-2 接入无菌TPY 培养基中,37℃培养24h,连续活化3d。4℃保存备用。
1.2.2 抑菌活性的检测 用牛津杯法[8]测定抑菌活性。
1.2.3 对菌体生长及细菌素H 的变化过程研究 按2%接种量将菌株4-3-2 接入到TPY 培养基中,37℃培养48h,每隔4h 取样测定菌体湿重、OD600nm值、发酵上清液的抑菌活性。每隔6h 取样用平板计数法测定菌落总数。将发酵液3000r/min 离心20min 后除去菌体,留取上清液,即为含有细菌素H 的粗制液。以发酵时间为横坐标,菌体湿重和H 抑菌直径为纵坐标,绘制细菌素H 动态变化过程曲线。再以发酵时间为横坐标,OD600nm值和细菌总数为纵坐标,绘制菌体生长曲线。
1.2.4 确定细菌素生成的最低菌群密度实验 通过改变培养温度的高低和培养基营养的富寡,设置九种培养条件来改变细胞密度。按表1 中所述的条件培养48h,每隔6h 分别取样测定在不同培养条件的不同时间段内的菌体湿重及菌株的抑菌活性。根据实验结果得出不产生细菌素的条件,以此为细菌素H 产生的低密度培养条件,即阈值。
1.2.5 不同浓度的信号分子对菌株抑菌活性的影响按2%接种量将菌株4-3-2 接入到TPY 培养基中,因为其在不同的时间有不同的菌体密度,信号分子浓度亦会随菌体密度的改变而改变,所以在培养到6、12、24、36h 时将发酵液3000r/min 离心20min后获得上清液,视为含有不同浓度信号分子的溶液。信号分子可能是蛋白质或肽类物质,这在后续的实验中会得到验证。在低密度(即阈值)条件下培养4-3-2 至对数生长期(8h),分别在发酵液中加入以上不同浓度信号分子溶液(×10 浓缩),继续培养24h,研究细菌素积累量的变化。以未发酵的培养基作为对照。
2 结果与分析
2.1 菌体生长及产细菌素H 动态变化过程
如图1 所示,发酵的前8h,菌体开始进入对数生长期,细菌素H 的抑菌性随着菌体的生长开始显现,8h 之后,菌体生长进入对数生长期中后期,由于菌体4-3-2 的快速生长,细菌素H 的抑菌活性也以对数趋势增长,发酵约12h 后进入稳定期,在12~20h 内抑菌活性变化不大,于是以8~20h 做为4-3-2 产生细菌素H 的高峰期。

图1 菌株4-3-2 菌体湿重及H 产量变化曲线Fig.1 Wet weight and H yield curve of Enterococcus faecalis 4-3-2
如图2,菌株在4h 内生长极为缓慢,4h 后OD600nm值几乎是直线上升,菌株进入对数生期,12~20h 内改变不大,24h 后略有下降。每隔6h 测定菌株的菌落总数,取其值的对数作图。经过48h 培养,菌株4-3-2 的菌落总数可达到108CFU/mL。

图2 菌株4-3-2 生长曲线Fig.2 Growth curve of Enterococcus faecalis 4-3-2
2.2 不同条件下菌株4-3-2 的细胞密度与抑菌活性的关系
依照1.2.4 设计的生长条件,菌株4-3-2 的生长情况和抑菌活性不同。从图3 可以看出,温度的变化对其菌体密度有影响,但培养基的富寡是影响其生长的主要因素。用TPY 培养基进行发酵时,发酵液的OD600nm值最高可以达到2.1496,1/2TPY 次之,最大可达到1.8924,1/5TPY 最低,最大也仅能达到1.1796。从图4 可知,利用牛津杯法检测这9 种条件下的抑菌活性,得出在32、37 、42℃的1/5 TPY 培养条件下,稳定期的细胞密度为OD600nm= 1.1680、1.1896、1.1714,均小于1.2,此时无抑菌活性。因此抑菌活性的产生是依赖于细胞密度的,由此可得出阈值密度培养条件(即细菌的细胞密度低于此值就不表达抑菌活性)为:1/5TPY 培养基,37℃培养24h。
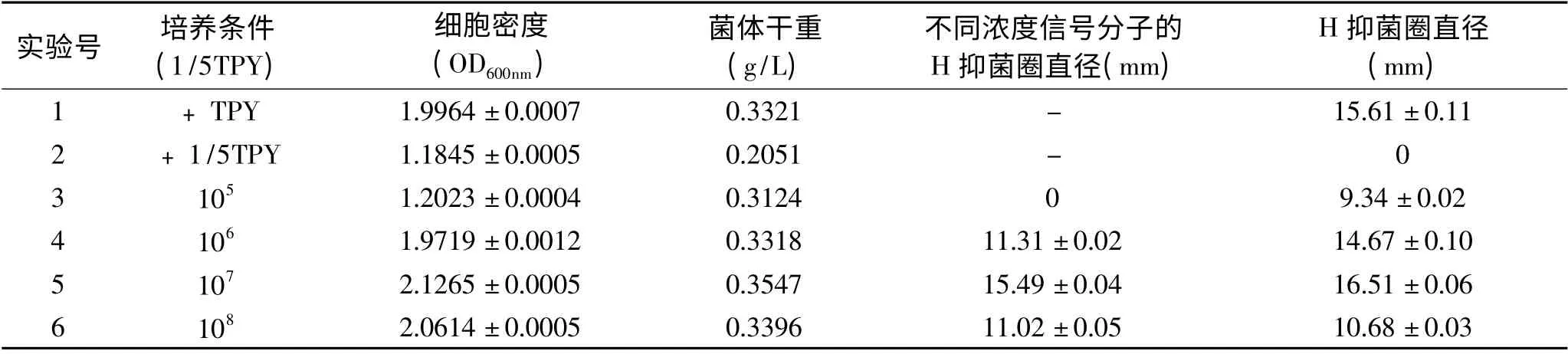
表2 添加信号分子对H 抑菌活性的影响Table 2 Effect of adding autoinducer on the antibacterial activity of H

图3 不同培养条件下4-3-2 细胞密度Fig.3 The density of 4-3-2 cells in different culture conditions
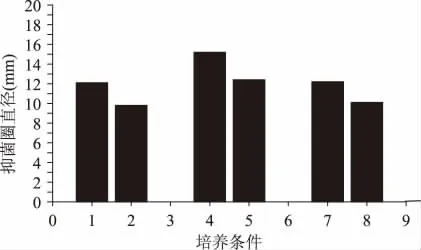
图4 不同培养条件下H 抑菌活性Fig.4 Antibacterial activity of H under different culture conditions
同一培养基在32、37、42℃培养温度下,抑菌活性在37℃时最好(抑菌直径为15.23mm,TPY 培养基,37℃),温度过高或过低都不利于抑菌物质的产生。同一培养温度在TPY,1/2TPY,1/5TPY 条件下,抑菌圈直径和细胞密度OD600nm在TPY 时最大,1/2TPY次之,1/5TPY 最低,而且菌株代谢产物的抑菌活性是随着细胞密度的升高而增大的。因此,二者的变化趋势在一定范围内成正比,且菌株4-3-2产生的细菌素H 抑菌活性的代谢是依赖于细胞密度的。
2.3 细菌素H 的浓度对抑菌活性的影响
将含有不同浓度信号分子的溶液加到阈值培养条件下的菌株发酵液进行培养,由表2 可以看出,组1 和组2 与对照样(即菌株在TPY 和1/5TPY 条件下培养)相比,菌株菌体湿重和抑菌活性的变化不大,由此可忽略培养基对抑菌活性的影响;添加105CFU/mL对4-3-2 的抑菌活性几乎没有影响,添加106、107CFU/mL 的发酵液其抑菌活性有提高,抑菌圈直径分别由原来的11.31、15.49mm 提高到14.67、16.51mm,说明信号分子对菌株抑菌活性有影响,不同浓度的信号分子确实可以提高菌体产细菌素的能力。当添加108CFU/mL 浓度的上清液时,却由11.02mm 下降到10.68mm。这有两个假设:一是在生长到某些时期抑菌活性的下降,推测是因为细菌素会附着在其菌体细胞表面;二是细菌素H 的抑菌活性仅仅在一定范围内与菌体密度成正比,过高则抑菌活性会下降[9]。
3 结论
本文通过对不同培养条件的控制,初步认为细菌素H 抑菌活性受到粪肠球菌4-3-2 发酵液的菌体密度影响。当发酵液菌体密度低于阈值时,不表现抑菌活性;当加入不同浓度发酵上清液时,细菌素H抑菌性与之成正相关。但是,这种正相关只在一定菌体密度范围内适用,当菌体密度超过这个值时,其抑菌活性没有随之增加,反而会有所降低。本实验发现,产细菌素H 的粪肠球菌发酵液中含有信号分子,且证明了信号分子为细菌素H,其自身浓度是影响细菌素产量和抑菌性的关键因素。依据此实验可知,添加不同浓度的信号分子,发酵液中细菌素H 的产量和抑菌活性会发生改变。同时,细菌素H 的抑菌活性受发酵液中菌体的群体感应系统影响,并且其本身可进行自我诱导。
[1]Svetoslav Dimitrov Todorov,Monica Wachsman,Elisabetta Tomé,et al.Characterisation of an antiviral pediocin - like bacteriocin produced by Enterococcus faecium [J] .Food Microbiology,2010,27(7) :869-879.
[2]邓梅,王俊钢,高阳,等.耐低温肠球菌Enterococcus sp.MB2-1 产细菌素的生物学特性研究[J].食品科学,2012,12(5) :1-9.
[3]Ni N,Li M,Wang J,et al.Inhibitors and antagonists of bacterial quorum sensing[J].Med ResRev,2009,29 ( 1) :65-124.
[4]S.Schauder,BL.Bassler.The languages of bacteria[J].Genes Dev,2001,15(12) :1468-1480.
[5]Pascal Hols,Frederic Hancy,Fontaine Laetitia,et al.New Insights in The Molecular Biology and Physiology of Streptococcus Thermophilus Revealed by Comparative Genomics[J].FEMS Microbiology Reviews,2005,29(3) :435-463.
[6]Antonio Maldonado,José Luis Ruiz-Barba,Rufino Jiménez-Díaz.Production of plantaricin NC8 by Lactobacillus plantarum NC8 is induced in the presence of different types of gram-positive bacteria[J].Arch Microbiol,2004,181(1) :8-16.
[7]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995.
[8]王锂韫,贺银凤,李少英,等.酸马奶酒中粪肠球菌抑菌特性的研究[J].食品科技,2006,12:15-18.
[9]石继红,赵永同,张英起.应用SDS-PAGE 显示小分子多肽技术的探讨[J].生物工程进展,2001,21(1) :38-41.

