KIR基因多态性与肝移植研究进展
李雪松,陈小平 综述 肖露露 审校
1解放军第458医院 肝胆普通外科,广东广州 510602;2广州器官移植配型中心,广东广州 510095
自然杀伤(natural killer,NK)细胞参与机体的天然免疫及获得性细胞免疫,构成机体的防御屏障,其功能主要通过表达于细胞表面的杀伤细胞免疫球蛋白样受体(killer immunoglobulin-like receptor,KIR),识别表达于靶细胞表面的HLA-I类分子,转导激活或抑制信号来调节,当靶细胞不表达或表达自我缺失的HLA-I类分子时,NK细胞被激活,发生溶细胞反应。现在,越来越多的研究表明,NK细胞在移植免疫中也扮演“多面手”的角色,参与造血干细胞、实体器官移植中急、慢性排斥反应和移植物耐受的过程[1]。目前NK细胞及其受体KIR与造血干细胞移植的报道较多,但有关KIR在实体器官移植特别是肝移植中的研究较少,其结果仍然存在不少争议,有待进一步深入探讨,现综述近年来NK细胞及其表面受体KIR在肝移植中的研究进展。
1 KIR基因遗传多态性及生物学功能
KIR基因位于人染色体19q13.4,具有高度的多态性,主要表达于NK细胞及部分T细胞表面。KIR基因编码的蛋白属免疫球蛋白超家族成员,分为胞外区、跨膜区及细胞质区,依其编码的蛋白胞外区免疫球蛋白样结构域(Ig)的数目,可分为KIR2D、KIR3D; 按细胞质区内是否含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motifs,ITIM),分为L型和S型,L型含1~2个ITIM,介导抑制信号,S型不含ITIM,介导活化信号[2]。目前已知18个KIR基因,即KIR1D、KIR2DL1-5、KIR3DL1-5、KIR3DS1、Xv、X和KIR2DP1。其中Xv、X和KIR2DP1为假基因,KIR2DL4、KIR3DL2和KIR3DL3为框架基因(见图1)。不同的KIR基因以一定的规律组合,形成KIR基因的单体型,A类型基因组合只含一种活化型KIR,即2DS4,B类型基因组合含除2DS4外的2DS1-3、2DS5、3DS1的不同组合[3-4]。NK细胞表面受体KIR主要与MHC-I类分子结合,包括HLA-C、HLA-Bw4。生理情况下,激活型KIR与MHC-I类分子的结合力很弱,而抑制型KIR的作用占主导地位(见图2)。NK细胞通过抑制型KIR识别自身的MHC-I类分子,使其处于抑制状态,防止NK细胞对自身的杀伤作用。而在病理情况下,包括肿瘤、感染,移植等状况下,靶细胞表面的MHC-I表达异常或不表达,KIR的配体缺失,于是NK细胞的抑制作用减弱,导致NK细胞激活并杀伤靶细胞[5]。
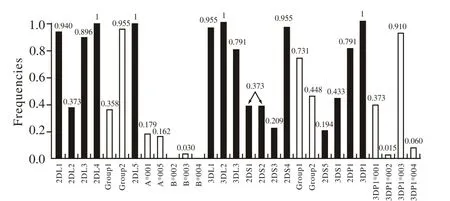
图 1 正常汉族人群KIR基因及等位基因频率[4]

图 2 抑制型KIR受体与HLA-I类分子之间的相互作用示意图[3]
2 KIR与肝移植
由于KIR和HLA-I类分子的高度多态性,临床移植时HLA/KIR不相合的情况多见,因此在造血干细胞移植中,由HLA/KIR不匹配引发NK细胞的同种异体反应性对异基因造血干细胞移植预后具有显著影响,在实体器官移植中,Velickovic等在肾移植中发现当受者有较多的激活型KIR与供者的MHC-I类分子相匹配时,受者的NK细胞对供肾的杀伤作用就会增大,但与急性排斥反应无显著关系[6-7]。这些研究成果为进一步研究NK细胞受体KIR在肝移植后移植免疫中的作用提供了理论基础。
2.1 受者NK细胞KIR对肝移植的影响在肝移植中,受者对移植物的排斥或耐受对预后起重要作用。Bishara等对34例肝移植受者进行分析,发现供者HLA-I类分子与受者NK细胞受体KIR不匹配率越高,移植后急性排斥反应的发生率也越高,其结论表明,KIR配体错配可能是肝移植后早期排斥反应发生的危险因素之一,NK细胞参与了肝移植后的早期排斥反应[8-9]。Bishara等[10]进一步研究发现,供受者HLA-C一致的受者,移植后第一年内急排反应的发生率明显低于HLA-C不一致的受者。Hanvesakul等[11]对大样本肝移植供受者的HLA-I类分子基因型进行了更进一步的研究,发现供者若含有至少一个HLA-C2等位基因,移植物慢性排斥及纤维化的发生率明显降低,移植物失活减少16.2%,10年存活率提升13.6%。这些错配分析均表明,在肝移植中HLA-C是抑制型KIR最主要的配体,HLA-C含两组等位基因,HLA-C1和HLA-C2,其中,HLA-C2对NK细胞的抑制作用更强,调节HLA-C与KIR的相互作用可能是改善肝移植物及病人长期存活的重要途径[12]。针对KIR与HLA-C的这种特异性,Tran等[12]测定了913例尸肝供者的HLA-C基因型,结果表明,供者HLA-C2基因型的存在或缺失与移植物长期存活并没有明显关系,与之前Hanvesakul等得出的结论矛盾。那么究竟供者HLA-C与KIR的相互作用是否在肝移植排斥及肝移植预后中起作用,可能还需要进行多中心、多种族人群的研究[13-15],同时,供受者错配分析结果的不吻合,提示需要去进一步探索新的研究思路。
2.2 供者NK细胞KIR对肝移植的影响由于肝移植前对供肝的灌注,使得很少人关注供者NK细胞对肝移植的影响。但肝移植后移植物抗宿主病同样有可能发生,Moroso等证实肝移植后仍有供者来源的NK细胞进入到受者体内,因此他们首次从供者NK细胞对受者采用了“配体缺失”和“自我缺失”两种经典模型,对153个供者NK细胞受体KIR及供受者对的HLA-C基因进行了测序,统计并分析HLA/KIR的错配是否对急性排斥反应、移植物存活及受者存活的影响。结果表明:没有发现供者NK细胞的KIR与受体HLA-I类分子的错配与肝移植预后相关,供者来源的NK细胞并没有在肝移植的预后中起显著作用[16-17]。
2.3 NK杀伤效应对移植后药物使用的影响Eissens等[18]在造血干细胞移植的活体及离体实验中已经发现:环孢素A、雷帕霉素及甲泼尼龙均可通过改变NK细胞表面受体的表达,影响NK细胞的表型及功能,其中CsA处理的NK细胞呈NKG2A+KIR-NCR+表型,而雷帕霉素及MPA处理的NK细胞则呈NKG2A-KIR+NCR+/-表型,并且失去了其对靶细胞的溶解作用[19],可见免疫抑制药物可通过改变NK细胞表型,限制其细胞毒性功能,减轻急性排斥反应,使移植物耐受。但是在肝移植中,过度的使用免疫抑制药物,并没有明显减少排斥反应的发生,反而增加了药物对人体的不良反应。已经发现,免疫抑制剂的应用是肝移植术后发生肾功能衰竭的最大诱因,尤其是神经钙蛋白阻滞剂(环孢素A和他克莫司)[18],已经被证实能诱导肾毒性,所以长期来看,在肝移植中,进一步研究KIR的功能及信号网络,调节NK细胞的杀伤效应,减少免疫抑制药物的使用,避免免疫抑制药物的不良反应,对在活体中发挥NK细胞的最大有利作用具有重要指导意义。
2.4 NK杀伤效应与肝移植后肾功能衰竭的影响肝移植术后急性肾功能衰竭是常见的并发症之一,也是移植术后病死率的重要影响因素之一,肾功能衰竭是多因素作用的结果,最主要的原因是移植后的缺血再灌注损伤,免疫抑制药物的肾毒性,以及感染等并发症。在急性肾损伤(acute kidney injury,AKI)的过程中,与炎症反应有关,大量的中性粒细胞、巨噬细胞及NK细胞进入肾组织,产生大量炎症介质导致肾小管的损伤。NK细胞能直接杀伤小管上皮细胞以及诱导小管上皮细胞凋亡,动物实验已证实,去除小鼠体内的NK细胞对AKI有保护作用,而被动转入NK细胞会加重小鼠的AKI[20-23]。NK细胞在肾损伤中的杀伤效应,不仅需要HLA-C的错配,同时也与其细胞表面特异性的激活KIR的表达相关。将来,如果运用特定的如单链抗体、基因沉默等技术,那么消除NK细胞对移植后肾损伤的作用值得进一步的研究。
3 展望
从目前的研究看来,NK细胞参与了移植过程,并且通过KIR及其配体之间的相互作用,可能对移植物的急、慢性排斥反应或移植物耐受发挥双面作用,但是目前对实体器官移植尤其是肝移植的影响仍然不太明了。这可能是由于目前我们对NK细胞及其KIR的生物学功能,NK细胞在移植中与其他免疫细胞间复杂的相互作用关系了解仍然受限所致。随着将来对如何控制KIR的表达以及对KIR与其配体功能的进一步研究,将对临床肝移植急性排斥反应的控制、合理免疫治疗及改善移植患者的预后有重要意义。
1 Björklund AT, Schaffer M, Fauriat C, et al. NK cells expressing inhibitory KIR for non-self-ligands remain tolerant in HLA-matched sibling stem cell transplantation[J]. Blood, 2010, 115(13):2686-2694.
2 Williams AP, Bateman AR, Khakoo SI. Hanging in the balance. KIR and their role in disease[J]. Mol Interv, 2005, 5(4): 226-240.
3 Trowsdale J. Genetic and functional relationships between MHC and NK receptor genes[J]. Immunity, 2001, 15(3): 363-374.
4 付绍杰,于立新,罗敏,等.NK细胞表面免疫球蛋白受体KIR基因的分析[J].南方医科大学学报,2009,29(1):109-113.
5 Thielens A, Vivier E, Romagné F. NK cell MHC class I specific receptors (KIR): from biology to clinical intervention[J]. Curr Opin Immunol, 2012, 24(2): 239-245.
6 Velickovic M, Velickovic Z, Dunckley H. Diversity of killer cell immunoglobulin-like receptor genes in Pacific Islands populations[J] .Immunogenetics, 2006, 58(7): 523-532.
7 Nowak I, Magott-Procelewska M, Kowal A, et al. Killer immunoglobulin-like receptor (KIR) and HLA genotypes affect the outcome of allogeneic kidney transplantation[J]. PLoS One, 2012,7(9):e44718.
8 Bishara A, Brautbar C, Eid A, et al. Killer inhibitory receptor mismatching and liver transplantation outcome[J]. Transplant Proc, 2001,33(6):2908.
9 Hsieh CL, Obara H, Ogura Y, et al. NK cells and transplantation[J].Transpl Immunol, 2002, 9(2-4):111-114.
10 Bishara A, Brautbar C, Zamir G, et al. Impact of HLA-C and Bw epitopes disparity on liver transplantation outcome[J]. Hum Immunol, 2005, 66(11): 1099-1105.
11 Hanvesakul R, Spencer N, Cook M, et al. Donor HLA-C genotype has a profound impact on the clinical outcome following liver transplantation[J]. Am J Transplant, 2008, 8(9): 1931-1941.
12 Tran TH, Middleton D, Döhler B, et al. Reassessing the impact of donor HLA-C genotype on long-term liver transplant survival[J].Am J Transplant, 2009, 9(7): 1674-1678.
13 Mendel JB, Chavin KD, Bratton C, et al. HLA-C and liver transplant outcomes: interpreting the facts[J]. Am J Transplant, 2009, 9(7):1491-1492.
14 López-Alvarez MR, Moya-Quiles MR, Minguela A, et al. HLA-C matching and liver transplants: donor-recipient genotypes influence early outcome and CD8+KIR2D+ T-cells recuperation[J].Transplantation, 2009, 88(3 Suppl):S54-S61.
15 Wilson TJ, Jobim M, Jobim LF, et al. Study of killer immunoglobulin-like receptor genes and human leukocyte antigens class I ligands in a Caucasian Brazilian population with Crohn’s disease and ulcerative colitis[J]. Hum Immunol, 2010, 71(3):293-297.
16 Muhanna N, Abu Tair L, Doron S, et al. Amelioration of hepatic fibrosis by NK cell activation[J]. Gut, 2011, 60(1):90-98.
17 Moroso V, van der Meer A, Tilanus HW, et al. Donor and recipient HLA/KIR genotypes do not predict liver transplantation outcome[J].Transpl Int, 2011, 24(9):932-942.
18 Eissens DN, Van Der Meer A, Van Cranenbroek B, et al. Rapamycin and MPA, but not CsA, impair human NK cell cytotoxicity due to differential effects on NK cell phenotype[J]. Am J Transplant,2010, 10(9):1981-1990.
19 Portela P, Jobim LF, Salim PH, et al. Analysis of KIR gene frequencies and HLA class I genotypes in prostate Cancer and control group[J]. Int J Immunogenet, 2012, 39(5): 423-428.
20 Akcay A, Nguyen Q, Edelstein CL. Mediators of inflammation in acute kidney injury[J]. Mediators Inflamm, 2009,10:1-12.
21 Lewandowska L, Matuszkiewicz-Rowinska J. Acute kidney injury after procedures of orthotopic liver transplantation[J]. Ann Transplant, 2011, 16(2):103-108.
22 Castroagudín JF, Molina E, Varo E. Calcineurin inhibitors in liver transplantation: to be or not to be[J]. Transplant Proc, 2011, 43(6):2220-2223.
23 Kreijveld E, van der Meer A, Tijssen HJ, et al. KIR gene and KIR ligand analysis to predict graft rejection after renal transplantation[J].Transplantation, 2007, 84(8): 1045-1051.

