甘蓝枯萎病菌REMI转化体系的建立
冯建海, 张 玮, 李兴红, 燕继晔*, 黄金光,3*
(1.青岛农业大学农学与植物保护学院,青岛 266109;2.北京市农林科学院植物保护环境保护研究所,北京 100097;3.山东省植物病虫害综合防控重点实验室,青岛 266109)
甘蓝枯萎病菌REMI转化体系的建立
冯建海1, 张 玮2, 李兴红2, 燕继晔2*, 黄金光1,3*
(1.青岛农业大学农学与植物保护学院,青岛 266109;2.北京市农林科学院植物保护环境保护研究所,北京 100097;3.山东省植物病虫害综合防控重点实验室,青岛 266109)
建立高效、稳定的甘蓝枯萎病菌REMI转化体系,为进一步获得特定表型突变体及基因功能研究建立技术储备。利用REMI(restriction enzyme mediate intergration)转化方法,将线性化的含有潮霉素抗性基因的pUCATPH质粒转化甘蓝枯萎病菌A6菌株的原生质体,摸索获得转化子最适的潮霉素筛选浓度以及不同限制性内切酶和酶量对转化效率的影响;利用PCR(polymerase chain reaction)技术对潮霉素抗性转化子进行验证。结果表明转化子的最适潮霉素筛选浓度为50μg/mL;转化效率较高的限制性内切酶为HindⅢ,并且转化效率最高时的酶量为20U。利用该转化体系构建了含1 050个转化子的甘蓝枯萎病菌转化子库,对转化子进行Southern验证,证明该转化体系是可行的。
甘蓝枯萎病菌; REMI; 转化子库
由甘蓝枯萎病菌(Fusariumoxysporumf.sp.conglutinans)引起的甘蓝枯萎病是一种典型的土传病害[1],受害的甘蓝在苗期即可发病,最初表现为叶脉变黄,随着病情的发展,整叶或全株变黄,进而植株变小而萎蔫,最后枯死,剖开植株的短缩茎可见维管束明显变褐。该病在大叶芥上的症状与甘蓝相似,也表现为萎蔫、黄化及枯死[2]。1895年,Smith在美国首次发现甘蓝枯萎病,该病害在美国东北部蔓延,随后在加拿大、日本等国家也相继报道[3-6],近年来,该病害在我国北京、河北等地发生并迅速蔓延[7]。生产上除抗病品种选育外,至今没有其他的有效防治措施。
基于甘蓝枯萎病危害日趋严重的现状,从分子水平上研究其致病机理,已经愈来愈受到重视。甘蓝枯萎病菌REMI转化体系的建立正是为下一步致病相关基因的研究奠定基础。限制性内切酶介导的整合技术(REMI)是1991年由Schiestl等在研究酿酒酵母(Saccharomycescerevisiae)的过程中创立的[8]。目前,REMI技术已经广泛应用于真菌尤其是植物病原真菌的研究[9-11],并因其高效性已成为病原真菌研究中的一种重要手段。本研究在掌握甘蓝枯萎病菌原生质体的制备和再生基础上[12],建立高效的甘蓝枯萎病菌REMI转化体系和构建甘蓝枯萎病菌突变体库,从而为致病相关基因的研究奠定基础。
1 材料与方法
1.1 菌株和质粒
甘蓝 枯 萎 病 菌 (Fusariumoxysporumf.sp.conglutinans)A6菌株,分离自北京市延庆县甘蓝产区,保存在北京市农林科学院植物保护环境保护研究所植物病害综合防治研究室;用于转化的质粒pUCATPH由中国农业大学彭友良教授惠赠,美国康奈尔大学构建。
1.2 主要试剂及培养基
1.2.1 主要培养基
PDA培养基:200g马铃薯,20g葡萄糖,15g琼脂,蒸馏水定容至1L。
CM液体培养基:6g酵母提取物,3g酸水解干酪素,3g酶水解干酪素,10g蔗糖,蒸馏水定容至1L。
液体再生培养基(LR):1g酵母提取物,1g酶水解干酪素,342g蔗糖,蒸馏水定容至1L。
固体再生培养基(SR):向1LLR培养基中加入15g琼脂。
以上培养基均需1×105Pa灭菌20min。
1.2.2 主要试剂
STC:1.2mol/L 山梨醇,10mmol/L Tris-HCl(pH 7.5),50mmol/L CaCl2。
PTC:60% 聚乙二醇(PEG 3350),10mmol/L Tris-HCl(pH 7.5),50mmol/L CaCl2。
0.7mol/L NaCl:40.9g NaCl,ddH2O 定容至1L。
崩溃酶(driselase):20mg/mL,用预冷0.7mol/L NaCl配制,2 000g离心10min,上清液经20μm微孔滤膜过滤后分装,-20℃保存备用。
崩溃酶、酶水解干酪素(casein enzymatic hydrolysate)、酸水解干酪素(casein acids hydrolysate)为美国Sigma公司产品;山梨醇(sorbitol)、PEG3350为美国Amresco公司产品;限制性内切酶HindⅢ、EcoRI、DNA Marker、琼脂粉为宝生物工程(大连)有限公司(TaKaRa)产品;其他常规生化试剂国产分析纯,购自北京化学试剂公司。
1.3 转化方法
向50mL离心管中分别加入150μL原生质体,2μg线性化质粒pUCATPH,限制性内切酶HindⅢ,用STC补足至每管300μL,冰上放置20min。每管逐滴加入2mL PTC溶液,冰上静置20min。每管各加入25mL预冷的STC溶液,颠倒混匀,4℃,2 000g离心15min,弃上清,每管加入3mL LR培养基,28℃静置培养12~18h后,向培养液中加入15mL 50℃左右的SR再生培养基,混匀后铺板,凝固后在平板表面覆盖10mL 50℃左右含有50μg/mL Hygromycin B的1.5%水琼脂。
1.4 潮霉素敏感性测定
用灭菌的牙签分别挑取A6菌丝接种到含有不同浓度潮霉素B的PDA培养基上,浓度梯度设定为10、20、30、40、50、60、70、80μg/mL,28 ℃培养5d后测量菌落直径,每个处理重复3次。
1.5 不同酶量对转化效率的影响
利用不同酶量的限制性内切酶HindⅢ介导转化 A6菌株,酶量分别为5、10、15、20、25、30、35U,其他条件保持不变,重复3次。
1.6 不同限制性内切酶对转化效率的影响
分别用HindⅢ和EcoRI介导转化A6菌株。所用酶量均是20U,其他条件保持不变,重复3次。
1.7 转化子的PCR鉴定
随机挑取转化菌株,以未转化的野生型菌株A6作对照。提取野生菌株和转化菌株的基因组DNA,用根据潮霉素磷酸转移酶基因设计的引物(HPTF:5′-CGACAGCGTCTCCGACCTGA-3′, HPTR:5′-CGCCCAAGCTGCATCATCG AA-3′)进行PCR扩增。PCR扩增反应程序为:94℃,3min;94℃,30s;60℃,30s;72℃,50s;32个循环,最后72℃延伸10min。PCR反应总体系为25μL,其中模板1μL,2× PCR Mix 12.5μL,上下游引物各0.5μL,ddH2O 10.5μL。PCR产物用1.0%琼脂糖凝胶电泳检测。
1.8 Southern blot验证
随机挑选9个转化子,以野生型菌株A6作为对照。大量法提取转化子和野生型菌株的基因组DNA,用潮霉素磷酸转移酶基因作为探针,HindⅢ酶切转化子和野生型菌株DNA,用HindⅢ酶切的λDNA作为Marker进行Southern blot验证。
1.9 转化子的遗传稳定性鉴定
甘蓝枯萎病菌转化菌株经过5代单孢继代培养后,转接到添加潮霉素B的PDA培养基平板上,观察生长情况。
2 结果与分析
2.1 甘蓝枯萎病菌对潮霉素B的敏感性测定
通过测量野生型A6菌株在添加不同浓度潮霉素B的PDA培养基上的菌落直径,发现随着潮霉素B浓度增大菌落生长速度逐渐减慢,在50μg/mL时菌株生长完全受到抑制(图1)。
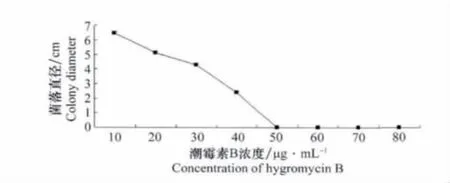
图1 不同浓度潮霉素B对A6菌株生长速度的影响Fig.1 Influence of hygromycin B at different concentration on the growth of the strain A6
2.2 不同HindⅢ酶量对转化效率的影响
由图2可知,随着酶量的增加,转化子产生的个数也逐渐增多。当酶量超过20U后转化效率没有明显提高。
2.3 不同限制性内切酶对转化效率的影响
分别用HindⅢ和EcoRI两种限制性内切酶介导转化A6菌株,酶量均为20U/管。结果表明,HindⅢ介导产生的转化体个数平均为25个/管,而EcoRI平均仅为10个/管。

图2 不同酶量对转化效率的影响Fig.2 Influence of enzymes with different amount on transformation efficiency
2.4 转化子的PCR鉴定
分别以野生型A6菌株和转化子基因组DNA为模板进行PCR检测。如图3所示,在随机挑选的9个转化子的基因组中都能够扩增得到预期大小约为750bp的目的片段,而A6菌株基因组DNA中未扩增到任何条带,表明这些转化子基因组中确实含有潮霉素磷酸转移酶基因。初步验证了潮霉素磷酸转移酶基因已转化并整合入野生型菌株的基因组DNA中。
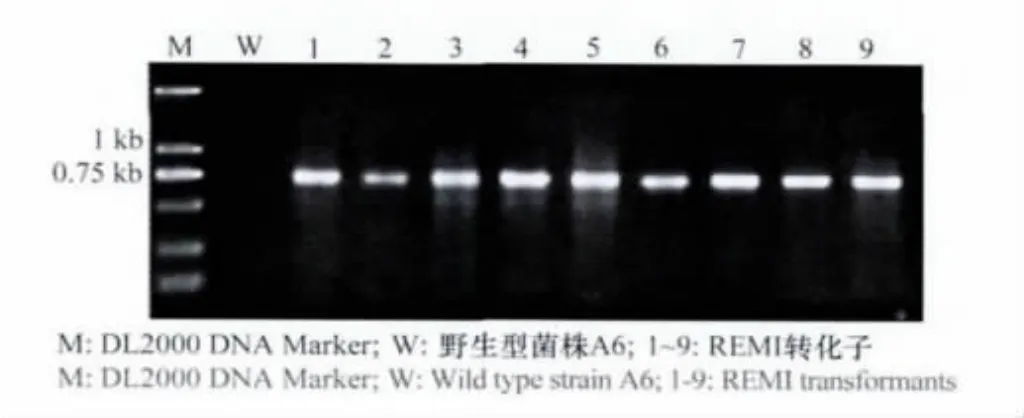
图3 转化子的PCR鉴定Fig.3 Identification of the transformants by PCR
2.5 转化子库的构建及Southern blot验证
利用建立的REMI转化体系,用HindⅢ转化A6,共获得1 050个转化子。随机选取9个转化子进行Southern blot验证,转化子中都含有潮霉素磷酸转移酶基因并且大部分为单位点插入(图4)。

图4 转化子的Southern blot验证Fig.4 Verification of the transformants by Southern blot
2.6 转化子的遗传稳定性鉴定
甘蓝枯萎病菌转化菌株经过5代单孢继代培养后,转接到添加潮霉素B的PDA培养基平板上,仍然生长良好,表明试验所获得的转化菌株潮霉素B抗性能够稳定遗传。
3 结论与讨论
制备原生质体是进行丝状真菌遗传转化的关键因素,在Cochliobolusheterostrophus[8]、Aspergillusalternate[10]中,已成功得到转化所用的原生质体产量均在106个/mL,因此获得一定浓度、纯度和活力的原生质体是丝状真菌进行分子遗传学研究的基础和前提。本研究在掌握甘蓝枯萎病菌原生质体的制备和再生基础上[12],利用REMI转化技术将含潮霉素磷酸转移酶基因的质粒成功整合到了甘蓝枯萎病菌基因组中。
潮霉素对不同真菌的影响不同,对木霉的筛选浓度为250μg/mL[13],稻瘟病菌的筛选浓度为300μg/mL[14],本试验发现当潮霉素B浓度大于50μg/mL时,甘蓝枯萎病菌分生孢子的萌发完全受到抑制且菌丝几乎不能生长,因此试验采用50μg/mL作为甘蓝枯萎病菌的潮霉素筛选浓度。本研究所用质粒含有很多酶切位点,其中限制性内切酶HindⅢ和EcoRI在丝状真菌REMI转化中使用效率较高,因此本试验对这两种酶的转化效率做了比较,发现用限制性内切酶HindⅢ的转化效率相对较高。通过不同酶量转化效率的比较,发现当酶量超过20U后转化效率没有明显提高,因此本研究选用酶量为20U。但有文献曾报道随着酶量的增多,转化子的拷贝数也会相应增多[15]。
REMI转化因在真菌转化上的效率远远大于传统方法的转化效率,已经越来越多地被应用到真菌转化中,但同时也存在一些局限性,如转化机理还不够明确,转化过程中多拷贝插入率较高等。目前在真菌中,一些酵母菌的Agrobacteriumtumefaciens介导转化(ATMT)首先获得成功,随后ATMT转化技术已扩展到一些丝状真菌的转化。相对于REMI转化,ATMT转化可以省略原生质体制备的过程,并且在一些真菌转化上可以单拷贝地随机插入到染色体中,该项工作不仅为丝状真菌的转化提供了新的途径,而且T-DNA转化在插入突变和标记基因方面具有相当的潜力,提供了新的可能途径。本试验在研究REMI介导整合转化的基础上将进一步探讨A.tumefaciens介导的方法,建立起了一套完整、有效的尖孢镰刀菌A.tumefaciens介导的遗传转化体系。
另外试验中还存在一些问题,如获得单拷贝的转化子效率相对不高,转化稳定性尚有待提高。因此还需要进一步优化转化条件,提高转化效率。
本研究通过构建REMI转化子库,对获得的部分转化子进行Southern blot验证分析,确认转化子中含有潮霉素磷酸转移酶基因并且大部分为单位点插入,并筛选出了一批产孢和致病力发生明显变化的转化子,这对克隆甘蓝枯萎病菌产孢和致病相关基因具有重要意义。
[1]郝晓娟,刘波,谢关林.植物枯萎病生物防治研究进展[J].中国农学通报,2005,21(7):319-322.
[2]朱育菁,车建美,肖荣凤,等.尖孢镰刀菌 (FusariumoxysporumSchl.)的生长特性[J].中国农学通报,2007,23(8):373-376.
[3]Harter L L.Fusarium wilt of cabbage[J].Science,1909,30(782):934.
[4]李明远,张涛涛,李兴红,等.十字花科蔬菜枯萎病及其病原鉴定[J].植物保护,2003,29(3):44-45.
[5]Schiestl R H,Petes T D.Integration of DNA fragments by illegitimate recombination inSaccharomycescerevisiae[J].Proceedings of the National Academy of Sciences,1991,88(17):7585-7589.
[6]Noh W,Kim S W,Dong-Won B,et al.Genetic introduction of foreign genes toPleurotuseryngiiby restriction enzyme-mediated integration[J].Journal of Microbiology,2010,48(2):253-256.
[7]Kim S,Song J,Choi H T.Genetic transformation and mutant isolation inGanodermalucidumby restriction enzyme‐mediated integration[J].FEMS Microbiology Letters,2004,233(2):201-204.
[8]Lu S,Lyngholm L,Yang G,et al.Tagged mutations at the Tox1locus ofCochliobolusheterostrophusby restriction enzyme-mediated integration[J].Proceedings of the National Academy of Sciences,1994,91(26):12649-12653.
[9]Brown J S,Aufauvre-Brown A,Holden D W.Insertional mutagenesis ofAspergillusfumigatus[J].Molecular and General Genetics,1998,259(3):327-335.
[10]Sanchez O,Navarro R E,Aguirre J.Increased transformation frequency and tagging of developmental genes inAspergillusnidulansby restriction enzyme-mediated integration(REMI)[J].Molecular and General Genetics MGG,1998,258(1):89-94.
[11]Shi Z,Christian D,Leung H.Enhanced transformation inMagnaporthegriseaby restriction enzyme mediated integration of plasmid DNA[J].Phytopathology,1995,85(3):329-333.
[12]李伶俐,严红,李兴红,等.甘蓝枯萎病菌原生质体的制备与再生条件的优化[J].中国农学通报,2011,27(10):203-207.
[13]Tanaka A,Shiotani H,Yamamoto M,et al.Insertional mutagenesis and cloning of the genes required for biosynthesis of the host-specific AK-toxin in the Japanese pear pathotype ofAlternariaalternata[J].Molecular Plant-microbe Interactions,1999,12(8):691-702.
[14]Brown J S,Aufauvre-Brown A,Holden D W.Insertional mutagenesis ofAspergillusfumigatus[J].Molecular and General Genetics,1998,259(3):327-335.
[15]Jin X,Ming He M,Xiao Wei H,et al.Improvement on genetic transformation in the nematode-trapping fungusArthrobotrysoligosporaand its quantification on dung samples[J].Mycopathologia,2005,159(4):533-538.
Construction of transformation system inFusarium oxysporumf.sp.conglutinansby REMI
Feng Jianhai1, Zhang Wei2, Li Xinghong2, Yan Jiye2, Huang Jinguang1,3
(1.CollegeofCropProtectionandAgronomy,QingdaoAgriculturalUniversity,Qingdao266109,China;2.InstituteofPlantandEnvironmentProtection,BeijingAcademyofAgricultureand ForestrySciences,Beijing100097,China;3.KeyLabofIntegratedCropPest ManagementofShandongProvince,Qingdao266109,China)
Establishment of an efficient and stable REMI transformation system inFusariumoxysporumf.sp.conglutinansby restriction enzyme-mediated integration is a key step to build a transformants library for further studying mutants with specific phenotype and gene function.By REMI transformation method,the linearized pUCATPH plasmid containing the hygromycin resistance gene was transformed into the protoplasts ofF.oxysporumstrain A6.The hygromycin concentration to transformants was optimized,and different restriction enzymes were tested on the transformation efficiency.Hygromycin-resistant transformants were checked by PCR.Hygromycin at 50μg/mL was optimal for screening transformants.Transformation efficiency byHindⅢ was higher than other enzymes,and reached to the highest at 20 U.A library with1 050 transformants was built by the REMI transformation system.The Southern blot results proved the feasibility of the transformation system.
Fusariumoxysporumf.sp.conglutinans; REMI; transformants library
S 436.35
A
10.3969/j.issn.0529-1542.2013.03.020
2012-08-28
2012-09-24
公益性行业(农业)科研专项(2000903049);北京市农林科学院植保环保所创新基金(CXJJ200901);山东省“泰山学者”建设工程专项经费,青岛农业大学高层次人才科研基金(631217)
* 通信作者E-mail:jghuang@qau.edu.cn

