以J亚型禽白血病病毒LTR为启动子的真核表达载体构建
王 蓓,陈宗艳,李传峰,孟春春,王桂军,刘光清*
(1.安徽农业大学动物科技学院,安徽合肥 230036;2.中国农业科学院上海兽医研究所,上海 200241)
J亚型禽白血病病毒(Subgroup J avian leukosis virus,ALV-J)属于甲型反转录病毒属,其中,长末端重复序列(LTR)位于ALV-J前病毒基因组的两侧,其结构由U3、R和U5 3部分组成[1]。LTR包含了一些与转录调控有关的顺式作用元件,例如,5'LTR具有类似RNA聚合酶II启动子的作用元件,而5'LTR中的U3区具有增强子和一些转录调控信号功能[2],R序列起始端约25 bp为RNA聚合酶II结合的序列[3]。3'LTR虽然具有与5'LTR一样的序列结构,但仅具有终止转录和聚腺苷酸化功能,不能作为启动子和增强子[4-5];3'LTR的R区与逆转录病毒RNA的加工成熟有关[2]。反转录病毒的LTRs已被证实能够选择性启动邻近基因的表达[6],赵文明等利用禽网状内皮组织增生病病毒(Reticuliendotheliosis virus,REV)的LTR元件构建了表达外源基因的表达质粒[7]。本研究在前期研究的基础上[1],以ALV-J的LTR为启动子元件构建可以在多种细胞中表达外源基因的真核表达载体,为研发基因输送或DNA疫苗载体提供有价值的参考信息。
1 材料和方法
1.1 主要实验材料 含有ALV-J全基因组的重组质粒pSK-ALV[8]由本实验室构建和保存;pBluescript IISK(+)载体、pEGFP-C3质粒、DH5α感受态细胞,293T细胞、BHK细胞和NDV NP单克隆抗体(MAb)由本实验保存;SPF鸡胚购自北京勃林格殷格翰公司;鸡胚成纤维细胞(CEF):取9日龄~11日龄SPF鸡胚,常规操作制备CEF;限制性内切酶购自TaKaRa公司;转染试剂LipofectamineTM2000购自英俊公司;兔抗GFP多克隆抗体、辣根过氧化物酶(HRP)及FITC标记山羊抗兔lgG、HRP标记山羊抗鼠lgG购自北京康为生物科技有限公司;鼠抗β-actin多克隆抗体购自上海西美生物科技有限公司;去内毒素质粒抽提试剂盒为OMEGA产品;DNA回收试剂盒和质粒抽提与纯化试剂盒购自AxyGen公司;DAB显色试剂盒购自武汉博士德生物工程有限公司。
1.2 引物设计 参照pEGFP-C3(U57607.1)、NDV Lasota株(AF077761)和ALV-J经典株SD07LK1(FJ216405.1)序列设计引物,由上海杰李生物技术有限公司合成(表1)。
1.3 重组质粒的构建 利用PCR的方法,以pSK-ALV为模板,扩增5'LTR和3'LTR序列;以pEGFP-C3为模板扩增eGFP基因;使用表1中的限制性内切酶将3'LTR、5'LTR和eGFP基因依次插入pBluescript II SK(+)载体中,构建重组质粒pSKLTR-eGFP。
以NDV Lasota株的基因组为模板,使用PCR方法扩增出NP基因;利用SalⅠ和ClaⅠ酶切位点,将NP基因置换pSK-LTR-eGFP中的eGFP基因,构建重组质粒pSK-LTR-NP。所构建的重组质粒均经酶切和序列测定进行鉴定。
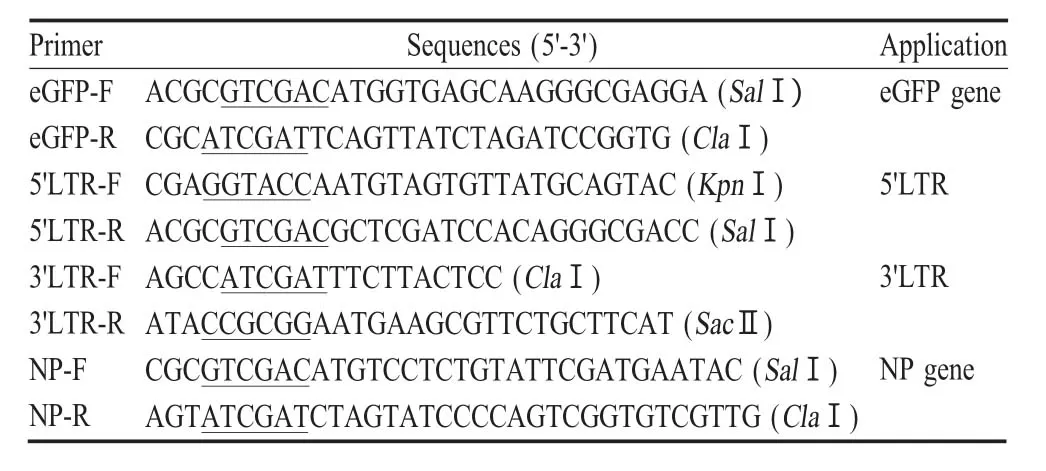
表1 PCR扩增引物Table 1 PCR primers used in this studies
1.4 细胞转染 使用OMEGA质粒提取试剂盒进行重组质粒的提取,按LiptofectaminTM2000说明书进行转染,将pSK-LTR-eGFP、pSK-LTR-NP、pEGFPC3分别转导入长满90%的293T细胞、BHK-21细胞和CEF细胞,5 h后更换完全培养基,置于37℃,5%CO2培养箱中进行培养和观察。
1.5 RT-PCR检测 收集pSK-LTR-eGFP转染后培养48 h的293T细胞、BHK-21细胞和CEF细胞,提取细胞中总RNA。以特异性引物对eGFP-F/R,进行RT-PCR,扩增报告基因eGFP。
1.6 Western blot检测 将pSK-LTR-eGFP转染293T细胞、BHK-21细胞和CEF细胞,培养48 h,收集细胞进行SDS-PAGE电泳,转膜,以兔抗GFP多克隆抗体1∶1 000稀释为一抗,山羊抗兔HRP-lgG 1∶1 000稀释为二抗,进行western blot检测。
pSK-LTR-NP转染293T细胞培养48 h后,以NP MAb 1∶500稀释做为一抗,山羊抗鼠HRP-lgG 1∶1 000稀释为二抗,进行western blot检测。
1.7 流式细胞技术检测 pSK-LTR-eGFP转染293T细胞,取转染后培养12 h、24 h、36 h、48 h和72 h的293T细胞,分散细胞至密度为1×106个/mL,采用流式细胞仪分析,以未转染的细胞作为阴性对照,设定eGFP阳性细胞区(M 1区)使阴性对照M 1区细胞数不超过0.1%。实验结果用转染率和荧光指数(FI)表示。转染率即eGFP阳性细胞阳性率,FI主要反映了目的基因的表达效率,分别用下列公式计算:
转染率=样品M 1区细胞百分率-阴性对照M 1区细胞百分率;
FI=样品M 1区细胞百分率×样品M 1区平均荧光强度-阴性对照M 1区细胞百分率×阴性对照M 1区平均荧光强度。由于减数很小,一般情况下可忽略不计。
2 结 果
2.1 eGFP转染不同细胞鉴定 将pSK-LTR-eGFP重组质粒和pEGFP-C3质粒分别转染293T细胞、BHK细胞和CEF细胞,转染后24 h于荧光显微镜下观察,两质粒在3种细胞均可见较强的绿色荧光,表明eGFP均获得表达(图1)。
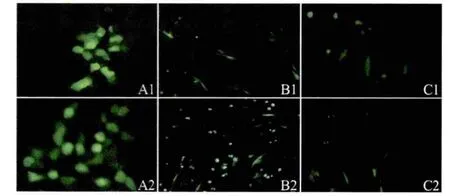
A1:293T transfected w ith pSK-LTR-eGFP;A2:293T transfected with pGEFG-C3;B1:BHK-21 transfected with pSK-LTR-eGFP;B2:BHK-21 transfected with pGEFG-C3;C1:CEF transfected w ith pSK-LTR-eGFP;C2:CEF transfected w ith pGEFG-C3
2.2 RT-PCR鉴定 以eGFP-F、eGFP-R为引物,对pSK-LTR-eGFP和pEGFP-C3分别转染后的293T细胞、BHK-21细胞和CEF细胞中提取的总RNA进行RT-PCR检测。结果显示,扩增片段约800 bp,大小与预期相符(图2)。

图2 RT-PCR检测结果Fig.2 Identification of eGFP'smRNA by RT-PCR
2.3 Western blot检测 将pSK-LTR-eGFP和pEGFPC3分别转染293T细胞、BHK细胞和CEF细胞,western blot检测结果显示,转染不同种类细胞后,均出现一条约29 ku的条带(图3),与eGFP蛋白理论值符合,其中以β-actin作为内参蛋白,大小为42 ku。
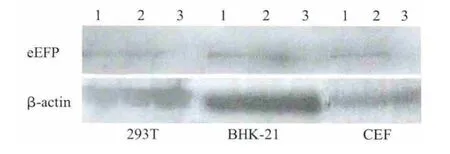
图3 eGFP在293T细胞、BHK-21细胞和CEF细胞中的表达Fig.3 Expression identification of eGFP gene in the 293T cell,BHK-21 cell and CEF cell
2.4 定量分析 pSK-LTR-eGFP转染293T细胞,应用荧光显微镜和流式细胞仪,检测出不同时间点eGFP报告基因的动力学检测(图 4)。结果表明,pSK-LTR-eGFP转染293T细胞12 h之后,eGFP在细胞中出现明显的荧光信号,其表达效率为10%;随着时间的延长,eGFP的表达量明显增长,携带报告基因的293T细胞增多;根据增长曲线分析,12 h至24 h的表达量的增幅最大,24 h表达效率(26%)是12 h(9%)的两倍以上;在培养36 h之后,eGFP的表达效率仍在缓慢增长,但增长幅度明显缩小,表达效率趋于稳定,并在48 h时,eGFP表达量达到峰值,此时细胞的状态最佳;48 h之后,由于细胞开始变圆破损脱落,其表达量下降,荧光的亮度也发生改变。
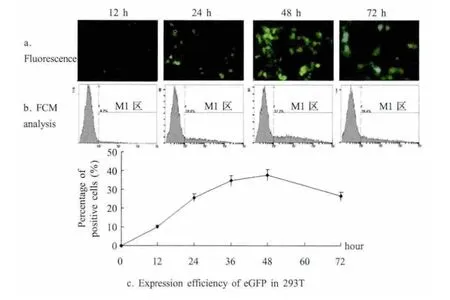
图4 eGFP基因在293T细胞中表达动力学检测Fig.4 The kinetics identificaition of the expression of eGFP in 293T
2.5 NP基因在293T细胞中的表达 将pSK-LTRNP转染293T细胞,48 h后收集并裂解细胞,western blot检测NP基因的表达。结果显示,出现一条约53 ku的条带(图5),与NP蛋白理论值相符,其中以β-actin作为内参蛋白,表明携带的外源基因获得正确表达。

图5 Western blot检测NP基因的表达Fig.5 Expression identification of NP gene by western blot
3 讨 论
ALV-JLTR包含有与转录起始与调控有关的顺式作用元件,可以良好启动外源基因的转录和表达[1]。因此,一些逆转录病毒的LTR元件已被应用于构建真核表达载体,如REV、牛泡沫病毒(BFV)、劳斯肉瘤病毒(RSV)和人免疫缺陷病毒(HIV)等[4-6]。目前还没有应用ALV-J的LTR构建真核表达载体的报道。本研究将ALV-J的5'和3'LTR插入常用转录载体pBluescript IISK(+)中,利用绿色荧光蛋白检测LTR在多种细胞中启动基因表达的能力。研究结果表明,ALV-J的LTR可以在293T、BHK-21和CEF细胞中启动报告基因的表达,证明以ALV-JLTR为启动子构建表达质粒是可行的。对报告基因在293T细胞中的动态表达规律进行检测和分析,结果显示重组表达质粒转染293T细胞12 h时eGFP开始表达,到48 h表达量达到峰值,荧光指数达40%。
为验证所构建的真核表达载体是否可以良好的表达禽源病毒的基因,本研究将NDV的NP基因插入ALV-J 5'LTR和3'LTR间,并转染细胞。试验结果显示NDV NP基因获得良好表达,表明本文构建的表达载体有望用于构建禽源病毒的DNA疫苗或靶基因的输送。
真核表达载体的启动子和增强子的强弱以及之间的搭配是影响外源基因表达的主要因素。有文献表明,ALV-J的LTR中,U5区对基因表达存在负调控作用[1],ALV-J为适应体外的细胞培养环境,通过改变LTR与细胞相互作用的结合基序来提高病毒LTR的启动子活性,从而使病毒的复制能力增强[9]。因此,选择适合的动物细胞也可以提高外源基因的表达水平。LTR对病毒DNA整合进宿主细胞基因组和控制病毒RNA合成均有重要作用,ALV-J感染宿主后,其前病毒cDNA可以整合于宿主细胞的基因组中[1];Isfort等发现,ALV-J和马立克病毒(MDV)共感染细胞后,ALV-JLTR可以整合于MDV的基因组中[10]。因此,本实验构建的表达载体更适合体外细胞系的建立和带有报告基因的表达。
[1]张伟伟,王超,杨宗伟.J亚群禽白血病病毒的LTR体外启动活性分析[J].中国兽医科学,2011,41(2):121-125.
[2]戴冰冰,梅文瀚,王家敏.CMV-3'LTR嵌合启动子对逆转录病毒载体MFG滴度及外源基因表达的影响[J].病毒学报,2003,19(3):235-239.
[3]Lv Xiao-qing,Han Jin-run,Liu Xiao-fang.The LTR of endogenous retrovirus ev21 retains promoter activity and exhibits tissue specific transcription in chicken[J].Chi Sci Bulle,2009,54(24):4664-4667.
[4]Bryan R C,Kyle R,Grace Ju.Functional analysis of the transcription control region located w ithin the avian retroviral long term inal repeat[J].Molec cell biol,1985,5(3):438-447.
[5]Bep K,Ben B.Comparison of 5'and 3'long terminal repeat promoter function in human immunodeficiency virus[J].JVirol,1994,68(6):3830-3840.
[6]Sun Ai-jun,Petherbridge L,Zhao Yu-guang.A BAC clone of MDV strain GX0101 w ith REV-LTR integration retained its pathogenicity[J].Chi Sci Bull,2009,54(15):2641-2647.
[7]赵文明,丁家波,姜世.禽网状内皮组织增殖病病毒LTR序列的启动子功能[J].中国病毒学,2004,19(3):255-258.
[8]王超,缪华先,谢宝婵.J亚型禽白血病病毒的拯救与鉴定[J].中国预防兽医学报,2011,33(11):837-840.
[9]张贺楠,齐岩,史伟伟.不同病变型J亚群禽白血病病毒LTR启动子序列分析及活性比较[J].病毒学报,2010,26(5):402-406.
[10]Isfort R,Jones D.Retrovirus insertion into herpesvirus in virtro and in vivo[J].PNAS USA,1992,89(3):991-995.

