Empetrifranzinans A和Empetrifranzinans C的全合成及其抗肿瘤活性*
李人则,刘晓宇,焦晓臻,田承森,董 梁,谢 平
(中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室活性物质发现与适药化研究北京市重点实验室,北京 100050)
Empetrifranzinans A(1a),Empetrifranzinans B和 Empetrifranzinans C(1b)是由 Sebastian 等[1]首次从植物Hypericum empetrifolium WILLD的地上部分分离得到的单萜柠檬烯类三环酰基间苯三酚类化合物。其中,1a和Empetrifranzinans B以两种异构体的混合物形式存在,尚未分离到单一异构体。他们在体外对人微血管上皮细胞均表现出较好的抗增殖作用,其合成未见文献报道,因此对其进行全合成研究,为对该类化合物进行进一步的药理学活性评价具有重要意义。
本文以廉价易得的间苯三酚为起始原料,经Friedel-Crafts酰基化反应得取代间苯三酚(2a和2b)[2];在20 mol%L-脯氨酸催化下,以 DMF 为溶剂,2a和2b分别与柠檬醛(3)于100℃反应10 h,分别以60%和55%的总收率首次合成了1a和1b(Scheme 1),其结构经1H NMR,13C NMR和HR-MS确证。并采用MTT法对1a和1b进行了初步的体外抗肿瘤活性评价。
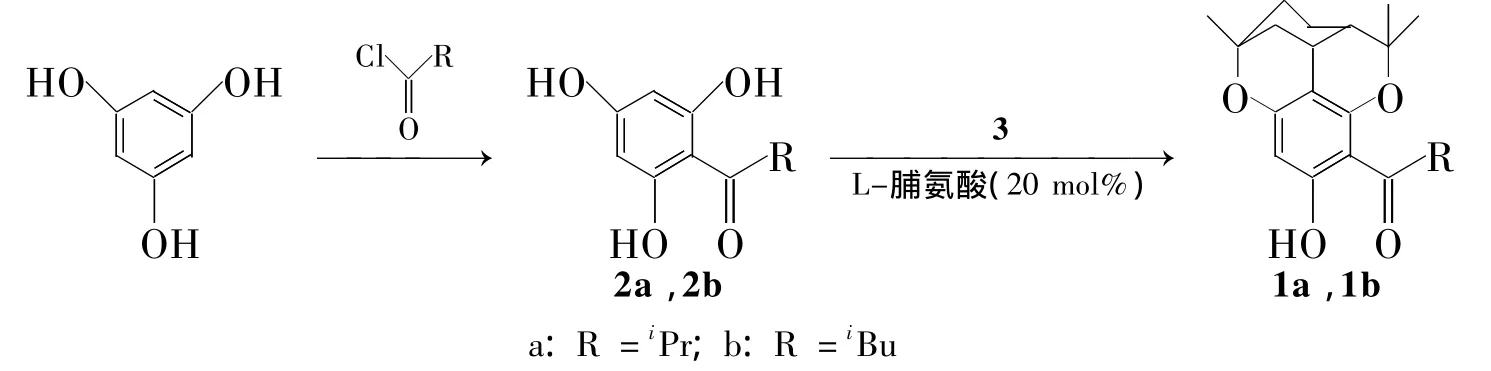
Scheme 1
1 实验部分
1.1 仪器与试剂
Yanaco MP-500D型显微熔点仪(温度未校正);PerkinElmer 241型旋光仪;Varian INOVA-500型和Mercury-400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Micromass Auto Spec Ultima-TOF型质谱仪。
薄层层析和常压柱层析用硅胶,160目~200目,青岛海洋化工厂;其余所用试剂均为分析纯。
1.2 合成
(1)2的合成(以2a为例)
在反应瓶中加入硝基苯150 mL和无水间苯三酚20 g(158 mmol),搅拌使其完全溶解;于室温分三等份加入无水AlCl386.7 g(650 mmol),反应30 min;滴加异丁酰氯 18.2 mL(174 mmol),滴毕,于65℃反应8 h。倒入冰水中,用乙酸乙酯(3×100 mL)萃取,合并萃取液,用2 mol·L-1NaOH(2×150 mL)萃取,合并水相,用浓盐酸中和至pH 4~5,乙酸乙酯(3×100 mL)萃取,合并有机层,用饱和NaCl洗涤,无水NaSO4干燥,减压蒸除溶剂后经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=5∶1~2∶1]纯化得淡黄色固体 2a 26 g,收率 84%;1H NMR δ:12.26(s,2H),10.31(s,1H),5.81(s,2H),3.88(m,1H),1.07(d,6H,J=6.3 Hz)。
按类似方法合成淡黄色固体2b 6.4 g,收率82%;1H NMR δ:12.23(s,2H),10.31(s,1H),5.79(s,2H),3.74(m,1H),1.69(m,1H),1.30(m,1H),1.04(d,J=6.6 Hz,3H),0.82(t,J=7.8 Hz,3H)。
(2)1的合成(以1a为例)
在反应瓶中加入2a 1.96 g(10 mmol)和无水DMF 20 mL,搅拌使其完全溶解;加入柠檬醛2.05 mL(12 mmol)和 L-脯氨酸 230 mg(2 mmol),于100℃反应10 h。冷却至室温,加水30 mL,用乙酸乙酯(3×30 mL)萃取,合并有机相,用无水NaSO4干燥,蒸除溶剂后经硅胶柱层析[A=50 ∶1~20 ∶1]纯化得淡黄色固体 1a 2.38 g,收率72%,m.p.138 ℃~139 ℃,[α]20D0°(c 0.7,MeOH);1H NMR δ:13.54(s,1H),6.05(s,1H),3.93(s,1H),2.75(s,1H),2.17(m,1H),2.08(m,1H),1.86(s,1H),1.83(s,1H),1.58(s,3H),1.45(m,1H),1.39(s,3H),1.31(m,1H),1.18(d,J=6.7 Hz,3H),1.15(d,J=6.7 Hz,3H),1.11(s,3H),0.88(m,1H);13C NMR δ:209.6,164.9,162.2,159.0,107.4,106.4,97.1,86.4,75.9,46.2,38.1,37.5,34.9,29.9,28.7,27.6,24.4,21.8,20.1,18.5;HR-ESI-MS m/z:Calcd for C20H27O4{[M+H]+}331.190 4,found 331.190 5(表征数据与文献[1]值吻合)。
按类似方法合成淡黄色固体1b 2.31 g,收率67%,m.p.117 ℃~118 ℃,[α]20D0°(c 0.5,MeOH);1H NMR δ:13.62(s,1H),6.05(s,1H),3.78(m,1H),2.75(s,1H),2.19(m,1H),2.08(m,1H),1.86(m,1H),1.85(m,2H),1.58(s,3H),1.45(m,1H),1.39(s,3H),1.37(m,1H),1.31(m,1H),1.15(d,J=6.8 Hz,3H),1.11(s,3H),0.94(m,3H),0.89(m,1H);13C NMR δ:209.3,165.0,162.3,159.1,107.5,106.9,97.1,86.6,75.9,46.3,45.1,37.5,34.9,29.9,28.7,27.6,25.9,24.4,21.8,17.6,12.2;HR-ESI-MS m/z:Calcd for C21H29O4{[M+H]+}345.206 0,found 345.206 8。
1.3 1的体外抗肿瘤活性测定
以人结肠癌细胞(HCT-8)、人肝癌细胞(Bel-7402)、人胃癌细胞(BGC-823)、人肺腺癌细胞(A549)和人卵巢癌细胞(A2780)为测试细胞株,采用MTT法对1a和1b进行了抗肿瘤活性实验。将对数生长期的细胞用胰酶消化后,配制成一定浓度的单细胞悬液,按2 000个/孔接种于96孔板,每孔加入细胞悬液100 μL,于37℃培养24 h。次日加入不同浓度药物及相应溶剂对照的新鲜培养基,每孔加100 μL(DMSO 终浓度 <0.1%),每种受试物设3个剂量组,每组设三个平行孔。于37℃培养120 h后弃上清,每孔加入200 μL新鲜配制的含0.5 mg·mL-1MTT的无血清培养基,培养4 h。弃上清,每孔加入200 μL DMSO溶解MTT甲簪沉淀,振荡混匀后,酶标仪在570 nm处测定光密度值(OD),以溶剂对照处理的肿瘤细胞为对照组,按下式计算药物对肿瘤细胞的抑制率,并按中效方程计算IC50。

2 结果与讨论
2.1 合成
1a和1b具有典型的单萜柠檬烯类多环酰基间苯三酚母核,虽然文献[3]报道其可用取代间苯三酚与柠檬醛在吡啶存在下进行环合反应而得,但收率较低,且产物通常为两种异构体的混合物,分离纯化困难。近年来,韩国学者[4]报道了由乙二胺二乙酸(EDDA)催化的柠檬烯类化合物与间苯三酚的环合反应,避免了异构体的产生,但是由于催化剂EDDA价格较为昂贵,考虑到该反应的经济适用性,我们希望筛选到一种更为廉价易得的催化剂,并达到EDDA的催化效果。从而使该合成方法具有更为广泛的适用性。
以合成1a为模板,考察催化剂对本反应的催化活性,结果见表1。由表1可以看出,当催化剂用量为20 mol%时,使用L-脯氨酸收率达72%。同时发现,该反应适宜在较弱酸性条件下进行;随着催化剂的酸性增强,1a收率随之降低,二环副产物增多。从表1还可以看出L-脯氨酸作为催化剂,具有廉价易得、收率高等优点,是该反应的理想催化剂。此外,值得一提的是,经1H NMR和NOESY分析表明,在1a中可观察到2'-H与8″,9″-H的相互作用,而非2'-H与10″-H的相互作用,说明1a为单一构型,没有异构体的产生。同样,在1b中也只观察到2'-H与8″,9″-H的相互作用(Chart 1)。

表1 催化剂对环合反应的影响*Table 1 Effect of catalyst on cyclization

Chart 1
以L-脯氨酸为催化剂,考察温度(室温、100℃)和溶剂(二氯甲烷、四氢呋喃、甲醇、甲苯或DMF)对反应的影响。实验结果表明,于室温反应10 h,均未得到1a;于100℃反应10 h,以二氯甲烷、四氢呋喃、甲醇为溶剂,也未发生预期反应;而以甲苯为溶剂时收率达65%;DMF为溶剂时,收率达72%。由此看出,除去溶剂对反应的影响,温度似乎起到了更大的作用。
2.2 抗肿瘤活性
为了研究1潜在的抗肿瘤活性,对其进行了抗肿瘤活性测试,结果见表2。由表2可见,1a对测试细胞株HCT-8,Bel-7402,BGC-823,A549和A2780表现出了较强的细胞毒作用。

表2 1的体外抗肿瘤活性*Table 2 Antitumor activities of 1
本研究结果为进一步考察该类天然产物的构效关系奠定了基础。
[1] S Schmidt,G Jürgenliemk,H Skaltsa,et al.Bi-,Tri-,and polycyclic acylphloroglucinois from hypericum empetrifolium [J].JNatProd,2012,75:1697-1705.
[2] J H George,M D Hesse,J E Baldwin,et al.Biomimetic synthesis of polycyclic polyprenylated acylphloroglucinol natural products isolated from hypericum papuanum[J].Org Lett,2010,12:3532-3535.
[3] M J Begley,L Crombie,R W King,et al.Chromens and citrans derived from phloroacetophenone and phloroglucinaldehyde by citral condensation:Regioselectivity,mechanism,and X-Ray crystal structures[J].J Chem Soc,Perkin Trans,1977,1:2393-2401.
[4] V V Kane,T L Grayeck.Regiospecific synthesis of rubranine [J].Tetrahedron Lett,1971,12:3991-3994.
[5] L Crombie,R Ponsford.Pyridine-catalysed condensation of citral with phlsroglucinols,a novel reaction leading to tetracyclic bis-ethers and chrornenes.Twostep synthesis of(± )-deoxybruceol[J].J Chem Soc C,1971,788-795.
[6] L Crombie,S D Redshaw,D A Slack,et al.Synthesis and structure of eriobrucinol and isomeric‘Cyclol’Meroterpenes[J].J Chem Soc Chem Commun,1979,628-630.
[7] X Wang,Y R Lee.EDDA-catalyzed rapid synthetic routes for biologically interesting polycycles bearing citrans and chalcones:The first total synthesis of sumadain A[J].Tetrahedron,2009,65:10125-10133.

