甜菜磷酸蔗糖合成酶的转基因研究
刘大丽 ,马龙彪 ,郝 慧
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院北方糖料作物资源与利用重点实验室/中国农业科学院甜菜研究所,哈尔滨 150080)
甜菜是我国主要的糖料作物之一,其含糖率及产量直接关系到糖料的生产和发展[1]。常规的育种方法在提高产量和含糖率上逐渐表现出来了很大的局限性。随着生物技术和分子生物学的发展,基因工程技术为解决这一难题提供了有效而便捷的方法。
蔗糖是植物体内光合同化物由叶到果实的主要运输形式,也是决定甜菜品质形成的关键因子[2-3]。高等植物的蔗糖代谢是一个复杂的过程,其中,蔗糖磷酸合成酶(Suerosephosphate synthase,EC2.3.1.14,SPS)与蔗糖的代谢密切相关。SPS是一种可溶性酶,存在于细胞质中,催化如下可逆反应:UDPG+6-磷酸果糖⇌6-磷酸蔗糖+UDP。许多果实成熟过程中蔗糖积累与SPS活性的升高密切相关[4-5]。因此,克隆甜菜BvSPS基因,并进而将其转化到甜菜植株中去,能够有效地提高甜菜块根的含糖率及品质,进而有效地促进我国甜菜产业的发展。
1 材料与方法
1.1 实验材料及试剂
实验所用的甜菜试管苗、植物表达载体pBI121、农杆菌菌株EHA105由黑龙江大学甜菜遗传育种重点实验室提供。T4 ligase (Biolabs);Trans5α 感受态细胞(Transgen);Taq DNA polymerase(Transgen);限制性内切酶(MBI);未特殊注明试剂均为进口分析纯。
1.2 pBI121-BvSPS植物表达载体的构建
分别将顺式插入甜菜 BvSPS(Genbank accession no.X81975)基因的 pMD 18-T-BvSPS载体[6]、pBI121载体用PstI、SacI限制性内切酶酶切,Tris饱和酚提纯后用Klenow大片段补平,再经过Tris饱和酚提纯后用XbaI限制性内切酶酶切,经1%琼脂糖凝胶电泳回收BvSPS片段及pBI121片段;将目的片段BvSPS和载体pBI121按照3∶1的摩尔比建立连接反应体系,16°C连接过夜;连接产物转化到Trans5α感受态细胞中,通过Kana抗性筛选出待测阳性克隆;待测克隆经过质粒提取及PCR鉴定,引物参见[6],进一步确定重组子pBI121-BvSPS。重组质粒转化到农杆菌EHA105中,待用。
1.3 农杆菌介导的甜菜遗传转化
以甜菜无菌苗的叶柄为转基因的外植体,将其置于预培养培养基(MS+0.5 mg/L 6-BA)中2 d;分别用浓度为OD600=0.4、0.6、0.8的含有pBI121-BvSPS的农杆菌侵染甜菜叶柄外植体,侵染时间为5 min、10 min、15 min,然后置于共培养培养基(MS+0.5 mg/L 6-BA+100 μmol/L AS)中暗培养 2 d、4 d、6 d;最后,转入筛选培养基(MS+0.5 mg/L 6-BA+200 mg/L Kana)中进行抗性芽的分化和筛选。
1.4 甜菜基因组DNA的提取及转基因甜菜的分子鉴定
利用CTAB法提取甜菜基因组DNA。根据甜菜BvSPS基因及pBI121的序列信息,利用Primer premier 5.0设计鉴定引物:上游引物(5'-3')为 GAC CTG CAG GCA TGC AAG CTT;下游引物(5'-3')为 CCT GAC GTG GAT TGG AGT TAT,扩增片段长度约为680 bp,引物由上海生工合成。
取 100 ng 甜菜基因组 DNA 为模板进行 PCR 扩增,反应条件为:94°C,4 min;94°C(30s);62°C(45s);72°C(1 min),39个循环;72°C延伸10min。扩增产物于1.0%琼脂糖凝胶中进行电泳,并利用GenSnap 6.08(f)进行检测。
2 结果与分析
2.1 植物表达载体pBI121-BvSPS的构建
实验分别利用pBI121、pMD 18-T-BvSPS进行酶切以获得连接所需的载体及目的片段。如图1所示,通过质粒提取及特异引物的PCR鉴定,pBI121-BvSPS重组质粒被成功地构建并转化到农杆菌EHA105中。该重组的植物双元表达载体被用于甜菜转基因的研究。
2.2 甜菜BvSPS转基因体系的优化
植物基因遗传转化过程错综复杂,其中各种转化因子直接关系到基因的转化效率。本研究着重从农杆菌的侵染浓度、侵染时间及共培养时间方面对甜菜转基因体系进行了优化。如表1所示,当农杆菌侵染浓度OD600值为0.6,侵染时间5 min,共培养4 d后,甜菜叶柄外植体经过侵染后,其不定芽比率最高,约为36.6%、33.3%及38.3%。而侵染浓度和时间过高或过长,都会由于农杆菌生长频率较快而导致甜菜叶柄死亡。
依据以上实验结果,确定最适农杆菌浓度是OD600值为0.6,最适侵染时间为5 min,最佳共培养时间为4 d。
2.3 BvSPS转基因植株的鉴定
剪取野生型及待测转基因甜菜新鲜叶片,利用CTAB法提取甜菜基因组DNA,以提取的DNA为模板进行Kana抗性苗PCR扩增检测。
如图2所示,阳性质粒pBI121-BvSPS对照的扩增条带最亮,野生型阴性对照没有明显扩增出特异性条带。而待测8株转基因植株则分别不同程度地扩增出了和阳性对照同等大小的目的条带,这就证明BvSPS基因被不同程度地转化并整合到甜菜基因组中。
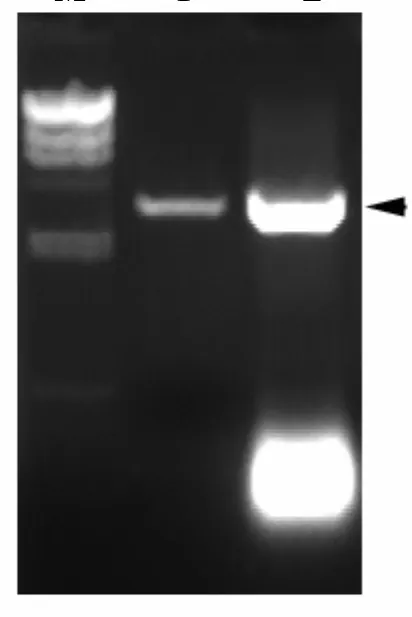
图1 pBI121-BvSPS植物表达载体的PCR鉴定
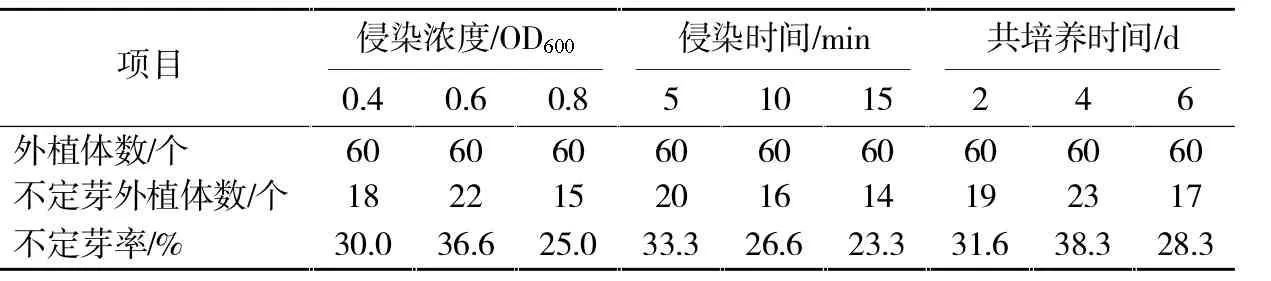
表1 甜菜转基因体系的优化

图2 转基因甜菜的PCR检测
3 讨论
随着甜菜产业的发展及人民生活水平的提高,传统的遗传改良方式已经无法满足人们对糖制品的需求。利用转基因技术提高甜菜含糖率成为最为快速有效的方法之一。甜菜基因工程在我国起步较晚,转基因研究主要集中在甜菜的病害及抗除草剂方面[7-8]。本研究则利用分化率较高的、遗传性状稳定的和再生能力较强的遗传转化体系,建立高效而稳定的外源基因整合方法,并成功将BvSPS基因稳定而高效地转化到甜菜基因组内。由于甜菜BvSPS基因存在于甜菜基因组内,转基因植株检测过程中,用于分子鉴定的PCR引物特殊设计了上游引物位于pBI121载体上的碱基序列,下游引物位于BvSPS基因内部,这就避免了检测过程中假阳性的出现。转基因植株也将进一步生根、栽培,所获得的种子将进一步用于筛选、比较研究及实际应用。
[1]朱向明,韩秉进,张秋英,等.黑土区甜菜新品种间块根产量与含糖率差异[J].土壤与作物,2012,1(2):126-128.
[2]Huber S C,Huber J L.Role of sucrose phosphate synthase in sucrose metabolism in leaves[J].Plant Physiol.,1992,99:1275-1278.
[3]Fiew S,Willenbrend J.Sucrose synthase and sucrose phosphate synthase in sugar beet plants(Beta vulgaris L.ssp.altisima)[J].J Plant Physiol,1987,131:153-162.
[4]Lunn J E,Macrae E.New complexities in the synthesis of sucrose[J].Curr Opin Plant Biol,2003,6(3):208-214.
[5]Cumino A,Curatti L,Giarrocco L,et al.Sucrose metabolism:Anabaena sucrose-phosphate synthase and sucrose-phosphate phosphatase define minmal functional domains shuffled during evolution[J].FEBS Lett,2002,517(1-3):19-23.
[6]刘大丽,马龙彪,郝慧.甜菜蔗糖磷酸合成酶基因的克隆及序列分析[J].中国糖料,2010(4):6-8.
[7]刘大丽,马龙彪,王皙玮,等.应用 RT-PCR 技术检测甜菜坏死黄脉病毒[J].中国糖料,2008(2):12-17.
[8]孙亚卿,邵金旺,张少英.甜菜基因工程研究进展及其展望[J].中国农学通报,2007,23(4):27-32.

