酶解刺参内脏蛋白制备抗氧化肽的研究
闫鸣艳,秦 松
(中国科学院烟台海岸带研究所,山东烟台264003)
人体内存在过剩的活性氧自由基,这些活性氧自由基若不加以清除,可破坏人体内的DNA、生物膜、蛋白质等,导致多种疾病的产生,加快人体衰老。抗氧化剂是生物体实现自我保护的最根本性机制[1]。目前使用较多的是化学合成抗氧化剂,虽然具有较好的清除自由基活性,但是存在致癌等毒副作用,各国政府纷纷出台强制措施限制其过量添加。在这种情况下,天然抗氧化剂以天然、安全、健康、营养等特点,受到消费者的青睐。抗氧化肽是天然抗氧化剂的一种,指那些具有抗氧化生理活性的多肽类,近年来已成为食品科学领域的研究热点之一。刺参是山东省胶州湾地区水产养殖的主要海参品种。近年来其养殖和加工规模不断扩大,然而其综合利用程度较低,加工过程中产生的内脏(肠、卵)等副产物未得到充分开发利用。研究发现刺参内脏与体壁含有同样丰富的蛋白质和活性成分[2],可用于制备生物活性肽。目前已有利用海参肠[3]和卵[4]制备多肽的研究报道,但是这些研究均以水解度为主要指标研究内脏蛋白的酶解工艺,未发现以自由基的清除率为指标研究酶解内脏蛋白制备抗氧化肽的报道。本实验以刺参内脏为原料,初步研究了内源蛋白酶的性质,在此基础上研究了其酶解条件,并与八种外源蛋白酶比较筛选出制备抗氧化肽所用的蛋白酶,对酶解条件进行了优化,确定由刺参内脏制备抗氧化肽的最佳酶解工艺,为刺参内脏的加工利用提供了参考。
1 材料与方法
1.1 材料与仪器
刺参内脏 山东东方海洋科技股份有限公司提供,-20℃保存实验时4℃解冻。
食品级碱性蛋白酶、风味蛋白酶、中性蛋白酶、菠萝蛋白酶和木瓜蛋白酶 广西南宁庞博生物工程有限公司;食品级胰蛋白酶、酸性蛋白酶、胃蛋白酶湖北康宝泰精细化工有限公司;其他试剂均为分析纯。
磁力搅拌器(82-2A) 金坛市科析仪器有限公司;高速台式冷冻离心机(TGL-16M) 长沙湘仪离心机仪器有限公司;电热恒温水浴锅(DK-S24)上海精宏实验设备有限公司;精密增力电动搅拌器(JJ-1) 江苏金坛市双捷实验仪器厂;电子天平(AL204-IC)梅特勒-托利多仪器有限公司;紫外可见分光光度计(721E)上海光谱仪器有限公司;pH计(PHS-3C)上海虹益仪器仪表有限公司;气浴恒温振荡器(ZD-85A)金坛市恒丰仪器制造有限公司。
1.2 实验方法
1.2.1 内脏内源蛋白酶的制备 将刺参内脏中泥沙除净,剪成小块备用。内脏内源蛋白酶的提取方法参照Fu的方法[5]。称取内脏60g,加入180mL低温预冷的50mmol/L的 Tris-HCl缓冲液(pH7.5),于4℃条件下搅拌提取 5h,12000r/min低温离心20min,上清液即为内源蛋白酶粗酶液。蛋白酶活力测定参照SB/T 10317-1999,采用福林-酚法,以酪蛋白为底物。
1.2.2 内源蛋白酶最适反应pH和温度的确定 将内源蛋白酶加入到 pH1~14的缓冲液中,采用福林-酚法测定酶活力。不同pH的选择性缓冲液分别为:0.1mol/L KCl-HCl缓冲液(pH1.0~2.0);0.1mol/L柠檬酸-Na2HPO4缓冲液(pH3.0~6.0);0.05mol/L Tris-HCl缓冲液(pH7.0~9.0);0.05mol/L硼砂-NaOH缓冲液(pH10.0);0.2mol/L Na2HPO4-NaOH缓冲液(pH11.0~14.0)。
将内源蛋白酶加入到pH2.0、5.0、8.0和12.0的缓冲液中,分别在 20、30、40、50、60、70℃的水浴中准确反应40min,酶活力测定采用福林-酚法。
1.2.3 内脏蛋白的酶解工艺 精确称取一定量的刺参内脏,用蒸馏水匀浆,混合均匀,用1mol/L的HCl或NaOH溶液调节至设定pH,加入一定量的蛋白酶后调节至设定温度,内源蛋白酶酶解直接设定至对应温度,搅拌,开始水解,反应至设定时间。水解结束后,沸水浴灭酶活10min,终止反应,然后冷却至室温,置于离心机中,8000r/min离心 30min,收集上清液。
1.2.4 检测方法
1.2.4.1 水解度测定 水解度(Degree of hydrolysis,DH)的测定采用茚三酮比色法。蛋白含量测定采用凯氏定氮法(GB/T 5009.5-2010)。
1.2.4.2 氮回收率的测定 对原料进行水解,记录水解离心后上清液的总体积,取15.0mL蛋白水解液,用凯氏定氮法消化、定氮,测定上清液中氮含量,氮回收率(Nitrogen recovery,NR)公式如下:

式中:NR-氮回收率(%);C0-底物总氮含量(g),C1-上清液总氮含量(g)。
1.2.4.3 酶解液对羟自由基的清除作用[6]在刻度试管中加入0.8mL的HAc-NaAc缓冲液(pH5.0),1.0mL的孔雀绿溶液(1 ×10-4mol/L),2.2mL 的EDTA-Fe2+溶液(2 ×10-2mol/L),1.4mL 体积分数0.3% 的H2O2溶液,用去离子水稀释至10mL并摇匀,放置45min后在617nm下测定吸光度Ab,同时测定不加H2O2时体系在617nm下的吸光度A0,则羟自由基的产生量为ΔA=A0-Ab。ΔA越大,表示生成的羟自由基越多。
上述体系中加入H2O2之前加入1mL待测样品,测定其吸光度As,则羟自由基的清除率(Scavenging rate of hydroxyl radical,SRHR)为:

1.2.4.4 酶解液对超氧阴离子自由基的清除作用[7]
取50mmol/L 的 Tris-HCl缓冲液(pH8.2,2mmol/L Na2EDTA)3mL,加入0.5mL待测酶液,于25℃保温10min,然后加入25℃预温的5mmol/L的邻苯三酚(预先用 10mmol/L HCl配制)0.1mL,反应 4min,每30s测定一次溶液在320nm下的吸光度,计算邻苯三酚自氧化速率,以10mmol/L HCl作为空白调零。按照下式计算超氧阴离子的清除率(Scavenging rate of superoxide anion radical,SRSAR)。

式中:V0:未加待测样品的反应液中邻苯三酚自氧化速率。Vs:加入加待测样品的反应液中邻苯三酚自氧化速率。
1.2.5 酶解工艺优化 分别选取八种外源蛋白酶(中性蛋白酶、碱性蛋白酶、胰蛋白酶、风味蛋白酶、菠萝蛋白酶、木瓜蛋白酶、酸性蛋白酶和胃蛋白酶)和内源蛋白酶对刺参内脏蛋白进行水解,测定酶解液对羟自由基和超氧阴离子自由基的清除率、水解度和氮回收率。表1所示为八种蛋白酶水解反应参数。选取酶解作用较强的蛋白酶,应用正交实验对其水解条件进行优化,确定其最佳酶解工艺条件。正交实验因素与水平见表2。
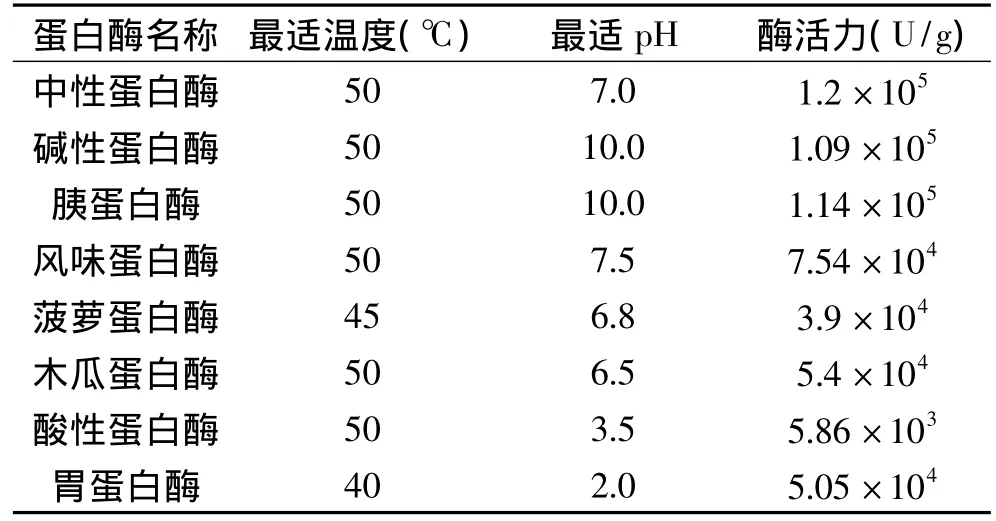
表1 八种蛋白酶水解反应参数Table 1 Parameters for enzymatic hydrolysis of eight enzymes
2 结果与分析
2.1 内源蛋白酶最适反应pH和温度的确定
2.1.1 最适反应pH的确定 图1显示了从刺参内脏提取的内源蛋白酶以酪蛋白为底物时不同pH下的酶活力变化,可以发现蛋白酶活力曲线出现高低不同的起伏,可能是由于内脏中含有多种蛋白酶,不同的蛋白酶在不同的pH条件下表现出不同的活力。在pH2.0时,蛋白酶可能为类胃蛋白酶,表现出最大酶活力,这不同于启航等报道的海参体壁粗蛋白酶在pH5.0时酶活力达到最大值[8]。随着pH的增大,该酶液在pH5.0、8.0和12.0均有活性峰,表明至少有三种蛋白酶存在,最适pH5.0的酶可能为一种组织蛋白酶,最适pH8.0和12.0的酶为两种碱性蛋白酶。上述结果与Fu等从海参消化道中提取的蛋白酶的实验结果类似[5]。

表2 菠萝蛋白酶正交实验因素与水平L9(34)Table 2 Factors and levels in the orthogonal array design L9(34)

图1 pH对刺参内脏内源蛋白酶酶活力的影响Fig.1 Effect of pH on the proteolytic activity of endogenous enzyme extracted from sea cucumber viscera
2.1.2 最适反应温度的确定 由图2可知,刺参内脏内源蛋白酶活力均随着温度的升高而增大,当温度进一步升高时,由于蛋白的热变性作用蛋白酶活力逐渐降低[9]。在 pH2.0的条件下,内源蛋白酶在40~70℃之间酶活力较高,在60℃时酶活力达到最大值;在pH5.0时,酶活力最高点出现在55℃;在pH8.0和12.0的条件下,内源蛋白酶的最适温度分别为45℃和50℃。
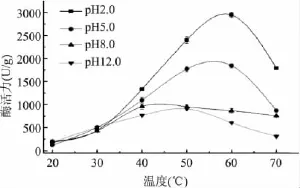
图2 温度对刺参内脏内源蛋白酶酶活力的影响Fig.2 Effect of temperature on the proteolytic activity of endogenous enzyme extracted from sea cucumber viscera
2.2 水解用酶的筛选
由于蛋白酶的酶切位点不同,所以蛋白酶的种类对多肽品质具有重要影响[10]。Zhou等研究指出鲍鱼内脏蛋白酶酶解液的水解度、氨基酸组成和抗氧化活性均与所采用的蛋白酶有关[11]。因此,实验中我们对水解刺参内脏蛋白制备抗氧化肽所用的蛋白酶进行了筛选。由于内源蛋白酶和外源蛋白酶水解蛋白各有优缺点,因此我们分别用这两类蛋白酶对内脏蛋白进行了水解,对水解液的清除自由基活性、水解度和氮回收率进行了研究,筛选出最佳用酶。
海参内脏和体壁含有丰富的内源蛋白酶,在一定条件下能水解自身蛋白,即发生自溶。用内源蛋白酶水解自身蛋白具有成本低的优点,因此在实际生产中具有一定的应用。但是内源蛋白酶酶活力受到原料贮藏环境的影响,并且酶解过程的可控性和重现性较差[12]。本实验分别在内源蛋白酶最适pH和对应的最适温度下对内脏蛋白酶解4h,对酶解液的清除自由基活性、水解度和氮回收率进行了测定,结果如图3所示。在pH8.0时,酶解液的清除自由基活性、水解度和氮回收率均明显高于在其它条件下(p<0.05),由此可以确定pH为8.0和温度为45℃是内源蛋白酶酶解内脏蛋白制备抗氧化肽的最佳条件。在此条件下,所得酶解液对羟自由基和超氧阴离子自由基清除率分别为47.67%和24.98%。上述结果表明内源蛋白酶可对内脏蛋白进行有效酶解,所得酶解液具有一定的清除自由基活性。

图3 内源蛋白酶对刺参内脏蛋白酶解液的清除羟自由基和超氧阴离子自由基活性、水解度和氮回收率的影响Fig.3 Effect of endogenous proteases on the scavenging rate of hydroxyl and superoxide anion radical,degree of hydrolysis and nitrogen recovery of hydrolysates prepared from sea cucumber viscera.
用外源蛋白酶酶解是目前常用的制备生物活性肽的方法。它不仅具有酶解过程可控性和重现性较好的优点,而且可供使用的蛋白酶种类也比较多,但是往往增加了生产成本[13]。本实验选用八种常用蛋白酶对内脏蛋白进行酶解,在各酶活力最高条件下水解4h,测定水解物的清除自由基活性、水解度和氮回收率,实验结果见图4。八种酶解液均具有清除羟自由基和超氧阴离子自由基活性,其中菠萝蛋白酶酶解液对羟自由基的清除率为63.04%,明显高于其它蛋白酶(p<0.05);其清除超氧阴离子自由基活性与木瓜酶和酸性酶酶解液相当,明显高于胰酶、风味酶、胃酶、中性酶和碱性酶酶解液(p<0.05)。由图4(B、C)还可以看出菠萝蛋白酶酶解液的水解度和氮回收率分别为25.50%和74.29%,与其它蛋白酶相比均处于较高水平。因此,从酶解液的清除自由基活性、水解度和氮回收率来看,菠萝蛋白酶是水解刺参内脏蛋白制备抗氧化肽的最佳用酶,这主要与该酶的酶切位点有关[14]。

图4 外源蛋白酶对刺参内脏蛋白酶解液的清除羟自由基和超氧阴离子自由基活性、水解度和氮回收率的影响Fig.4 Effect of endogenous proteases on the scavenging rate of hydroxyl and superoxide anion radical,degree of hydrolysis and nitrogen recovery of hydrolysates prepared from sea cucumber viscera.
2.3 菠萝蛋白酶酶解工艺条件的优化
通过料液比单因素实验确定菠萝蛋白酶酶解刺参内脏蛋白制备抗氧化肽的最适料液比为1∶9;由加酶量和酶解时间单因素实验可知二者的较好水平分别为4.0g/100g和2h;生产厂家提供菠萝蛋白酶的最适酶解pH为6.8,最适酶解温度为45℃。以上述条件为基础,以pH、温度、加酶量和酶解时间为主要因素,以清除羟自由基和超氧阴离子自由基活性为指标,采用正交设计确定最佳反应条件。菠萝蛋白酶正交实验结果分析见表3。
由表3可知,用菠萝蛋白酶酶解刺参内脏蛋白时,以清除羟自由基活性为指标,对正交实验结果进行极差分析,发现各因素的影响程度依次为酶解时间、pH、温度和加酶量;最佳实验组合为A3B1C3D1,即pH为7.8,温度为35℃,加酶量为5.0g/100g,酶解时间为1h。以清除超氧阴离子自由基活性为指标,对正交实验结果进行极差分析发现温度对其影响最大,其余依次为酶解时间、加酶量和pH;最佳实验组合为 A1B2C3D2,即 pH 为 5.8,温度为45℃,加酶量5.0g/100g,时间为2h。上述两个最佳组合并未出现在正交表中,需要对其进行验证实验。采用两组优化工艺参数对刺参内脏蛋白进行酶解反应,酶解液对羟自由基的清除率分别为79.15%和56.96%,二者具有显著性差异(p<0.05);对超氧阴离子自由基清除率分别为28.57%和35.71%,二者没有显著性差异(p>0.05)。由表3发现,菠萝蛋白酶在实验2的条件下酶解刺参内脏蛋白,所得酶解液对超氧阴离子自由基清除率明显高于两个最优组合条件下的,但是其对羟自由基的清除率要低得多。实验中测定酶解液对羟自由基的清除率时需将酶解液稀释4~8倍,而测定其对超氧阴离子自由基清除率时不需稀释,因此在确定最优水解条件时以酶解液对羟自由基的清除率为主要指标。综上所述,本研究确定菠萝蛋白酶水解刺参内脏蛋白制备抗氧化肽的最佳实验条件为pH7.8、温度35℃、加酶量5.0g/100g、酶解时间1h,在此条件下酶解液对羟自由基和超氧阴离子自由基的清除率分别为79.15%和28.57%,明显高于内源蛋白酶在最适pH和温度条件下水解内脏蛋白得到的酶解液对自由基的清除率。由此可以看出外源蛋白酶是酶解刺参内脏蛋白制备抗氧化肽的较好途径,这可能与外源蛋白酶的多样性和加酶量的可控性有关。
3 结论
刺参内脏中至少有四种蛋白酶存在,其最适反应pH分别为2.0、5.0、8.0和12.0,以pH2.0条件下的酶活力最高,相对应的最适反应温度分别为60、55、45、50℃。内源蛋白酶在pH8.0、温度45℃的条件下酶解刺参内脏蛋白,所得酶解液对羟自由基和超氧阴离子自由基清除率较高,分别为47.67%和24.98%。通过外源蛋白酶筛选实验确定菠萝蛋白酶为水解内脏蛋白制备抗氧化肽的最佳用酶,由正交实验确定其最适酶解条件为pH7.8、温度35℃、加酶量5.0g/100g、酶解时间1h,该条件下得到的酶解液对羟自由基和超氧阴离子自由基的清除率分别为79.15%和28.57%。综上所述,由刺身内脏酶解制备的多肽表现较好的清除自由基的能力,作为功能因子用于抗衰老保健品和化妆品具有巨大的开发潜力。
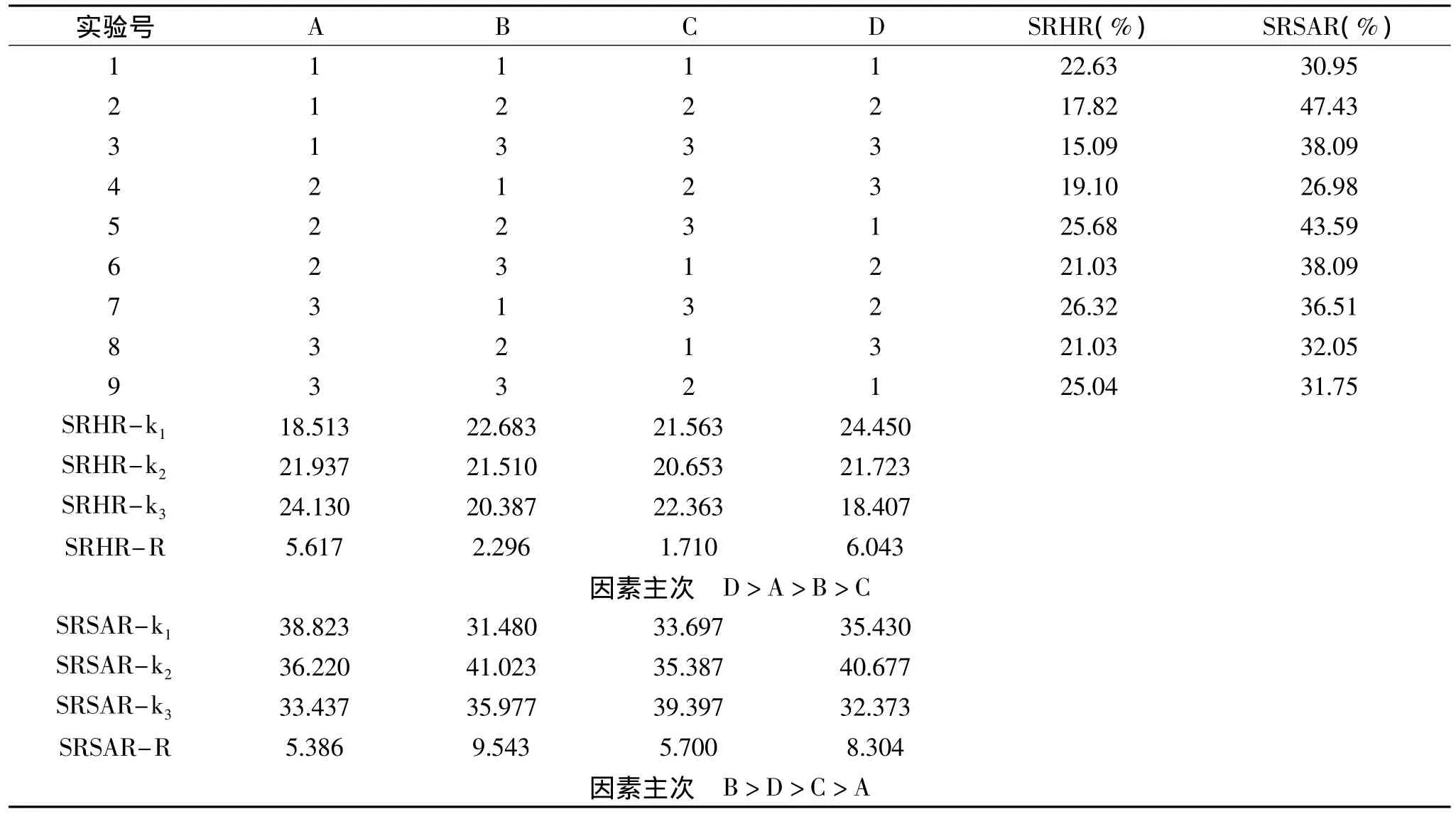
表3 菠萝蛋白酶酶解条件正交实验方案与结果分析Table 3 The design and results of orthogonal test of bromelain
[1]樊金娟,罗霞,付岩松,等.米糠抗氧化肽大鼠体外抗氧化作用研究[J].食品科学,2010,31(9):251-254.
[2]刘小芳,薛长湖,王玉明,等.乳山刺参体壁和内脏营养成分比较分析[J].水产学报,2011,35(4):587-593.
[3]李冬燕,曹荣,刘淇,等.海参肠高效酶解工艺研究[J].湖南农业科学,2012,3:84-86.
[4]赵鸿霞,周大勇,秦磊,等.响应面法优化海参卵酶解工艺[J].食品与机械,2012,26(5):114-117.
[5]Fu X,Xue C,Miao B,et al.Characterization of proteases from the digestive tract of sea cucumber(Stichopus japonicus):High alkaline protease activity[J].Aquaculture,2005,246:321-329.
[6]张照昱,邢俊德,张朝峰,等.孔雀绿褪色光度法检测Fenton反应产生的羟自由基[J].太原理工大学学报,2009,40(2):113-116.
[7]胡文婷,孙谧,王跃军.栉孔扇贝(Chlamys farreri)中抗氧化肽的分离纯化及性质研究[J].海洋与湖沼,2006,37(1):14-19.
[8]启航,董秀萍,高杨,等.海参体壁粗蛋白酶的提取及酶学性质研究[J].食品研究与开发,2007,28(3):4-8.
[9]Phanturat P,Benjakul S,Visessanguan W,et al.Use of pyloric caeca extract from bigeye snapper(Priacanthus macracanthus)for the production of gelatin hydrolysate with antioxidant activity[J].LWT-Food Science and Technology,2010,43:86-97.
[10]Hou H,Li B,Zhao X,et al.Optimization of enzymatic hydrolysis ofAlaska pollock frame for preparing protein hydrolysates with low-bitterness[J].LWT-Food Science and Technology,2011,44:421-428.
[11]Zhou D,Zhu B,Qiao L,et al.In vitro antioxidant activity of enzymatic hydrolysates prepared from abalone(Haliotis discus hannaiIno)viscera[J].Food and Bioproducts Processing,2012,90:148-154.
[12]Kristinsson H G,Rasco B A.Fish protein hydrolysates:production,biochemical and functional properties[J].Critical Reviews in Food Science and Nutrition,2000,40:43-81.
[13]Aspmo S I,Horn S J,Eijsink V G H.Enzymatic hydrolysis of Atlantic cod(Gadusmorhua L.)viscera[J].Process Biochemistry,2005,40:1957-1966.
[14]Bayram T,Pekmez M,Arda N,et al.Antioxidant activity of whey protein fractions isolated by gel exclusion chromatography and protease treatment[J].Talanta,2008,75:705-709.

