反胶团萃取分离红豆蛋白质
杨秋慧子,张志宽,陈雨泰,曹 礼,2,张喜峰
(1.南京农业大学食品科技学院,江苏南京210095;2.河西学院农业与生物技术学院,甘肃张掖734000)
红豆,又称赤豆、小豆、赤小豆、饭豆,为一年生豆科植物,色泽鲜红、淡红或深红。已有研究证明红豆中含有蛋白质、脂肪、淀粉、膳食纤维、B族维生素等营养物质[1-3]。因此,红豆具有较高营养价值。我国对红豆蛋白质开发利用有限,高效充分提取蛋白质,促进红豆蛋白功能食品加工可持续发展,以期为红豆蛋白利用开辟新的途径。红豆蛋白质现有分离纯化技术包括:碱溶酸沉法[4]、酶解法[5-6]、微波辅助提取法[7]。碱溶酸沉法易导致蛋白质构象变化,蛋白质发生聚集。酶解法周期较长,在分离提取蛋白质同时引入酶组分,增加分离纯化难度。微波辅助提取法仅适用于热稳定性物质的提取,对于热敏性物质,微波加热可能使其变性或失活。微波萃取过程中细胞因受热而破裂,一些不希望得到的组分也会溶解于溶剂中,从而使微波萃取的选择性显著降低。反胶团萃取是近年来发展起来的一种新型萃取技术,主要适合于蛋白质的提取和分离,具有操作简单、处理量大、成本较低、前萃取和后萃取同时进行的优点[8]。且反胶束内的环境接近细胞内的环境,蛋白质不易变性[9]。本实验采用阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)反胶团体系萃取红豆中蛋白质。采用Plackett-Burman(PB)实验综合考察水相pH、表面活性剂浓度、离子强度、蛋白质浓度、有机溶剂与助剂种类和比例、萃取时间、萃取温度对萃取率的影响,然后利用最陡爬坡实验及Box-Behnken设计选取对影响前萃取率的显著因素进行中心组合实验,获取最佳前萃取条件,在该条件下进行反萃取实验,为红豆中蛋白质的提取条件的优化提供理论依据。
1 材料与方法
1.1 材料与仪器
红豆 购于甘肃省张掖市甘州区新乐超市;正丁醇 天津市富宇精细化工有限公司;正辛醇 广州市金华大化学试剂有限公司;十六烷基三甲基溴化铵、正己醇 天津市光复精细化工研究所;异辛烷、氯仿正辛烷 天津市百世化工有限公司;柠檬酸、磷酸氢二钠、氯化钠 天津开发区海光化学制药厂;牛血清白蛋白 科昊生物工程有限责任公司。
PL203电子天平 梅特勒-托利多仪器(上海)有限公司;DKB-501数显超级恒温水浴锅、DHG-9101.1电热恒温鼓风干燥箱 扬州市三发电子有限公司;752N型分光光度计 上海精密科学仪器有限公司;CR-21高速离心机 日本日立;漩涡混合器上海精科实业有限公司。
1.2 实验方法
1.2.1 红豆中蛋白质的提取 称取5g红豆粉末置于100mL磷酸二氢钠-磷酸氢二钠缓冲液中,在常温下搅拌使之混匀,静置30min,将得到的悬浊液于6000r/min离心10min,倾倒上清液可得到含红豆蛋白质的粗提液,测定水相中蛋白质含量。
1.2.2 反胶团溶液的配制[10]将CTAB以一定比例溶于有机溶剂(烷)和助剂(醇)的混合液中,充分摇匀至溶液透明为止。
1.2.3 反胶团的前萃取[11]在20mL试管中加入等体积的红豆蛋白粗提液和反胶团溶液(均为5mL),在漩涡混合器上以60次/min的频率振荡试管5min使两相充分混合,然后静置至分相,测定水相中蛋白质含量,计算萃取率。
1.2.4 反胶团的反萃取[12]用去离子水配制适当pH和离子强度的缓冲液作为反萃取水相,与前萃取所得的有机相混合(均为5mL),在漩涡混合器上以60次/min的频率振荡试管5min使两相充分混合,然后静置至分相。测定水相中蛋白质含量,计算反萃取率。
1.2.5 紫外吸收法测定蛋白质含量[13]用柠檬酸-磷酸氢二钠缓冲液将牛血清白蛋白(BSA)配成0.1、0.2、0.4、0.6、0.8、1.0mg/mL 不同梯度的溶液,以柠檬酸-磷酸氢二钠缓冲液为空白对照,在280nm波长下测吸光值,以吸光值为A280纵坐标,牛血清白蛋白含量为横坐标(mg/mL)作标准曲线。作线性回归,得直线方程为:Y=0.5436X+0.0277(R2=0.991)
红豆中蛋白质的前萃取率E、反萃取率E'的计算如下式所示:

式中:C0为提取液中蛋白质的浓度(mg/mL),C1为前萃取平衡后水相中蛋白质的浓度(mg/mL),C2为反萃取后水相中蛋白质的浓度(mg/mL)。
2 结果与讨论
2.1 前萃取
2.1.1 有机溶剂与助剂种类对萃取的影响 实验在已确定阳离子表面活性剂CTAB的基础上,考察不同种醇类、烷类有机溶剂作为反胶团有机相与助剂体系对萃取的影响,结果如表1所示。从表1可知,不同的溶剂与助剂组合,在萃取过程中对分相时间和澄清度均有影响。

表1 溶剂与助剂体系对萃取的影响Table 1 Effect of the system of organic solvent and complex solubilizer on extraction yield of protein from red beans
大多数表面活性剂在脂肪族有机溶剂如己烷、庚烷、异辛烷等中的溶解性较差,难以形成稳定的反胶束体系,不利于蛋白质的萃取。助溶剂有助于表面活性剂分散在有机相中形成反胶团,从而提高蛋白质的萃取率。这是由于助溶剂分子插入到表面活性剂分子之间,减弱了表面活性剂的内聚力和松懈了表面活性剂在有机相中的排列,则使大分子表面活性剂易溶于有机相形成反胶团,利于蛋白质的溶解。综上所述,本实验最终采用正丁醇-氯仿的反胶团体系来考察其它主要因素对红豆中蛋白质萃取率影响。
2.1.2 Plackett-Burman设计筛选影响红豆蛋白质萃取率显著因素 在前期预实验基础上,本次实验采用次数n=12的Plackett-Burman设计从7个影响因素中筛选出具有显著影响因素。每个因素取2个水平:即高水平和低水平以尽快而有效地筛选出最为重要的几个因素。实验设计及结果如表2、表3所示。
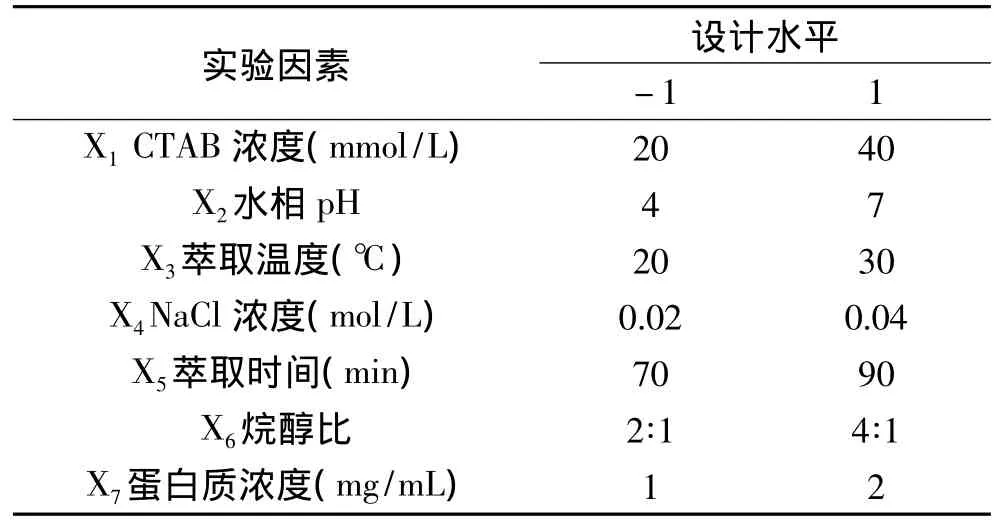
表2 Plackett-Burman实验因素水平范围Table 2 Factors and levels in the Plackett-Burman design
对这7个因素的效应分析结果见表4。一般认为影响值较大的因素对系统的贡献比较大,从表4可以看出,所考察的7个因素对红豆蛋白质提取率的影响顺序依次为 X5>X2>X1>X3>X4>X6>X7。通过Plackett-Burman实验设计结果可以看出 X5、X2、X1这三个因素为显著因素,X3、X4、X6、X7对结果的影响不大,为非显著因素。下一步通过最陡爬坡实验逼近萃取条件的最佳区域。
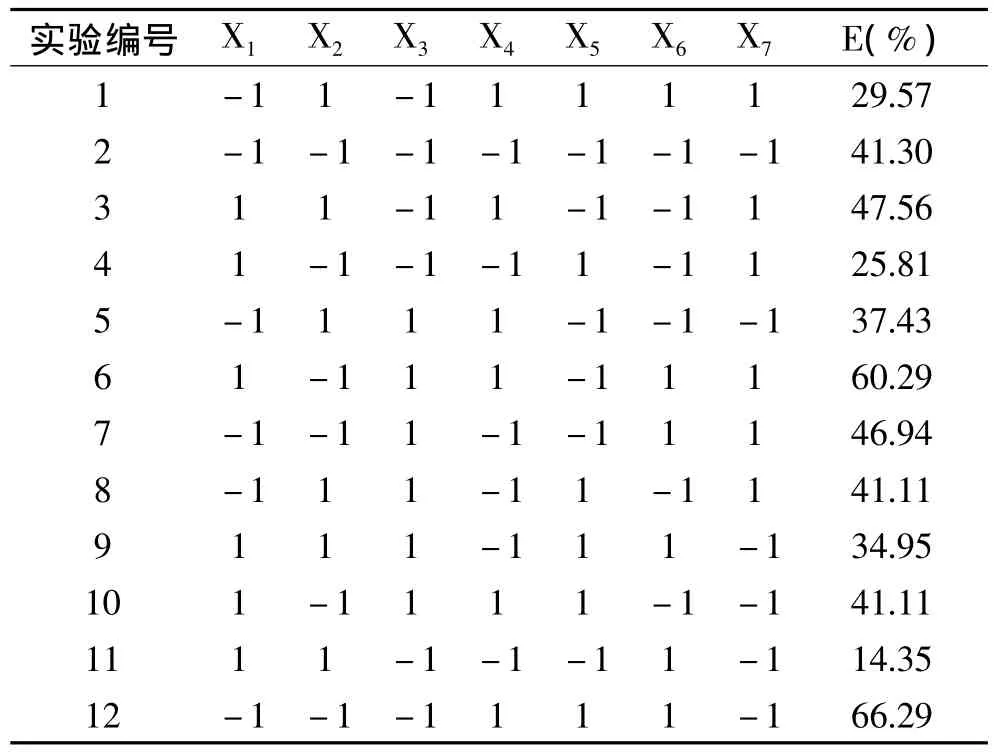
表3 Plackett-Burman实验设计及结果(n=12)Table 3 Plackett-Burman design matrix and corresponding results(n=12)
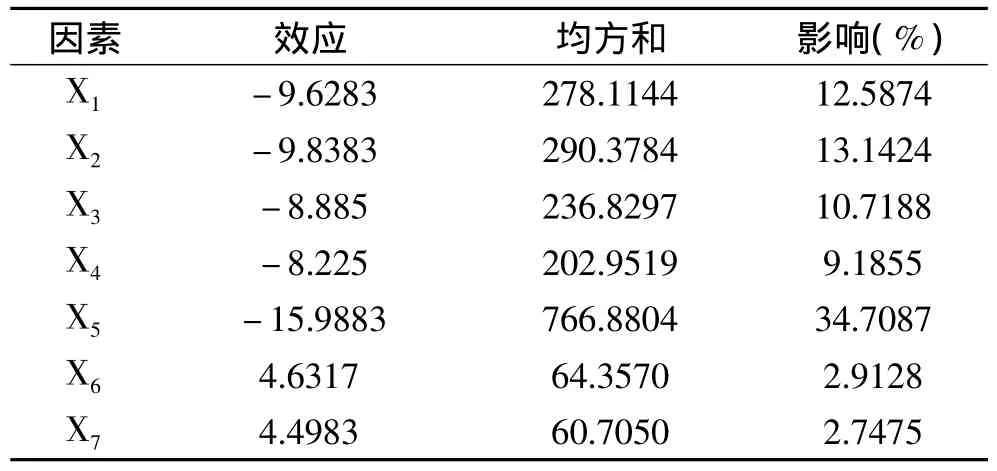
表4 Plackett-Burman实验因素水平及其效应评价Table 4 Levels and effects of six factors after Plackett-Burman design optimization
2.1.3 最陡爬坡实验的设计及结果 响应面拟合方程只有在考察的临近区域里才能充分近似真实情况,所以应先逼近最大萃取区域后再建立有效的拟合方程[14]。根据 Plackett-Burman法找出显著因素后,再进行最陡爬坡实验,要先逼近最佳萃取区域后再建立有效地响应面拟合方程。显著因素萃取时间、水相pH、CTAB浓度的变化及方向的实验设计结果见表5,不显著因素表现为正效应的取高水平,表现为负效应的取低水平[15]。

表5 最陡爬坡实验设计及结果Table 5 Steepest ascent design and corresponding results
由以上结果可知,最大萃取率在6号实验附近,故选其做中心点,萃取时间为90min、水相pH为4.5、CTAB浓度为40mmol/L。
2.1.4 响应面交互作用分析与显著因素最佳值的确定 根据最陡爬坡确定的实验因素中心点,设计的响应面因素及水平如表6所示,采用Box-Benhnken设计,其结果如表7所示。
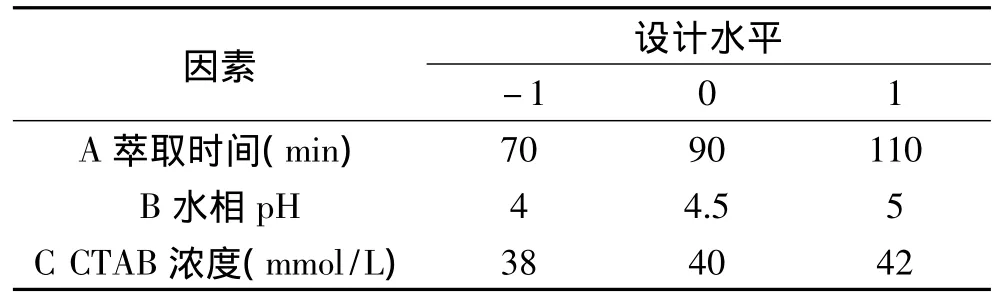
表6 Box-Benhnken实验因素及水平Table 6 Factors and levels in the Box-Benhnken experimental design

表7 Box-Benhnken响应面实验设计及结果Table 7 The experimental design and results for response surface analysis
运用Design-Expert8.0.5.0软件进行二次回归拟合后,得到以下回归方程:

从表8方差分析可以看出,模型p<0.01,表明该模型是显著。同时模型中参数B、A2、B2、C2影响是极显著的,其余项的影响不显著。模型失拟项(lack of fit)的p>0.05,不显著,说明该模型不需要引入更高次数的项,模型选择合适。同时,模型的相关系数R2=0.9350,说明模型拟合程度很好。变异系数(C.V)反映模型的置信度,C.V值越低模型的置信度越高,本实验的C.V=3.49%,说明模型方程能够很好地反映真实的实验值。所以,我们可以使用该模型来分析响应值的变化。
通过Design-expert8.0.5.0软件绘制了三维响应面曲面图,从响应面立体图可以看出,AB、AC、BC三个交互作用都不显著。当各因素从四周逐渐趋向中心点时,立体图中的曲面越凸,则说明各因素的值越靠近中心点时,红豆蛋白质的萃取率越大,响应值存在最大值。通过Design-Expert8.0.5.0软件分析计算得出,当预测的响应值最大时,三个因素的最佳值为:萃取时间 90min、水相 pH4.3、CTAB浓度40.24mmol/L,预测提取率最大值为53.5956%。

表8 Box-Benhnken Design回归模型方差分析Table 8 Analysis of variance of the fitted regression modle
2.1.5 模型验证实验 为了验证建立的模型与实验结果是否相符,根据以上实验中的结果确定的最佳条件:萃取时间 90min、水相 pH4.3、CTAB浓度40.24mmol/L,进行了3组验证实验,得到的最大提取率为56.85%,这与预测值53.5956%相接近,证明拟合模型能较好的反映红豆蛋白质前萃取的最佳条件。
2.2 反萃取
在前萃取Plackett-Burman设计和中心组合法的实验基础上进行反萃取实验,反萃取实验在前萃取的最优条件(水相pH4.3、CTAB浓度40.24mmol/L、时间90min)下进行。
2.2.1 反萃水相pH对红豆蛋白反萃取率的影响配制不同 pH(3.0、4.0、5.0、6.0、7.0)缓冲溶液,与固定的有机相等体积混合(均为4mL)进行反萃取,反萃时间90min,反萃温度20℃,结果如图2所示。
CTAB是一种阳离子表面活性剂,形成的反胶团核内带正电,进行反萃取时,要求蛋白质带正电荷,由于静电斥力作用,反胶束的蛋白质被反向萃取出来,实现了蛋白质的反萃,所以水相pH应小于红豆蛋白质pI=3.6。但pH过低会引起生物活性的丧失,从而导致反萃取率下降。如图2所示,水相pH大于红豆蛋白质pI=3.6时,蛋白质带有负电荷,且反萃取率较高。此现象无法用静电相互作用机理来阐释,可能还存在其它相互作用,有待进一步研究。因此综上可知,反萃取的最佳pH为6。
2.2.2 NaCl浓度对反萃取率的影响 配制含不同NaCl浓度(0.8、0.9、1.0、1.1、1.2mol/L)pH 为 6 缓冲溶液,与固定的有机相等体积混合(均为4mL)进行反萃取,反萃时间90min,反萃温度20℃,结果如图3所示。
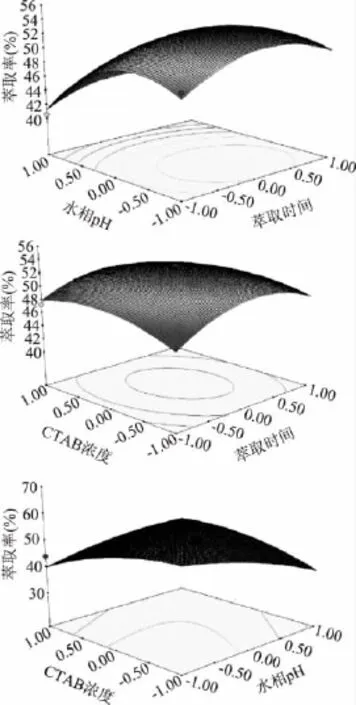
图1 各因素交互作用的响应面图Fig.1 Response surface plot for the pairwise interactive effects of CTAB concentration,pH and extraction time on forward extraction yield
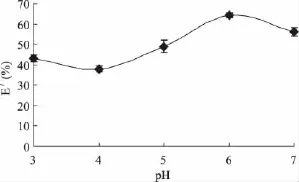
图2 pH对红豆中蛋白质反萃取率的影响Fig.2 Effect of pH value in aqueous phase on back extraction yield of protein from red beans

图3 NaCl浓度对红豆中反萃取率的影响Fig.3 Effect of NaCl concentration on back extraction yield of protein from red beans
如图3所示,反萃取率随着NaCl浓度的增加而增加,但当NaCl浓度增加到一定值后,蛋白质的反萃取率逐渐降低。这是由于NaCl浓度增加时,表面活性剂周围的双电层厚度变薄,减小了表面活性剂极性头之间的排斥作用使反胶团变小,从而使蛋白质在内相的增溶量减小,反萃取率增加[12]。但是NaCl浓度过高对蛋白质会产生盐析作用,导致蛋白质的反萃取率降低。因此实验最终确定NaCl浓度为1.1mol/L。
2.2.3 反萃取温度对反萃取率的影响 配制含NaCl浓度为1.1mol/L,pH为6的溶液,在不同温度(20、25、30、35、40℃)下与固定的有机相等体积混合(均为4mL)进行反萃取,反萃时间90min,结果如图4所示。
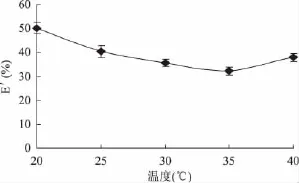
图4 反萃温度对红豆中蛋白质反萃取率的影响Fig.4 Effect of temperature on back extraction yield of protein from red beans
由图4可得,随着温度的升高,蛋白质的反萃取率逐渐下降,之后有回升,但起始位于最高点。这是因为随着温度的升高会影响反胶团体系的行为,导致独立水相析出,释放出其中的蛋白质,故反萃取率降低[16]。因此实验选定反萃取温度为20℃。
在20℃,含NaCl浓度为1.1mol/L的pH为6.0缓冲溶液进行蛋白质反萃取,红豆蛋白质的反萃取率可达64.96%。
3 结论
采用Plackett-Burman(PB)实验、最陡爬坡实验和响应面分析对反胶团萃取红豆蛋白质提取工艺进行优化。首先,采用Plackett-Burman设计从影响反胶团萃取的效果的7因素组合实验中筛选出具有显著效应的3个因素:萃取时间、水相pH、CTAB浓度。在此基础上,通过最陡爬坡实验逼近最大萃取率区域,然后Box-Behnken对显著因素进行优化,得出最佳萃取工艺条件为pH为4.3、NaCl浓度0.02mol/L、CTAB浓度40.24mmol/L、蛋白质浓度2mg/mL、萃取时间90min、萃取温度20℃。萃取条件优化后实验测得红豆萃取率为56.85%。温度为20℃,含NaCl浓度为1.1mol/L的pH为6.0缓冲溶液进行蛋白质反萃取,反萃取率可达64.96%。
[1]韩涛,王磷,李丽萍,等.红小豆纤维饮料的研究[J].食品工业科技,1996,17(3):20-22.
[2]霍丽芬,王强.红小豆乳饮料及其制备方法[P],中国:CN1465279,2004.
[3]王海棠,张玉清,马向东,等.红豆红色素的性质研究[J].郑州工程学院学报,2001,22(4):54-57.
[4]黄科礼,尹寿伟,杨晓.微射流处理对红豆分离蛋白结构及功能特性的影响[J].现代食品工业,2011,27(9):1062-1065.
[5]李杨,江连洲,刘琪,等.酶法水解红豆粉特性的研究[J].食品工业科技,2011,32(11):177-180.
[6]梁英岳.红豆蛋白的酶法水解工艺及其抗氧化肽的研究[D].广州:暨南大学,2010.
[7]扶庆权,张李阳,徐鉴.微波辅助提取红豆蛋白的工艺研究[J].食品工业,2012(2):71-73.
[8]吴雅睿,刘建,李宇亮,等.CTAB/正丁醇/异辛烷反胶团法纯化 α-淀粉酶[J].应用化工,2007,36(8):737-744.
[9]刘俊果,邢建民,畅天狮,等.反胶团萃取分离纯化纳豆激酶[J].科技通报,2006,51(2):133-137.
[10]甘林火,翁连进.反胶团萃取分离地木耳中藻蓝蛋白[J].化工进展,2010,29(12):2362-2367.
[11]刘杨,王雪青,庞广昌.反胶团萃取分离螺旋藻藻蓝蛋白[J].天津科技大学学报,2008,23(2):30-33,64.
[12]陈银鹤,郑竟成.反胶团萃取菜籽蛋白质和油的反萃工艺研究[J].粮油加工,2008,(11):69-71.
[13]刘叶青.生物分离工程实验[M].北京:高等教育出版社,2007.
[14]Li C,Bai JH,Cai ZL.Optimization of a cultural medium for bacteriocin production by Lactococcus lactis using response surface methodology[J].Journal of Biotechnology,2002,93:27-34.
[15]张蕾,张铎,张丽萍,等.枯草芽孢杆菌BSD-2产抗菌肽发酵培养基的优化[J].食品科学,2010,31(3):189-192.
[16]夏传波,杨延钊.反胶团萃取蛋白质技术的反萃取过程研究进展[J].中国生物工程杂志,2009,29(1):134-138.

