胶体金免疫层析法快速检测食品中庆大霉素残留
杨 俊,余晓峰,周伟伟,李红卫,王开萍,刘国庆,*
(1.合肥工业大学生物与食品工程学院,安徽合肥230009;2.安徽出入境检验检疫局技术中心,安徽合肥230022)
庆大霉素(Gentamicin,GM)属于氨基糖苷类抗生素,主要作用于革兰氏阴性细菌,是一种应用广泛的广谱抗菌药物[1]。由于其抗菌谱广、疗效佳,且价格低廉而被广泛用于畜禽饲料中。GM的血清有效浓度与毒性浓度很相近,安全范围较小,在其应用过程中易产生毒副作用,食品中的过量残留会对食品安全造成严重威胁[2]。庆大霉素的毒性主要表现为损害人体器官前庭和耳蜗神经,导致眩晕和听力减退[3]。此外,还会引起耳毒性和肾毒性[4]。庆大霉素残留理化分析检测方法主要有气相色谱法(GC)[5]、高效毛细管电泳法(HPLE)[6]、高效液相色谱法(HPLC)[7]、液相色谱—质谱联用分析法(LC/MS)[8]等,但这些分析检测方法对样品前处理的要求非常高,而且检测设备非常昂贵。而以抗原与抗体的特异性反应结合为基础的免疫学方法具有快速、灵敏、特异性高等特点,是残留检测的有效方法。目前应用于抗生素检测的免疫分析方法有放射免疫测定法(RIA)、酶联免疫吸附测定法(ELISA)、底物标记荧光免疫测定法(SLFIA)、固相免疫传感器法(SIS)和胶体金免疫层析法(GICA)。目前尚未见到庆大霉素胶体金层析检测方法的研究报道。因此,本实验通过制备庆大霉素的单克隆抗体,建立以胶体金免疫层析技术[9-10]为基础的食品中庆大霉素残留快速检测方法,该方法的建立为食品中其他药物残留的快速检测提供有利的技术支持。
1 材料与方法
1.1 材料与仪器
庆大霉素标准品、四环素标准品、链霉素标准品、卡那霉素标准品 上海生工生物工程有限公司;氯金酸(HAuCl4·4H2O)、柠檬酸三钠、牛血清白蛋白(BSA)、聚乙二醇(PEG20000)海藻糖、Tween20 国药集团化学试剂有限公司;庆大霉素单克隆抗体、庆大霉素偶联抗原、庆大霉素ELISA酶联免疫试剂盒北京博奥森生物技术有限公司;硝酸纤维素膜(NC膜)、玻璃纤维、样品垫、吸水纸、羊抗兔二抗 上海捷一生物技术有限公司。
721E型紫外可见分光光度计 上海光谱仪器有限公司;H800型透射电镜显微镜 日本日立公司;PHSCAN10型pH计 METER公司;MA型磁力搅拌器 德国Electromantle公司;QL-20G-Ⅱ型高速冷冻离心机 Sigma公司;JY-EQ03型连续式划膜仪、JY-EQ04型喷金机 上海杰一生物有限公司;SUNRISE酶标定量检测仪 奥地利SUNRISE有限公司。
1.2 实验方法
1.2.1 胶体金颗粒的制备 玻璃器皿的洗涤[11]:实验用所有玻璃器皿先用自来水冲洗干净,再用重铬酸钾洗液(1000g重铬酸钾,2500mL浓硫酸,加蒸馏水至10000mL)浸泡48h,取出,大量自来水冲洗,洗洁精洗涤,蒸馏水冲洗3遍,蒸馏水浸泡24h后用去离子水冲洗三次,烘箱烘干后备用。
试剂的配制要求:所有配制试剂用水为双蒸水或三蒸水,用0.22μm微孔滤膜过滤后使用。
准确称取1g氯金酸溶于100mL双蒸水中配成1%氯金酸溶液,然后将5mL 1%氯金酸溶液加入495mL超纯水配制成0.01%氯金酸溶液,取100mL 0.01%氯金酸在电磁炉上加热煮沸后立即加入2.4mL 1%柠檬酸三钠溶液,溶液的颜色由黄色→紫色→深蓝→酒红色,当溶液的颜色完全变为透明的酒红色时,继续回流8min后停止加热,冷却至室温,4℃低温贮存。
1.2.2 胶体金的电镜观察和紫外扫描 将制备好的胶体金分别进行电镜观察和紫外扫描,测量其颗粒大小和最大吸收波长[12]。
1.2.3 金标抗体的制备[13]取10mL胶体金溶液,用0.2mol/L K2CO3调pH为9.0,用磁力搅拌器搅拌均匀。于事先确定的最佳标记量将抗体逐滴加入与胶体金偶联,常温搅拌30min,然后逐滴加入10%BSA至终浓度为1%,搅拌反应30min,最后逐滴加入10%PEG20000至终浓度为1%,继续搅拌30min。在4℃,2000r/min离心20min,取上清液于10000r/min离心50min,吸去上清液。然后用重悬液(含质量浓度为 0.5%0.01mol/L pH7.4 PBS,0.5%BSA,1% 海藻糖,体积浓度为0.1%Tween20)将沉淀恢复到原体积,于4℃,10000r/min离心50min,重复离心3次,最后重悬至原体积的1/10,加入0.01%的叠氮钠于4℃保存备用。
1.2.4 试纸条的组装 用连续式划膜仪把0.5mol/L的GM-BSA及羊抗兔IgG喷于硝酸纤维素薄膜(NC膜)上,分别作为检测线(T线)和质控线(C线),37℃烘干。然后将其浸入NC膜处理液(含质量浓度为 6% 的蔗糖,1% 海藻糖,0.1%Tween20,0.5%0.01mol/L pH7.4 PBS)中30min,37℃烘干。用同样方法把将制备好的0.5mol/L胶体金单克隆抗体喷于金标抗体结合垫上。将NC膜贴于PVP纸板上;将吸水纸压在NC膜上方约1mm处贴于PVP纸板上;将金标结合垫压在NC膜下方约1mm处贴在PVP底板上;将样品垫压住金标结合垫,留出金标结合垫约2mm贴于PVP底板上。最后用切片机裁剪为3mm宽的试纸条放入加有干燥剂的铝箔袋内密封保存。
1.2.5 试纸条的检测方法 将试纸条的样品垫浸入待测样品中,样品液在毛细作用下自下往上泳动,金标结合垫上的金标抗体溶解于样品液中,若样品中不含待测物,则金标抗体会在检测线和NC膜上的包被抗原发生免疫反应,使胶体金颗粒发生聚集形成红色的线条,剩余的金标抗体会继续向上泳动,与控制线上的羊抗兔二抗发生第二次免疫反应,也会出现红色线条,这样NC膜上就出现了两条红色线条,表明样品为阴性。若样品中含待测物,则当样品液泳动到结合垫时,金标抗体首先会与样品中的待测物发生免疫反应,若金标抗体有剩余,才会在检测线上与包被抗原发生免疫反应,形成红色线条,线条颜色强度会明显弱于阴性的线条强度;若金标抗体没有剩余,则不会与检测线上的包被抗原发生反应,没有红色线条出现。控制线是作为检验金标免疫层析方法是否有效的指标而设定的,无论待测样品中是否存在待测物,控制线都会显色。如果控制线不显色,说明试纸条失效[14]。

图1 试纸条示意图Fig.1 Sketch map of an IC strip
1.2.6 试纸条的灵敏度和检测范围 配制标准质量浓度 0、0.5、0.7、0.9、1.0、5.0、10、20、100μg/mL 的待测液,将试纸条分别插在10mL待测溶液中,10min取出试纸条观察阴性和阳性结果,每个浓度重复5次。如果C线和T线亮度基本一致则说明是阴性结果;如果C线明显比T线亮则说明是阳性结果;如果两条线都没出现则说明试纸条失效。
1.2.7 试纸条的稳定性和重复性实验 将试纸条密封分别存放在4、25、37℃环境中,观察不同温度对试纸条的影响。每隔3d取出不同温度下的试纸条4支分别检测 0、5、10、100μg/mL 的 GM 待测液,持续30d,查看其稳定性。对同一批次的试纸条以及不同批次的试纸条在不同GM浓度下测试,每个浓度设置10个重复,检查其一致性。
1.2.8 试纸条的特异性实验 分别配制0、0.5、1.0、2.0、5.0μg/mL的四环素、链霉素、卡那霉素标准溶液,用试纸条检测,每个浓度重复实验5次,判断试纸条的特异性。

表1 庆大霉素试纸条的灵敏度检测Table 1 Sensitivity of GM test strip
1.2.9 检测样品 称取1.0g猪肉4份,均质后转入4个 50mL 的离心管中(编号为1、2、3、4 号),每一管分别加入5mL的去离子水,然后在1号管中加入50μg GM-PBS(500μg/mL,100μL),2 号管中加入 5μg GM-PBS(500μg/mL,100μL),3 号管中加入5μg GM-PBS(500μg/mL,100μL),4 号管中加入 100μL 去离子水,涡旋30s。加入3%三氯乙酸6mL,2500r/min振荡1min。混匀后,5000r/min离心10min。避开上层脂肪层,取150μL清液于2min离心管中,加入PBS缓冲液,用NaOH溶液调节pH到7.4,即为样品检测液。分别加入50μL于试纸条检测孔中,每个重复3次,10min判定结果。同时用ELISA方法进行对比[15-16]。
2 结果与分析
2.1 胶体金的质量分析结果
将制备好的胶体金经紫外可见光分光光度计在425~675nm波长范围内扫描,以超纯水做参比,在518nm处有最大吸收峰,OD值为2.353,见图2。胶体金溶液经20000倍透射电镜放大观察结果显示,制备的胶体金呈球形颗粒,而且分散均匀,随机测量60个颗粒,直径均在20nm左右,表明制备的胶体金颗粒良好,见图3。
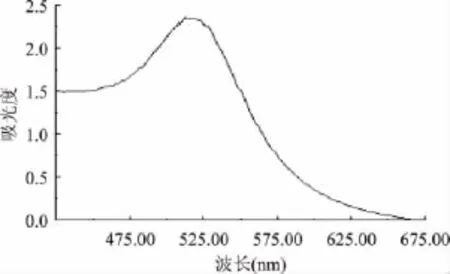
图2 胶体金紫外可见光分光光度计扫描图Fig.2 Determination of colloidal gold by spectrophotometry
2.2 试纸条的测试结果
2.2.1 试纸条的灵敏度结果 用试纸条分别测试浓度为0、0.5、0.7、0.9、1.0、5.0、10、20、100μg/mL 的庆大霉素标准液,从图4可以看出,庆大霉素浓度为0.5μg/mL时,T线和C线均显色为阴性;当庆大霉素浓度为0.7μg/mL时,T线颜色变淡为弱阳性;当庆大霉素浓度为0.9μg/mL时,T线颜色基本消失为阳性;当庆大霉素浓度大于0.9μg/mL时,T线彻底消失为强阳性;测试结果列表1如下。由此说明,该试纸条的灵敏度为0.7μg/mL。

图3 胶体金透射电镜图Fig.3 Determination of colloidal gold by transmission electron microscope

图4 标准品GM在不同浓度下C/T的颜色变化Fig.4 GM standards in different concentrations showing the color intensity of test and control lines
2.2.2 试纸条的稳定性结果 在4、25、37℃环境中放置30d的试纸条分别测试浓度为0μg/mL的庆大霉素标准液,发现C线和T线显色效果明显,试纸条的检测效果变化不大,这说明温度对试纸条的影响不大,而且试纸条至少可以在不高于37℃的条件下保存一个月而不失效。进一步实验发现,同一批次的3个平行试纸条在不同GM标准液浓度下的测试结果大体一致,随机抽取相同GM浓度不同批次5组试纸条测试结果对比也无明显的差异,说明试纸条重复性较好。以上是基于重复10次后得出的结果,证明该试纸重复性良好。
2.2.3 试纸条的特异性结果 试纸条分别测试浓度为1.0μg/mL的庆大霉素、四环素、链霉素、卡那霉素标准溶液,测试结果如图6。测试浓度为1.0μg/mL的庆大霉素时,C线显色,T线不显示,检测结果为阳性;测试其他三种标准溶液时,C线和T线均显色,检测结果为阴性。进一步测试浓度分别为0、0.5、1.0、2.0、5.0μg/mL的四环素、链霉素、卡那霉素标准溶液,得到结果如表2所示。可以看出,庆大霉素试纸条与四环素、链霉素、卡那霉素无交叉反应,说明试纸条特异性良好,只对GM有特异性结合。

图5 试纸条的稳定性测试Fig.5 Stability of the GM strip

图6 试纸条的特异性测试Fig.6 Specificity of GM test strip
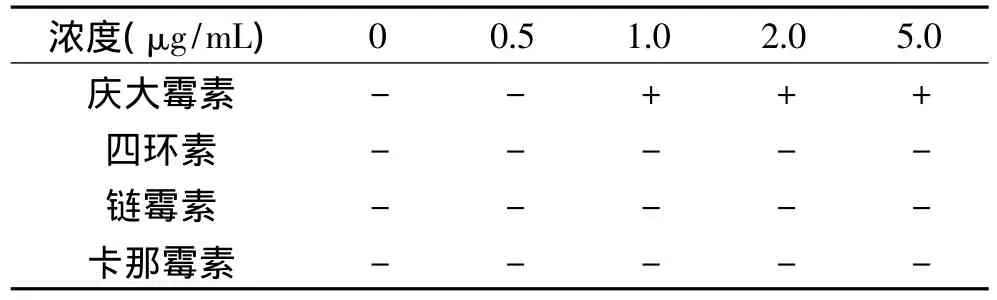
表2 庆大霉素试纸条特异性检测Table 2 Specificity of GM test strip
2.3 样品检测
将处理好的猪肉样品进行ELISA和GICA检测,检测结果如表3所示。从表3中可以看到,4管中GM 含量的理论值分别为 76.72、7.67、0.77、0μg/mL,ELISA测得的 GM 浓度分别为 75.82、7.53、0.75、0μg/mL,而GICA检测结果分别为阳性、阳性、弱阳性、阴性,由此可见,GICA检测结果与ELISA法测得的结果呈现很好的一致性。
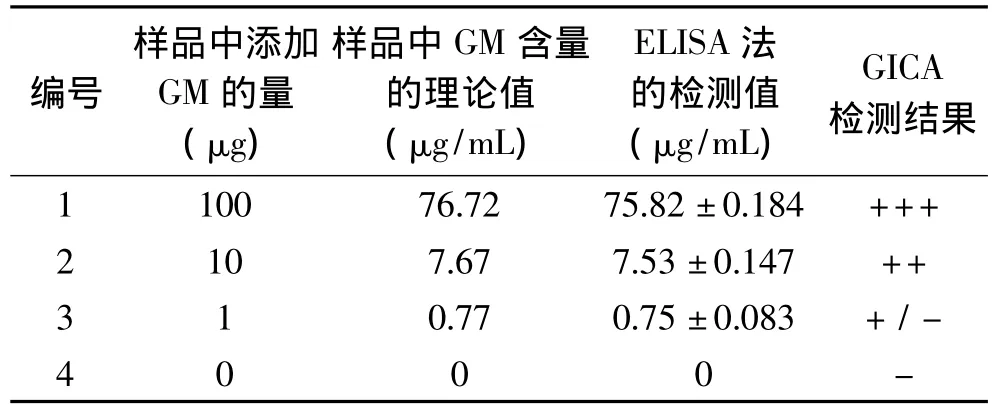
表3 猪肉样品中GM的ELISA和GICA检测结果的比较(n=3)Table 3 Comparison of ELISA and GICA for GM determination in pork samples(n=3)
3 结论
本实验应用胶体金免疫层析法研制出的庆大霉素试纸条,并对试纸条的灵敏度、特异性、准确性和稳定性进行测定。检测结果为庆大霉素检测限为0.7μg/mL,检测时间为10min,试纸条稳定性良好,30d内检测效果无明显差异,特异性强,与其他同类物质无交叉反应,将该方法与ELISA酶联免疫法检测结果进行对比,呈现良好的一致性。该方法检测准确度高、灵敏度高、特异性强、而且安全快捷,便于操作,这为广大的肉类加工厂和一些检测设备相对落后的检测部门提供了一种有效的检测方法。
[1]陈敏艳,孙涛,王香敏,等 .药物残留及其危害[J].动物医学进展,2005,26(10):111-113.
[2]李桂平,张海棠,王自良,等.庆大霉素的毒副作用及其残留检测[J].湖北农业科学,2008,47(6):723-725.
[3]徐亭.庆大霉素单克隆抗体的制备及初步应用[D].扬州:扬州大学,2005.
[4]Walker E M,Fazekas M A,Bowen W R.Nephrotoxic and ototoxic agents[J].Clin Lab Med,1990,10(2):323-54.
[5]Mayhew J W,Gorbach S L.Gas-liquid chromatographic method for the assay of aminoglycoside antibiotics in serum[J].Journal of Chromatogrphy,1978,151:133-146.
[6]Kaale E,Leonaed S,Van Schepdael A,et al.Capillary electrophoresis analysis of gentamicin sulphate with UV detection after pre- capillary derivatization with 1,2- phthalic dicarboxaldehyde and mercaptoacetic acid[J].J Chromatogr A,2000,895(1):67-79.
[7]齐雪琴.电化学液相色谱分析庆大霉素的方法[J].福建分析测试,2006,15(1):4-7.
[8]Cherlet M,Baere S D,Backer P D.Determination of gentamicin in swine and calf tissues by high performance liquid chromatography combined with electrospray ionization mass spectrometry[J].J Mass Spectrom,2000,35(11):1342-1350.
[9]Fauikw P,Talor GM.An immunocolloid method for the electron microscope[J].Immunochem,1971,8(2):1081-1085.
[10]Roth J,Bendayanm,Orci I.Ultrastructural localization of intracellular antigens by the use of protein A-gold complex[J].Histochem Cytochem,l978,26(3):1074-1081.
[11]许定花,刘丽强,郑蓓蓓,等.胶体金免疫层析法参数的优化[J].食品科学,2009,30(20):155-159.
[12]邓省亮,赖卫华,许杨.胶体金免疫层析法快速检测黄曲霉毒素 B1的研究[J].食品科学,2007,28(2):232-236.
[13]付云洁,刘志国,武玉香,等.胶体金免疫层析法快速检测食品中金霉素残留[J].食品科学,2010,31(2):191-194.
[14]Kabilan L,Andersson G,LowA F,et al.Detection of intracellular expression and secretion of interferon-y at the single-cell level after activation of human T cells with tetanus toxoid in vitro[J].Eur J Immunol,1990,20:1085-1089.
[15]李水明,刘丽,李逸瑾,等.肉类食品中庆大霉素残留的监测与分析[J].现代预防医学,2008,35(11):2109-2122.
[16]马伟,汪宝欢,李娟,等.庆大霉素酶联免疫检测法研究[J].食品科学,2009,30(10):242-244.

