薏苡仁油脂质体包封率测定方法研究
雷筱芬,刘玉珍(江西工业贸易职业技术学院,江西南昌330038)
薏苡仁(Coix lachryma-jobi L.var mayuen(Roman)stapf)是禾本科(Gramineae)薏苡属(Coix L.)草本植物薏苡的干燥成熟种仁,是药膳两用原料,具有健脾、补肺、清热、利湿的功效,《本草纲目》称其为上品养心药[1]。薏苡仁中含有约2%~7%左右的薏苡仁油、薏苡仁酯、植物固醇等多种成分。现代药理学研究表明,薏苡仁油具有抗肿瘤、免疫调节、抗病毒等方面的活性[2]。由于薏苡仁油中不饱和脂肪酸含量超过80%,易氧化,不但降低了其营养效价,而且极易导致食品安全问题。将薏苡仁油制备为脂质体,不但提高了其稳定性,而且可以实现靶向输送[3]。包封率一直是脂质体研究的热点,测定方法主要分为两种:一种是直接测定,另一种是将游离药物与脂质体分离后测定。常用的分离方法有透析法、柱层析法,离心法。由于包封率的测定次数十分频繁,柱层析所需时间较长,操作过于繁琐,且凝胶柱不适用于油脂的层析;冷冻超速离心只适于分离少量的小脂质体(约10nm以下)[4]。测定方法也不尽相同,有紫外分析、气相分析、高效液相分析等[5-7]。本实验拟采用透析法研究和测定薏苡仁油脂质体的包封率。
1 材料与方法
1.1 材料与仪器
大豆卵磷脂 上海源聚生物科技有限公司;胆固醇,BR级 上海政翔化学试剂研究所;薏苡仁油 广州合诚三先生物科技有限公司;磷酸盐缓冲液(PBS),pH6.8 按《中华人民共和国药典》2005年版标准配制;其余试剂 均为国产分析纯。
JB-3定时恒温磁力搅拌器 上海雷磁新泾仪器有限公司;JYT-10天平 上海医用激光仪器厂;R205旋转蒸发仪 上海申生科技仪器厂;紫外可见光分光光度计 日本岛津公司;紫外可见分光光度计 北京普析通用仪器有限责任公司;透析袋14000 国药集团化学试剂有限公司;超声波发生器 上海必能信超声有限公司。
1.2 实验方法
1.2.1 薏苡仁油含量测定方法的建立 采用薏苡仁油、卵磷脂、胆固醇的紫外扫描法分析[8]。
分别称取0.2g薏苡仁油、0.2g卵磷脂、0.2g胆固醇,用石油醚溶解并转移至100mL容量瓶中,定容,然后扫描其最大吸收波长。
1.2.2 薏苡仁油脂质体的制备[9]采用薄膜-超声法制备薏苡仁油脂质体。精密称取一定比例的卵磷脂、胆固醇、薏苡仁油于小烧瓶内,加入适量无水乙醚,摇动使其完全溶解,旋转蒸发除去乙醚,形成均匀类脂薄膜;向小烧瓶中加入pH6.8的磷酸盐缓冲液,超声处理(时间30min,功率90W,90%)即得薏苡仁油脂质体混悬液,置冰箱4℃保存。空白脂质体的制备则称取等量脂质溶于乙醇,其余步骤同薏苡仁油脂质体的制备。
1.2.3 薏苡仁油脂质体破壁方法与破壁后混合物的分离纯化
1.2.3.1 破乳剂种类的筛选 以乙醇、甲醇和Triton X-100(聚乙二醇辛基苯基醚)为破乳剂进行考察。精密移取脂质体混悬液1mL,置于25mL容量瓶中,加入其中一种破乳剂5mL,混匀,超声破乳30min,加入50mL石油醚溶解,测定其吸光度,并分别测定同一批次空白脂质体的吸光度作为各自空白对照。
1.2.3.2 超声破壁时间考察 采用超声破壁并结合破乳剂的方法进行脂质体破壁,测定其包封率。考察不同超声时间(10、20、30、40min)对脂质体的破壁效果。
1.2.3.3 薏苡仁油、卵磷脂、胆固醇的溶解特性及薏苡仁油的分离 考察薏苡仁油、卵磷脂、胆固醇在石油醚、冷乙醇及热乙醇中的溶解特性;用溶剂分离法分离薏苡仁油。
1.2.4 薏苡仁油石油醚标准曲线的绘制及其脂质体包封率的测定[10]
1.2.4.1 采用日本岛津的紫外可见分光光度计 扫描薏苡仁油石油醚溶液的最大吸收波长;配制不同浓度的薏苡仁油标准溶液,分别在最大吸收波长下测定其吸光度。以浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
本实验采用透析法除去未包封的薏苡仁油,加入破乳剂结合超声法使包封薏苡仁油游离出来,并测定其吸光度,进而换算出质量。包封率EE(%)计算公式如下:

式中,Wlip为脂质体中包封薏苡仁油的量;Wtot为脂质体混悬液中薏苡仁油总量。
1.2.4.2 透析时间的确定实验 分别量取20mL新制备的脂质体混悬液装入6个透析袋中,扎口后放入烧杯中以磷酸盐缓冲液回流。分别于10、12、14、16、18、20h取出透析后的脂质体,测定其包封率。
1.2.4.3 分离法精密度考察 对同一批薏苡仁油脂质体分别3次取样透析,平行分离,分离后将袋中溶液倒入100mL容量瓶,加入破乳剂,结合超声破壁(30min,功率90W,80%[9]),加入石油醚提取,将混合溶液进行离心(3000r/min,3min),取10mL上清液于25mL容量瓶中,用有机溶剂定容,测定其吸光度A,计算精密度。
1.2.4.4 回收率实验 精密称取薏苡仁油适量,加入空白脂质体中,分离后收集薏苡仁油溶解液10mL置于25mL容量瓶中,定容,测定其吸光度A,计算回收率。
2 结果与讨论
2.1 薏苡仁油、卵磷脂和胆固醇的紫外扫描和紫外扫描分析方法可行性
紫外扫描等分析方法测定各类脂质体包封率已有报道;仵文英、徐云龙等[8,10-11]利用空白脂质体和脂质体芯材的最大吸收波长不同,通过紫外分光光度法测定头孢他啶和茶树油脂质体包封率;晏亦林等[12]采用Sephadex G-50凝胶柱分离脂质体和游离磷酸川芎嗪,紫外分光光度法测定磷酸川芎嗪纳米脂质体包封率和渗漏率。紫外法测定薏苡仁油包封率的原理是通过测定薏苡仁油溶液对检测波长入射光的吸光度,由朗伯-比尔定律求得薏苡仁油的含量,对脂质体破壁前后薏苡仁油进行定量比较。
薏苡仁油、卵磷脂和胆固醇的扫描结果见图1。
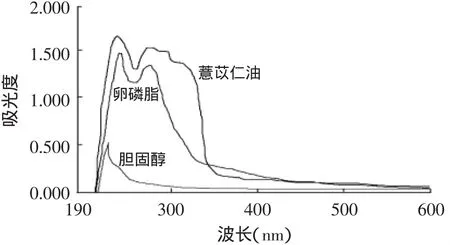
图1 光谱扫描曲线Fig.1 Ultraviolet scanning spectrum
由图1可知,在220~330nm波长范围内,薏苡仁油的吸收峰较大,而卵磷脂的吸光度在220~300nm范围内也较大,胆固醇在210nm附近也有一较小的吸收峰,脂材对薏苡仁油的紫外测定存在干扰。晏亦林等[12]发现脂材对磷酸川芎嗪的紫外测定存在干扰时,采用测定游离磷酸川芎嗪的量来间接计算脂质体的包封率。由于本研究采用透析法分离游离薏苡仁油,需不时更换透析液,不适宜测定游离薏苡仁油的含量,故直接测定包封薏苡仁油的量。要准确定量薏苡仁油的量,须从薏苡仁油脂质体破壁后的混合物中将磷脂和胆固醇完全除去,然后在235nm处测定吸光度。
2.2 破乳剂种类的选择
包封率的测定须用破乳剂破坏脂质体包囊双层膜,破乳效果完全才能使芯材完全从包囊的脂质体中转移到测定溶媒中,选择破乳剂种类在包封率测定中至关重要。
乙醇、甲醇和Triton X-100对薏苡仁油脂质体的破乳效果如表1所示。
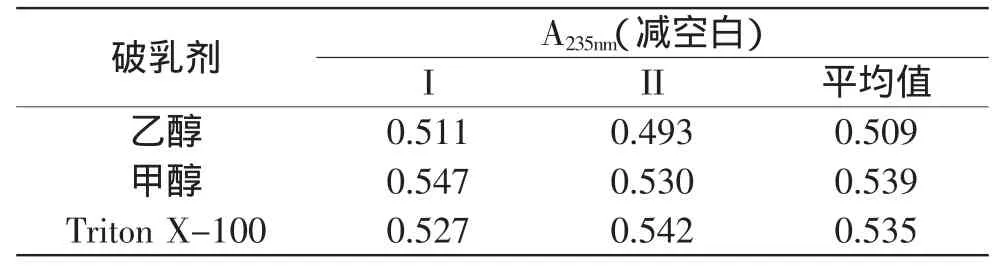
表1 不同种类破乳剂破乳后吸光度Table 1 Absorbance of coix seed oil with different demulsifies
破乳后从表观现象看,乙醇、甲醇、Triton X-100的加入都能将脂质体壁材卵磷脂溶解,乳液包埋形成的脂质体界面消失,破乳效果良好。从本质来说,破乳效果越好,包封薏苡仁油转移到测定溶媒中越多,吸光值越大。由表1可知,3种破乳剂破乳效果为:甲醇>Triton X-100>乙醇,由于加入的总薏苡仁油量相同,比较破乳后所得薏苡仁油量,可以看出3种破乳剂的破乳效果相差不是很大。考虑溶剂毒性与成本,实验宜选用乙醇为破乳剂。
2.3 超声破壁时间的考察
不同超声破壁时间的吸光度见表2。
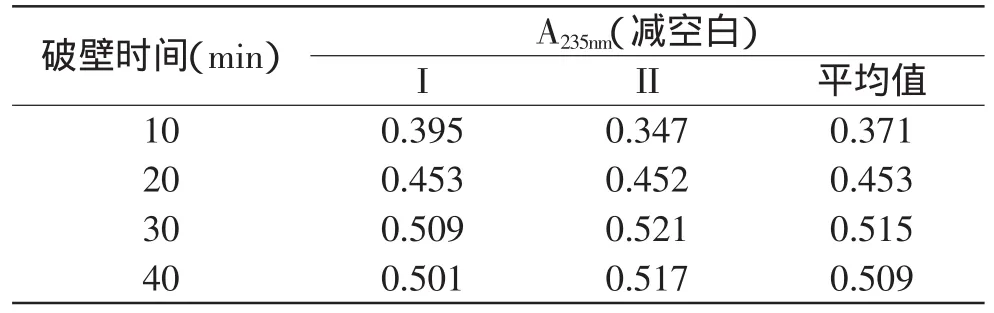
表2 不同超声破壁时间的吸光度Table 2 Absorbance of coix seed oil with different ultrasonic time
脂质体包封被破壁效果越好,乳化破坏程度也越高,因此吸光值越大。由表2可知,超声破壁时间对脂质体包封率的影响较大,当破壁时间超过30min时,能够完全将脂质体中的薏苡仁油释放到石油醚中;30min超声处理可以达到脂质体破壁最大化,达到分离薏苡仁油的最佳效果。
2.4 薏苡仁油、卵磷脂、胆固醇的溶解特性及薏苡仁油的分离
薏苡仁油、卵磷脂、胆固醇在石油醚、冷乙醇及热乙醇中的溶解性效果见表3。

表3 薏苡仁油、卵磷脂、胆固醇的溶解性Table 3 Solubility of coix seed oil,lecithin and cholesterol
由表3可知,薏苡仁油易溶于石油醚,微溶于热乙醇,不溶于冷乙醇;而卵磷脂和胆固醇都易溶于热乙醇;乙醇与水可以任意比例互溶,而石油醚不溶于水[13]。当破乳脂质体溶解在石油醚和冷乙醇水混合体系,静置后会分为两层,薏苡仁油溶解于上层石油醚体系,磷脂和胆固醇溶解于下层乙醇与水层。该方法可以将破乳脂质体的磷脂、胆固醇和薏苡仁油分开,达到高效分离薏苡仁油的目的。
2.5 包封率的测定
根据紫外扫描图谱选取235nm为检测波长,在该条件下测定不同浓度薏苡仁油标准溶液的吸光度,根据实验结果绘制标准曲线,结果如图2所示。薏苡仁油在0~13μg/mL范围内,吸光度与浓度成良好的线性关系,线性回归方程为:A=715.2C+0.0071,相关系数R2=0.9981。
透析时间对脂质体包封率的影响见图3。透析16h以前的脂质体中游离薏苡仁油不能完全除去,导致所测的包封率偏高;透析时间16h时,游离薏苡仁油几乎完全除去;故选取透析时间为16h。

图2 薏苡仁油石油醚标准曲线Fig.2 Standard curve of coix seed oil in petroleum ether
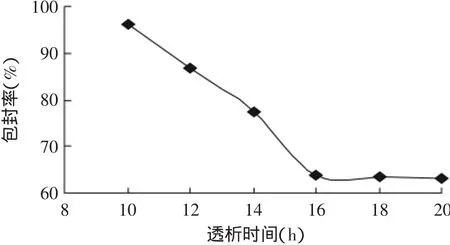
图3 透析时间对包封率的影响Fig.3 Effect of dialysis time on the entrapment efficiency
2.6 分离法精密度考察
精密度考察实验三次测得吸光度分别为:0.338、0.347、0.350,平均吸光度为0.345,RSD为1.81%,证明脂质体中包封薏苡仁油的破壁分离精密度较好,具有实际应用的可行性。
2.7 回收率实验
加样回收率结果如表5所示,平均回收率98.68%,RSD=1.98%,表明该法可行。

表4 加样回收率测定结果Table 4 Method recovery of coix seed oil
3 结论
采用透析法分离包封与未包封薏苡仁油,对薏苡仁油脂质体有良好的分离效果,脂质体与游离薏苡仁油分离完全,分离法精密度RSD=1.81%,加样回收率98.68%,RSD=1.98%。实验结果表明,建立的测定方法操作简单,结果准确,适用于薏苡仁油脂质体包封率的测定。
[1]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1993:329.
[2]江苏新医学院编.中药大辞典(下册)[M].上海:上海人民出版社,1997:2645.
[3]邓英杰,顾学裘.新型药物载体-脂质体的作用特点及应用[J].中国药学杂志,1990,25(4):195.
[4]陆彬.药物新剂型与新技术[M].第二版.北京:人民卫生出版社,2005:134-138.
[5]夏书芹,许时婴.吐温80增溶-紫外分光光度法测定辅酶Q10脂质体的载量及包封率[J].食品与发酵工业,2005,31(10):131-135.
[6]Malgorzata J R,Latowski D,Strzalka K.Incorporation of plastoquinone and ubiquinone into liposome membranes studied by HPLC analysis:The effect of side chain length and redox state of quinone[J].Chemistry and Physics of Lipids,2001,110(1):85-94.
[7]Xiangrong Song,Yu Zhao,Shixiang Hou,et al.Dual agents loaded PLGA nanoparticles:Systematic studyof particle size and drug entrapment efficiency[J].European Journal of Pharmaceutics and Biopharmaceutics,2008,69:445-453.
[8]仵文英,席枝侠,薛红安,等.紫外分光光度法测定黄芩苷脂质体的包封率和渗漏率[J].医药导报,2005,24(7):624-626.
[9]李亮,熊华,黄军,等.薏苡仁油脂质体制备工艺研究[J].粮食与油脂,2008,33(12):162-165.
[10]罗云敬,沈含熙,杜鸣,等.紫外分光光度法测定头孢他啶脂质体的包封率和泄漏率[J].中国抗生素杂志,1998,23(3):2032-2041.
[11]徐云龙,杨欣欣,徐盛.茶树油脂质体的制备及质量评价[J].华西药学杂志,2006,21(2):139-142.
[12]晏亦林,周莉玲,林绍瑜,等.磷酸川芎嗪纳米脂质体包封率的测定[J].药物导报,2008,27(7):824-825.
[13]程能林.溶剂手册[M].第二版.北京:化学工业出版社,1995:106-285.
——有效的抗弓形虫药物靶标

