根癌农杆菌介导甘蔗遗传转化Bt(cry1Ab)基因
李晓梅 王闵霞 秦廷豪 阳翠 安琪 张军
甘蔗(Saccharum officinarum L.)是重要的糖能经济作物,在世界各地广泛栽植,其产糖量约占世界糖产量的60%- 70%[1],在我国则占到90%以上[2]。甘蔗大田生产的整个生长发育期内均会受到多种虫害威胁,尤以鳞翅目害虫——蔗螟(主要有条螟、二点螟、大螟、白螟及黄螟等)危害最大,以幼虫蛀入甘蔗幼苗和蔗茎,导致甘蔗商品性、糖分等品质下降,并带来每年20%-25%的损失[3]。利用有性杂交技术培育抗虫甘蔗品种是提高甘蔗抗虫能力的重要途径[4]。但是,甘蔗是高度杂合的异源多倍体和多倍的非整倍体植物,遗传背景复杂,利用传统育种方法从有性杂交到良种育成要10-13年,周期长,成效低[5,6]。基因工程可以定向改变作物的某些性状,为植物育种开辟了新途径。
Arencibia等、Enriquez-Obreqon等和Elliott等[7-9]于1998年分别通过根癌农杆菌介导法成功地实现了甘蔗的遗传转化,开辟了甘蔗农杆菌介导法转基因研究的先河。农杆菌介导法简便、易于操作,克服了基因枪法及电击法等直接转化法转化效率低,转化体嵌合体多、转化外植体不易成活及拷贝数多的缺点,所以研究甘蔗根癌农杆菌介导遗传转化对甘蔗遗传工程改良有理论及实践意义。
Bt基因是从微生物苏云金杆菌分离出的一种杀虫结晶蛋白基因,是一种广谱性的抗虫基因,它指导合成的杀虫结晶蛋白(ICP)对许多鳞翅目、双翅目及鞘翅目的昆虫均有较强毒性。至1987年首次获得转Bt烟草植株以来,现已在许多植物的遗传转化中得以运用[10]。本研究旨在利用根癌农杆菌介导法将Bt(cry1Ab)基因导入自育甘蔗品种“川蔗23号”中,实现其抗虫性改良。
1 材料与方法
1.1 材料
1.1.1 植物材料 甘蔗材料为“川蔗23号”,由四川省植物工程研究院糖料作物研究所选育,于2011年11月至2012年2月取自研究院内试验场,每次取10个蔗鞘。
1.1.2 菌株与质粒 根癌农杆菌菌株EHA105由四川省农业科学院生物与核技术研究所提供,具有卡那霉素及利福平抗性。质粒为pCAMBIA1301-Cry1Ab,携带潮霉素磷酸转移酶基因(Hpt),以玉米的Ubi-1为启动子。
1.1.3 试剂 卡那霉素(Kan)、利福平(Rif)、羧苄青霉素(Car)、乙酰丁香酮(AS)和潮霉素(Hyg)均为Sigma公司产品,Taq DNA聚合酶、dNTP为上海生工产品,聚乙烯吡咯烷酮(PVP)及其它试剂为国产分析纯。
1.1.4 培养基 甘蔗植株再生及遗传转化各个阶段的最佳培养基,见表1。

表1 甘蔗再生体系建立及遗传转化培养基的组成
1.2 方法
1.2.1 胚性愈伤的诱导及再生体系的建立 以川蔗23号的幼嫩叶鞘为外植体,经常规灭菌后切成厚度为0.3cm左右的幼叶卷,接种于M1上,25℃黑暗培养,诱导胚性愈伤组织。胚性愈伤转入M2上,25℃,1500lx下分化培养,当分化苗约5cm时将其转入M3中生根培养,20d后进行炼苗假植,移栽至含有蛭石∶草炭=1∶1的盆钵内,成活后移栽入大田。
1.2.2 潮霉素抗性浓度的筛选试验 将胚性愈伤组织和丛芽分别转入添加不同浓度Hyg(0、10、20、30、40和50mg/L)的M1、M2、M3上,观察愈伤生长、丛芽分化及生根情况,确定甘蔗不同分化阶段最佳潮霉素筛选浓度。
1.2.3 农杆菌工程菌液的制备 从M4上挑取单菌落于新鲜的M4上划线培养,48-72h后刮取长0.5-1.0cm的菌体,悬浮于M5内,其OD600为0.1左右[11],再置于28℃,180r/min条件下振荡培养2h,以诱导农杆菌vir基因的活化表达,此菌液即为转化工程菌液。
1.2.4 胚性愈伤的预培养及预处理 胚性愈伤组织置于培养基M1上预培养4d,转化前于超净工作台吹风处理45min左右,让其微微干缩,以待用。
1.2.5 甘蔗的遗传转化 将预处理的胚性愈伤浸没于工程菌液中感染1.5min[11],转到滤纸上吸干多余菌液,然后接种到M6上,23℃黑暗共培养3-4d。用无菌水清洗至无浑浊后,用含有Car 500mg/L的无菌水浸泡2min,再用无菌水清洗3次,无菌滤纸吸干后,接种于M7上,25℃黑暗培养14d,转入M8中25℃,1500 lx光照强度下培养以诱导芽的形成,当抗性芽长至5cm左右时,转入M9中以筛选抗性完整植株。为筛选适宜于甘蔗遗传转化的愈伤年龄,分别用接种后20、30、40和50d的愈伤为受体,每个处理20个外植体,重复3次,经 20mg/L潮霉素抗性筛选20d后,以抗性愈伤百分率的高低评判胚性愈伤的优劣。
抗性愈伤率(%)=抗性愈伤组织块数/接入愈伤组织块数×100%
1.2.6 抗性植株的PCR检测 采用改良CTAB法提取植株叶片的总DNA,根据Bt(Cry1Ab)中间序列合成反应引物5' -TCATCCAGCGAATCTACC-3'和5'-AACAGTGCCCTTACAACC-3',目的片段大小为823bp(由上海生工合成)。分别以潮霉素抗性植株的DNA、对照甘蔗植株的DNA及质粒DNA为模板,用合成引物,在49℃退火温度下进行PCR扩增检测。
2 结果
2.1 甘蔗胚性愈伤的诱导及不定芽的再生
切取的幼叶卷在M1上培养大约3-5d 后开始膨大,并从叶卷中心开始凸起,愈伤组织最开始从叶卷内部及叶卷边缘开始形成(图1-A)。培养25d后外植体整个形成疏松、黄色、水分含量较多的愈伤组织,并在其上有零星团状白色、致密、颗粒状的愈伤形成,此类愈伤组织即为胚性愈伤组织。它们除了具有分生能力强、易于再生等特性外,还有与胚细胞相似的接受T-DNA的能力。为使侵染材料胚性一致,将诱导的少量胚性愈伤进行继代培养,2周后即可作为浸染材料(图1-B)。胚性愈伤组织分化能力极强,在转入分化培养基后7d左右就有绿色芽点形成,约2周后即长至2cm长,由于胚状体是由单细胞发育而来,因此胚性愈伤团发育形成芽丛,不定芽转入生根培养基后都能达到100%的生根率,并且在主芽周围还能分蘖形成许多侧芽(图1-C)。
在研究中发现甘蔗外植体极易褐化,在切取外植体的过程中其伤口随即变为褐色,在培养过程中约有15%的外植体不能产生愈伤组织而褐化、死亡,有些外植体在形成愈伤组织后也极易褐化。研究发现通过添加50mg/L聚乙烯吡咯烷酮(PVP)可有效减轻愈伤组织在培养过程中的褐化(图2),但对不能形成愈伤组织的外植体无效。

图1 甘蔗再生体系的建立
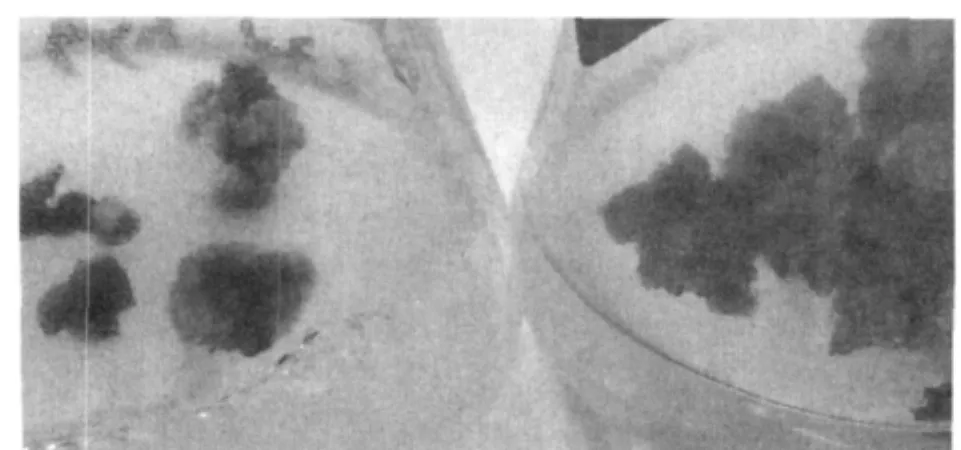
图2 添加50mg/LPVP对愈伤褐化的抑制作用
2.2 潮霉素浓度对胚性愈伤增殖、分化及丛芽生根的影响
潮霉素抗性浓度筛选预试验表明,随着潮霉素浓度的增加胚性愈伤增殖率、分化率及生根率都逐渐下降(表2)。当潮霉素浓达20mg/L时甘蔗胚性愈伤分化率仅为11%,并且分化的不定芽不能伸长,约10d后黄化死亡(图3-A)。由于未转化细胞的死亡会影响周围转化细胞的生长,为保证转化细胞的生长,在前期筛选阶段选择较低浓度的潮霉素(20mg/L)。甘蔗小芽对潮霉素的耐受性稍大于胚性愈伤,在10mg/L浓度下其生根率达到100%,只是再生的根与对照相比较少、较纤弱并且颜色为褐色(图3-B),在20mg/L浓度下其生根率为38.9%,形成的根较短色泽较深,上部芽部分黄化,约40d后植株整体死亡。在30mg/L时,其芽丛不能生根,并且20d后全部褐化死亡。为防止假阳性植株的逃逸,其生根筛选压以30mg/L为宜。

表2 潮霉素浓度对愈伤组织增殖、分化及不定芽生根的影响

图3 潮霉素对胚性愈伤再生及不定芽生根的筛选作用
2.3 甘蔗的遗传转化及抗性植株的获得
2.3.1 转化用适龄愈伤组织筛选 受体材料的生理状况及胚性的一致性是转化成功的关键。以外植体接种后20、30、40和50d的愈伤组织作为起始材料进行转化试验,经20mg/L潮霉素连续筛选20d后统计结果(表3)表明,当愈伤龄期在40d以前,抗性愈伤率随着龄期增加而增加,超过40d则显著降低,因此培养40d的愈伤组织为转化受体适龄愈伤组织。

表3 不同龄期愈伤组织经20mg/L潮霉素筛选后抗性愈伤率
2.3.2 抗性植株的获得 以培养40d胚性一致,大小为0.3-0.5cm的愈伤组织块为受体材料,用OD600值为0.1左右的工程菌液浸染1.5min,经抗性愈伤筛选后的胚性愈伤在分化筛选培养基上培养40d左右即可分化出小苗(图4-A)。本研究共进行了4批次的重复试验,侵染愈伤组织764块,最终获得98块抗性愈伤,转入M8后40d分化出31个抗性植株(系),将抗性株系分株转入M9中,共有65个单株生根,经PCR检测后有2株扩增到目的条带(图4-B),扩增到目的条带的两株植株相对于其他植株生长较弱,只有12个分蘖(图4-C),但阳性植株转入大田栽培后,其长势与分蘖能力与对照无差异(图4-D),阳性植株等待进一步的Dot-Southern检测及田间抗虫性验证。

图4 甘蔗的遗传转化与检测
3 讨论
外植体褐变是植物组织培养的三大技术难点之一,也是甘蔗组织培养的主要技术难点。在甘蔗中含有较多的酚类物质,这些物质极易氧化成褐色的醌类物质,醌类物质在酪氨酶等的作用下,使外植体细胞中的蛋白质聚合,生长停顿,最终导致死亡。在不同生长季节,甘蔗植株体内酚类化合物含量和多酚氧化酶的活性不相同。一般在夏、冬季节酚类物质含量和多酚氧化酶活性有所提高,此时外植体的褐化率较高[12]。本试验研究发现“川蔗23号”甘蔗幼叶卷外植体褐化率高达15%左右,这些外植体未膨大,仍保持接种时的状态即完全褐化,在形成愈伤后其愈伤褐化率逐渐降低,可能是因为取材时间在冬季的原因。聚乙烯吡咯烷酮(PVP)是酚类物质的专一性吸附剂,可用于防止褐变。本研究发现添加50mg/L PVP可有效降低培养中愈伤组织的褐化率,但对于未形成愈伤即褐变的外植体效果不明显。
潮霉素是根癌农杆菌介导植物遗传转化研究中应用较多的抗生素之一。本研究发现甘蔗在愈伤组织分化与再生苗生根阶段对潮霉素较敏感,其最佳筛选浓度分别为20mg/L、30mg/L,这与陈丽新等[13]的研究结果相似。
选用适宜的受体材料是转化成功的关键。本研究发现,培养25d后的外植体上形成的愈伤主要为非胚性愈伤,其上只有零星的胚性愈伤颗粒,40d龄期的愈伤组织胚性较一致且大小适宜,经潮霉素筛选后抗性愈伤率较高;当愈伤龄期超过40d后,愈伤组织容易褐化并产生黏性物质,并且有部分愈伤即使在黑暗培养条件下也会开始逐渐分化,不利受体的遗传转化。而罗敬萍等[14]研究表明培养25d的甘蔗愈伤组织胚性较好,为最适转化受体。这可能与甘蔗品种及取材时间有关,不同品种及取材时间其外植体活性不同,达到一致胚性状态的时间不同。
在根癌农杆菌介导植物遗传转化中工程菌液的浓度与侵染时间是影响转化率的重要因素。在预试验阶段采用王自章等、唐建平等[15,16]遗传转化甘蔗中使用的农杆菌菌液浓度与侵染时间进行“川蔗23号”的遗传转化,但均因在筛选培养阶段农杆菌的过度增殖导致胚性愈伤缺氧而褐化、死亡,未能获得抗性植株。日本研究者Nishimura等[11]在水稻农杆菌遗传转化中的研究发现较低的农杆菌侵染浓度与较短的侵染时间也可高效的遗传转化水稻。因此,在后续的试验中采用Nishimura等用于水稻遗传转化的方法进行甘蔗的遗传转化研究。结果发现,用较低的根癌农杆菌侵染浓度与较短的侵染时间处理后的甘蔗胚性愈伤在共培养3d后也会有可见的菌体出现,在脱菌中用含有500mg/L Car的无菌水中浸泡2min再转入筛选培养基中即可很好的抑制农杆菌的生长。
至1987年Chen等[17]首次开展甘蔗转基因以来,国内外许多学者成功应用基因枪法、电击法及根癌农杆菌介导法将多种外缘基因(如抗病性基因SCMV-CP、抗虫基因Bt、抗除草剂基因Bar、开花启动基因Leafy、抗旱基因Tsase等)转入甘蔗中[18,19]。但相对于水稻、小麦、玉米等单子叶植物来说,甘蔗转基因技术相对滞后,开展或利用有效的转基因方法,如利用双元或多元载体系统,建立高效表达的受体系统,构建适合甘蔗的特异启动子,加强农杆菌介导法的研究及功能基因的分离将是今后甘蔗转基因研究的重点。
4 结论
本研究以“川蔗23号”幼嫩叶鞘为外植体,以超毒菌株EHA105为转化的农杆菌菌株,Hpt基因为筛选标记,Ubi为启动子,以40d胚性愈伤为受体材料,首次在甘蔗上采用低浓度的农杆菌(OD600=0.1左右)和较短的侵染时间(1.5min),成功实现了甘蔗的遗传转化Bt(cry1Ab)基因。
[1] Agra-Europe.Cane taking larger share of world sugar output:sugarcane expected to bemain supply of world sugar production in 1994/5.
[2] 李奇伟.现代甘蔗改良技术[M].广州:华南理工大学出版社,2001.
[3] 陈庭俊.甘蔗螟虫的发生及其药剂防治[J].甘蔗, 1998, 5(1):22-25.
[4] 陈如凯.现代甘蔗育种的理论与实践[M].北京:中国农业出版社, 2003.
[5] 彭绍光.甘蔗育种学[M].北京:农业出版社, 1990.
[6] Inqelbrecht IL, Irvine JF, Mirkov TE.Posttranscriptional gene silencing in transgenic sugarcane:dissection ofhomologydependent virus resistance in amonocot thathas a complex polyploid genome[J].Plant Physiology, 1990, 199:1187-1197.
[7] Arencibia A, Carmona E, Tellez P, et al.An efficient protocol for sugarcane(Saccharum officinarum L.)transformstionmediated by Agrobacterium tumcfaciens[J].Transgenic Research, 1998, 7:213-222.
[8] Enriquez-Obregón GA, Vázquez-Padrón RI, Prieto-Samsonov DL,et al.Herbicide resistant sugarcane(Saccharum officinarum L.)plants by Agrobacterium-mediated transformation[J].Planta,1998, 206:20-27.
[9] Elliott AR, Campbell JA, Brettell RIS, et al.Agrobacterium-mediated transformation of sugarcane using GFP as a screenablemarker[J].Australian Journal of Plant Physiology, 1998, 6:739-743.
[10] 王关林, 方宏均.植物基因工程[M].第2版.北京:科学出版社, 2002.
[11] Nishimura A, Aich I, Matsuoka M.A protocol for Agrobacterium -mediated transformation in rice[J].Nature Protocols, 2006, 1(6):2796-2802.
[12] 戴友铭, 岑秀芬, 韦鹏霄, 等.甘蔗嫩叶鞘外植体褐变相关因子研究[J].广西农业科学, 2008, 39(2):127-131.
[13] 陈丽新, 李松, 谭芳, 等.甘蔗愈伤组织、组培幼苗对抗生素的敏感性试验[J].广西甘蔗, 2002, 27(2):3-6.
[14] 罗敬萍, 张树珍, 杨本鹏.农杆菌介导甘蔗基因转化技术的优化[J].热带作物学报, 2003, 24(4):23-28.
[15] 王自章, 张树珍, 罗敬萍, 等.甘蔗根癌农杆菌介导遗传转化研究[J].农业生物技术学报, 2002, 10(3):237-240.
[16] 唐建平, 蔡文伟, 王俊刚, 等.农杆菌介导蔗糖:蔗糖果糖基转移酶基因转化甘蔗[J].分子植物育种, 2009, 7(3):579-582.
[17] Chen WH, Gartland KMA, Davey MR.Transformation of sugarcane protoplasts by direct uptake of a selectable chimaeric gene[J].Plant Cell Report, 1987, 6:297-301.
[18] 许莉萍, 潘大仁, 陈如凯.基因工程甘蔗:潜能、现状和前景[J].生物工程学报, 2001, 17(4):371-374.
[19] 叶云, 秦新民.转基因技术在甘蔗育种上的应用[J].广西师范大学学报:自然科学版, 2002, 20(4):90-93.

