外源水杨酸对盐胁迫下菜豆种子萌发和幼苗生理特性的影响
张凤银,陈禅友,胡志辉,许丽彬
(1.江汉大学生命科学学院,武汉 430056;2.湖北省豆类(蔬菜)植物工程技术研究中心,武汉 430056)
土壤盐渍是影响植物生长、限制作物生产力的主要非生物逆境因素之一[1-4]。随着设施蔬菜业的发展,因设施内地温高、蒸发量大、无雨水淋溶的小气候及栽培作物时施肥量大等特点,易引起土壤次生盐渍[5],已成为制约蔬菜高产、优质、可持续发展的主要因素[6]。因此,长期以来,植物耐盐机理以及如何提高植物的耐盐性、增加盐胁迫下作物产量,一直是人们关注的焦点。目前研究发现,添加外源物质调控植物体抗氧化组分是解决非生物逆境胁迫对植物伤害行之有效的方法。水杨酸(Salicylic acid,SA)是植物体内广泛存在的一种简单的酚酸类物质,也是一种新的植物内源激素。据报道,在菊花[7]、棉花[8]、生菜[9]、黄瓜[10]、番茄[11]、花椰菜[12]等植物上添加外源SA能提高其抗盐性。
菜豆(Phaseolus vulgaris L.)又称芸豆(俗称二季豆或四季豆),属豆科菜豆属植物,在我国栽培广泛,属重要出口农产品。菜豆在种植过程中也经常受到盐胁迫,给生产带来不同程度的损失。但到目前为止,盐胁迫下菜豆生理特性研究及外源SA对盐胁迫下菜豆种子萌发及幼苗生长的影响少见报道。为明确SA对菜豆耐盐性影响的生理机制,本研究以菜豆种子为试验材料,在NaCl盐胁迫下,分析不同浓度外源SA对菜豆种子萌发、幼苗生长指标以及生理指标的影响,探讨SA对菜豆耐盐性的影响,旨在为实际生产中缓解菜豆盐害提供理论和技术依据。
1 材料与方法
1.1 材料
试验在武汉市江汉大学生命科学学院实验中心进行。以红花白荚的菜豆种子为试验材料(购于武汉市大东门蔬菜种子市场)。SA,化学纯,由上海国药集团生产。NaCl,分析纯,含量≥99.5%,由北京化学试剂公司生产。
1.2 方法
1.2.1 试验设计
试验共设8个处理:0 g·L-1NaCl+0 g·L-1SA(蒸馏水,记为CK1);7 g·L-1NaCl+0 g·L-1SA(记为CK2);7 g·L-1NaCl+0.25 g·L-1SA;7 g·L-1NaCl+0.5 g·L-1SA;7 g·L-1NaCl+1.0 g·L-1SA;7 g·L-1NaCl+1.5 g·L-1SA;7 g·L-1NaCl+2.0 g·L-1;7 g·L-1NaCl+2.5 g·L-1SA。
1.2.2 菜豆种子处理
菜豆种子经粒选后,用0.1%高锰酸钾溶液消毒10 min,蒸馏水漂洗3次,然后用蒸馏水浸种4 h。将浸种后的种子置入铺有双层滤纸的培养皿中,每皿100粒,沿培养皿的壁分别加入上述处理溶液,并保持滤纸湿润。处理后的种子在温度25℃、湿度85%恒温培养箱中培养。每天更换滤纸,并加入原处理溶液,保持滤纸湿润。每个处理重复3次。从培养次日开始统计发芽种子数(以胚根长为种子长度的一半作为发芽标准)。发芽试验进行7 d,测定并计算种子萌发相关指标(发芽率、发芽势及发芽指数)及幼苗的生长(芽长、主根长、侧根数)和生理指标(SOD活性、MDA含量)。
1.3 指标测定
1.3.1 种子萌发指标
种子萌发第4天测定发芽势,第7天测定发芽率和发芽指数。计算公式如下:
发芽势(%)=第4天发芽种子数/种子总数×100%;发芽率(%)=第7天发芽种子数/种子总数×100%;发芽指数=∑Gt/Dt,式中,Gt为在t日的发芽数,Dt为相应的发芽日数。
1.3.2 幼苗生理指标
超氧化物歧化酶活性采用氮蓝四唑(NBT)法测定[13];丙二醛含量采用硫代巴比妥酸(TBA)比色法测定[13]。以上指标均重复测定3次。
1.4 数据分析
数据采用Excel 2003进行整理,并用DPS 2000统计软件进行方差分析和多重比较,显著性检验采用邓肯氏新复极差方法。
2 结果与分析
2.1 外源SA对NaCl盐胁迫下菜豆种子萌发的影响
由表1可知,CK2发芽势、发芽率和发芽指数与CK1相比存在显著差异(P<0.05),前者发芽势、发芽率和发芽指数分别较后者降低19%、16%和7%。因此,盐胁迫延缓菜豆种子萌发速度、降低种子的萌发活力,抑制种子萌发。但在盐胁迫下添加外源SA,菜豆种子萌发相关指标随外源SA浓度的增加均呈先升高后下降的趋势。其中以添加0.5 g·L-1SA处理效果最佳,其发芽势、发芽率和发芽指数分别较CK2处理提高了21%、30%和11%。当SA浓度超过2.0 g·L-1则加重盐胁迫对种子萌发的抑制作用,SA浓度为2.5g·L-1时发芽率极低,仅为7%。

表1 不同浓度SA对NaCl盐胁迫下菜豆种子萌发的影响Table1 Effects of different concentrations of SA on seed germination of kidney bean under NaCl stress
2.2 外源SA对NaCl盐胁迫下菜豆幼苗生长的影响
由表2可知,CK1和CK2处理的菜豆幼苗侧根数差异不显著(P>0.05),但经过CK2处理的幼苗芽长、主根长显著短于CK1处理(P<0.05)。因此,盐胁迫抑制菜豆幼苗生长。在NaCl盐胁迫下,随添加外源SA浓度的增加,菜豆幼苗的芽长、主根长以及侧根数均呈先增加后下降的趋势。其中,0.5g·L-1SA缓解盐胁迫效果最佳,不仅其菜豆幼苗芽长、根长及侧根数显著高于CK2处理,而且芽长和侧根数也显著高于CK1处理。当SA浓度超过1.5 g·L-1时,SA浓度越高,对幼苗生长抑制越严重。
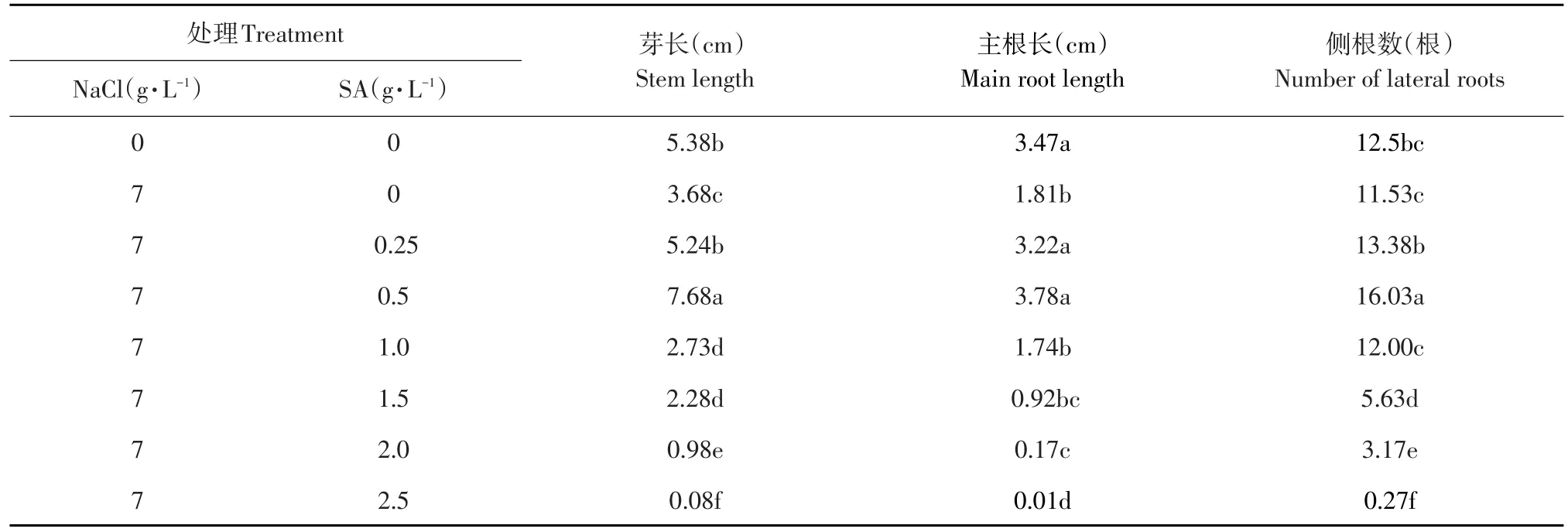
表2 不同浓度SA对NaCl盐胁迫下菜豆幼苗生长的影响Table2 Effects of different concentrations of SA on seedling growth of kidney bean under NaCl stress
2.3 不同浓度SA对NaCl盐胁迫下菜豆幼苗SOD酶活性的影响
SOD是植物细胞膜的重要保护酶,通过清除超氧阴离子自由基,保护细胞膜的完整性。SOD活性常作为植物抗逆性的重要生理指标之一。由表3可知,CK2处理幼苗SOD活性显著低于CK1处理(P<0.05),表明遭受盐胁迫后,菜豆幼苗体内SOD活性降低。在盐胁迫下,随添加外源SA浓度的增加,菜豆幼苗体内SOD活性呈先升高后降低的变化趋势。其中添加0.25~1.5 g·L-1SA均能显著提高SOD活性,且以0.5 g·L-1SA处理的菜豆幼苗SOD活性最高。因此,盐胁迫降低菜豆幼苗SOD活性,适宜浓度SA处理能提高菜豆幼苗SOD活性,保护细胞膜完整。
2.4 不同浓度SA对NaCl盐胁迫下菜豆幼苗MDA含量的影响
MDA是膜脂过氧化作用的最终产物,反映膜系统受伤害程度的重要标志之一。由表3可知,CK2处理幼苗中MDA含量显著高于CK1处理(P<0.05),说明经过盐胁迫后膜系统受到破坏。与CK2相比,通过添加0.25~0.5 g·L-1SA的处理能显著降低菜豆幼苗的MDA含量,缓解盐胁迫对膜的破坏,添加1.0~2.0 g·L-1SA对MDA含量无影响,而2.5 g·L-1SA反而显著提高MDA含量。
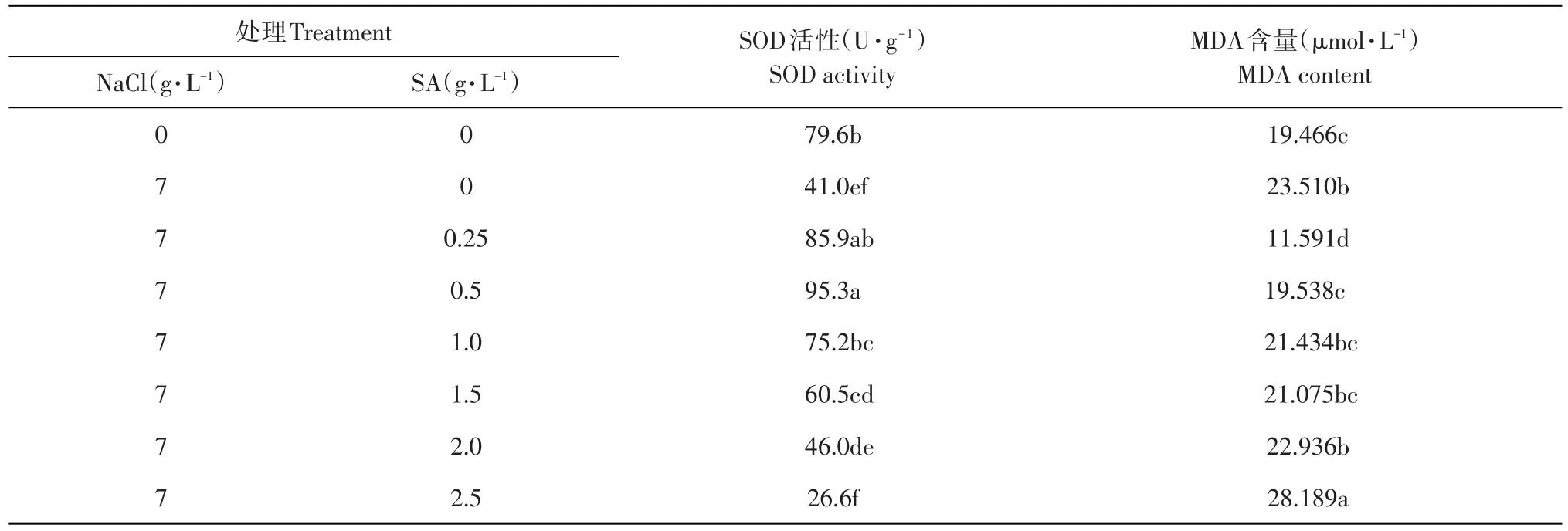
表3 不同浓度SA对NaCl盐胁迫下菜豆幼苗SOD活性及MDA含量的影响Table3 Effects of different concentrations of SA on SOD activity and MDA content of kidney bean seedlings under NaCl stress
3 讨论与结论
植物种子萌发和幼苗期是盐胁迫最敏感的阶段之一[14]。此阶段若受到盐胁迫,轻者会降低种子的发芽率,延迟出苗时间;重者则会导致种子不能发芽或幼苗死亡[15-18]。本试验结果表明,在NaCl处理下菜豆种子萌发延缓,发芽率降低,幼苗主根、侧根以及芽的生长均受到明显抑制。
盐胁迫引起种子萌发和植物生长抑制的原因主要为渗透胁迫引起植物细胞生理缺水,或细胞质膜遭破坏,导致溶质外渗,或离子毒害致细胞膜的选择透性遭破坏,使细胞的生理功能遭到破坏[19]。在本试验中,菜豆幼苗的细胞膜保护酶SOD活性降低,而反映细胞膜受伤害程度的MDA含量增加,说明菜豆受盐胁迫后,其细胞膜遭到破坏。SOD是一种诱导酶,Kumara等发现用100 mmol·L-1NaCl处理能显著提高非洲菊体内的SOD活性[20],王玉萍等报道用125 mmol·L-1NaCl处理也能显著提高花椰菜幼苗SOD活性[12],作者在预备试验中设置不同浓度NaCl处理菜豆,并没有发现提高SOD活性的处理,说明NaCl处理是否能提高SOD活性可能与植物种类有关或者与NaCl处理浓度有关,有待进一步研究。
本研究结果也表明,适宜浓度的SA能显著提高菜豆幼苗抗氧化酶的活性,有效清除活性氧,缓解盐胁迫导致的氧化伤害,从而提高菜豆种子的发芽力,促进幼苗生长。与报道[10,12]结果一致,SA对菜豆种子萌发和幼苗生长的影响与浓度有关,即低浓度时,缓解盐胁迫对种子萌发和幼苗生长的抑制作用,高浓度时,则加重盐胁迫对种子萌发和幼苗生长的抑制作用。在本研究中,0.25~0.5 g·L-1SA能缓解菜豆盐胁迫作用,超过1.0 g·L-1SA则加重盐胁迫作用。
菜豆在NaCl盐胁迫下,种子萌发和幼苗生长均受到抑制,添加SA能缓解盐胁迫,且以0.5 g·L-1SA为佳。
[1]刘剑光,肖松华,吴巧娟,等.盐胁迫对棉种萌发和幼苗生长的影响[J].江苏农业科学,2010(5):124-125.
[2]Silveira J G,Melo A R B,Viegas R A,et al.Salinity induced effects on nitrogen assimilation related to growth in cowpea plants[J].Environmental and Experimental Botany,2001,46:171-179.
[3]Khan M H,Panda S K.Alterations in root lipid peroxidation and antioxidative responses in two rice cultivars under NaCl-salinity stress[J].Acta Physiologiae Plantarum,2008,30:81-89.
[4]赵可夫.植物抗盐生理[M].北京:科学出版社,1993:11-20.
[5]史庆华,朱祝军,Al-aghabary K,等.渗盐胁迫对番茄抗氧化酶和ATP酶及焦磷酸酶活性的影响[J].植物生理与分子生物学学报,2004,30(3):311-316.
[6]张志刚,尚庆茂.水杨酸和壳聚糖对NaCl胁迫下黄瓜种子萌发的促进作用[J].中国蔬菜,2008(8):26-29.
[7]郭春晓,郑成淑,谢红英,等.盐胁迫下外源水杨酸对菊花根系离子含量和APTase及PPase活性的影响[J].园艺学报,2011,38(6):1167-1172.
[8]朱伟,袁超,马宗斌,等.水杨酸对盐胁迫下棉花种子萌发和幼苗生长的影响[J].江西农业大学学报,2009,21(10):17-19.
[9]何俊瑜,任艳芳.外源水杨酸对NaCl胁迫下生菜幼苗生长和光合性能的影响[J].湖南农业大学学报:自然科学版,2009,35(6):628-631.
[10]孙丽娜,曲敏,任广涛,等.水杨酸对盐胁迫下黄瓜种子萌发和幼苗生长的影响[J].东北农业大学学报,2006,34(4):449-453.
[11]宿越,李天来,杨凤军,等.外源水杨酸对NaCl胁迫下番茄幼苗保护酶活性和渗透调节物质含量的影响[J].沈阳农业大学学报,2009,40(3):273-276.
[12]王玉萍,董雯,张鑫,等.水杨酸对盐胁迫下花椰菜种子萌发及幼苗生理特性的影响[J].草业学报,2012,21(1):213-219.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14]王宝山,赵可夫,邹琦.作物耐盐机理研究进展及提高作物抗盐性的对策[J].植物学通报,1997,14(增):25-30.
[15]石元容.盐碱土改良[M].北京:农业出版社,1986:7.
[16]杨建伟,刘征,杜丽,等.盐胁迫对三樱椒种子萌发及幼苗生长的影响[J].江苏农业科学,2012,40(2):120-122.
[17]李存桢,刘小京,黄玮,等.不同盐分胁迫对中亚滨藜种子萌发及其恢复的影响[J].河北农业大学学报,2005,28(6):1-3,14.
[18]姚启伦,张维.NaCl胁迫对玉米自交系种子萌发和幼苗生长的影响[J].安徽农业科学,2010,38(5):2294-2296.
[19]刘洪兰,李景富,许向阳,等.NaCl胁迫对不同番茄种子萌芽的影响[J].东北农业大学学报,2008,39(5):28-33.
[20]Kumara G D K,Xia Y,Zhu J,et al.Effects of exogenous salicylic acid on antioxidative enzyme activities and physiological characteristics in gerbera(Gerbera jamesonii L.)grown under NaCl stress[J].浙江大学学报:农业与生命科学版,2010,36(6):591-601.

