鸭链球菌的分离鉴定及其16SrRNA基因序列分析
卢受昇,孔令辰,罗晶璐,张 翰,孙彦伟
(广东省动物卫生监督总所,广东 广州510230)
鸭链球菌病是由链球菌引起的鸭的急性或慢性传染病,雏鸭感染主要表现为急性死亡,一旦发病,可引起大量死亡。成年鸭和种鸭感染主要表现为跛行与瘫痪,死亡率一般较低,对生产性能产生较大的不良影响,造成经济损失[1]。2011年6月,某鸭场先后引进雏鸭两批,其中第1批4 000羽于7日龄发病,4d后,第2批4 000羽(3日龄)也开始发病,表现为拉稀,缩头,精神差,脚软,减食,其后出现死亡,立即使用氟苯尼考、硫酸新霉素等药物进行治疗,病情得到有效控制,全程两批鸭共死亡100多只。现将诊断情况介绍如下,供读者参考。
1 材料与方法
1.1 材料 病料:某肉鸭场10日龄病死雏鸭。
试验动物:1日龄健康雏鸭,饲养观察到5日龄。
主要仪器与试剂:营养琼脂、血液琼脂、麦康凯琼脂培养基为广州环凯微生物科技有限公司产品,在使用时自行配制;全自动微生物鉴定系统VITEK-32、GPI细菌生化鉴定卡、革兰染色液、接触酶试剂、氧化酶试剂均为法国梅里埃公司产品;药敏试纸为杭州天和微生物试剂有限公司产品;PCR预混试剂Premix Ex、载体pMD18-T、DH5α感受态细胞均为宝生物工程(大连)有限公司产品;DNA回收试剂盒 Wizard SV Gel and PCR Clean-Up System为Promega公司产品。
1.2 方法
1.2.1 剖检与细菌分离 常规方法对病死鸭进行剖检。无菌操作采集肝脏、心血,接种于营养琼脂、血液琼脂、麦康凯琼脂平板培养基,37℃培养24h。1.2.2 生化试验 将细菌的纯培养物,按试剂说明书进行氧化酶、触酶试验,再选用梅里埃细菌生化鉴定卡GPI在VITEK-32全自动微生物鉴定系统中进行鉴定。
1.2.3 药敏试验 纸片法,按试剂说明书进行。
1.2.4 动物试验 用灭菌生理盐水,将培养基中的菌落洗下(约2个麦氏比浊度),腿肌注射,接种5日龄雏鸭8只,每只0.5mL,对照组雏鸭8只,以同样的方式和剂量接种生理盐水。每天进行观察,对死亡鸭只进行剖检,并从肝脏和心血中分离细菌。
1.2.5 16SrRNA序列的测定 引物采用细菌16S rRNA 通用引物 F27:5′-AGAGTTTGATCMTGGCTCAG-3′,R1492:5′-TACGGYTACCTTGTTACGAC-TT-3′,扩增长度约为1 500bp,由上海生工生物工程技术服务有限公司合成。PCR扩增采用50μL体系,Premix EX 25μL、上下游引物各1μL、去离子水20μL、菌液3μL;反应程序为95℃30s,53℃30s,72℃90s,30个循环;72℃ 延伸8 min。产物电泳回收后,与载体pMD18-T连接,转化到DH5α中,经克隆鉴定后送上海生工生物工程技术服务有限公司进行测序。
2 结果
2.1 病理剖检 剖检病变主要为:全身充血、出血;肝脏肿大、充血出血;脾脏肿大,有灰白色坏死点;肾轻度出血,输尿管有白色尿酸盐沉积;跗关节稍肿大,关节液增多;脑膜下出血(见中插彩版图1)。
2.2 细菌培养及染色特性 从肝脏、心血中分离到一种菌落形态较一致的细菌。营养琼脂上菌落为灰白色细小菌落,生长很贫瘠;血液琼脂上菌落为圆形、边缘整齐、表面光滑、扁平隆起、淡白色的细小菌落,呈α溶血;麦康凯琼脂上不生长(见中插彩版图2)。取纯培养物进行革兰染色,结果为革兰阳性球菌,呈单个、成对、短链状或成堆排列(见图3)。

图3 革兰染色结果
2.3 生化鉴定结果 氧化酶试验为阴性,触酶试验为阳性。全自动微生物鉴定系统VITEK-32的GPI卡的鉴定结果为Streptococcus anginosus(Strep.milleri)(咽峡炎链球菌)或Streptococcus asnguinis(Streptococcus sanguis)/gordonii(血链球菌),鉴定值分别为77%和15%。具体生化特性见表1。

表1 GPI卡VITEK-32全自动微生物鉴定系统生化鉴定结果
2.4 药敏试验结果 纸片法药敏试验结果为先锋必、先锋Ⅴ、先锋噻肟、青霉素G、氨苄青霉素、氧呱嗪青霉素、苯唑青霉素、菌必治高度敏感;复达欣、头孢拉定、氧氟沙星、万古霉素、氯霉素敏感;环丙沙星、阿米卡星、氟哌酸、强力霉素低敏;红霉素、卡那霉素、利福平、呋喃妥因、痢特灵、链霉素、妥布霉素、庆大霉素、四环素、复方新诺明完全耐药。
2.5 动物试验结果 接种后表现为精神沉郁,拉稀,厌食,脚软,接种后第2天死亡3只,第4天死亡2只。随后,剩余的3只,精神、食欲逐渐转好,到接种后11d,基本痊愈。对照组鸭只正常。从每只病死鸭的肝脏和心血中,均分离到菌落形态一致的细菌,经鉴定,形态与生化特性与接种菌相同,成功的进行了人工发病试验,进一步证实了本病例的病原为该链球菌。
2.6 扩增结果 PCR扩增产物经琼脂糖凝胶电泳检测,可见1 500bp左右的特异条带(图4),与预期大小相符。
2.7 序列分析 测序结果已提交GenBank(收录号为JN594664),将所得菌株的16SrRNA基因序列在NCBI上用BLAST进行同源性比较,结果与Streptococcus pasteurianus(巴氏链球菌,序列号AP012054)相似性达100%。在最靠前25个序列中,有16个为巴氏链球菌,有6个为Streptococcus gallolyticus(解没食子酸链球菌),另3个为未能鉴

图4 PCR扩增结果
定的细菌,与该菌株的相似性在98%~100%。从GenBank数据库中选取不同种的链球菌参考株14株,沙门菌、鸭疫里默氏菌、大肠杆菌、铜绿假单胞菌、多杀性巴氏杆菌各1株(见表2),将其16S rRNA基因序列,用软件 MEGA 5.05进行多序列匹配排列,以Neighbor-Joining方式进行同源性比较,并绘制进化树。结果发现,各种链球菌16S rRNA基因序列间存在一定的差异,但差异不超过4%,本菌与巴氏链球菌参考株关系最近;其次为解没食子酸链球菌、牛链球菌,相似性均超过了99%;与咽峡炎链球菌相似性为98.46%;与变形链球菌的距离最远,差距达3.17%。本菌与大肠杆菌、沙门菌、铜绿假单胞菌、巴氏杆菌的同源性差异约为14%;与鸭疫里默氏菌的同源性则更远,超过16%(图5)。

表2 参考16SrRNA基因序列来源及数据库存取号
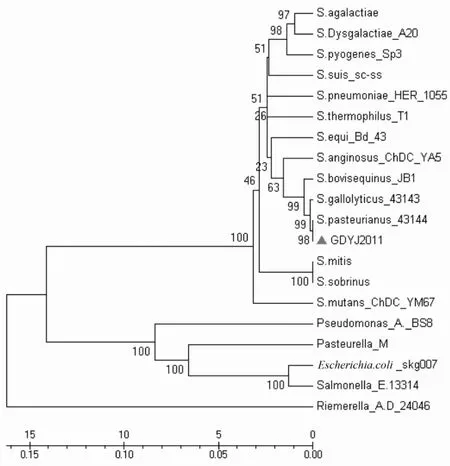
图5 16SrDNA序列分析结果
3 讨论
3.1 本分离株生化鉴定结果为咽峡炎链球菌,鉴定值较为77%,通过进一步测定其16SrRNA基因序列,其与巴氏链球菌最为接近,两种鉴定结果存在差异,但由于生化鉴定值较低,仅为77%,且其16S rRNA基因序列与咽峡炎链球菌的相似性为98.46%,低于“同一个种同源性为98.8%的标准”[2],故将本分离株定为巴氏链球菌。
3.2 将分离株接种健康雏鸭,成功复制出与原来相同的症状及病变,发病率达100%,致死率达62.5%,说明本病例由巴氏链球菌引起,且本巴氏链球菌分离株具有较强的毒力。鸭链球菌病多感染雏鸭,多呈急性败血性感染,鸟链球菌、兽疫链球菌、粪链球菌等感染雏鸭,兽疫链球菌感染成鸭的链球菌病已有报道[3],但由巴氏链球菌引起的未见报道,在当前养鸭业不断朝着集约化方向发展,养殖密度不断增大,水质日益恶化的条件下,该菌的致病作用增强,是否会成为危害养鸭业的一种新病需引起关注。
3.3 本病可通过用药进行治疗和预防。对该菌株的药敏试验结果显示,青霉素类药物高敏,氯霉素类药物敏感,本病例中及时应用氟苯尼考进行治疗,成功的地控制了病情,将死亡率降至2%以下,及时用药物进行治疗是减少损失的关键。
3.4 对于本病的预防,除了在发病敏感期前使用药物外,更重要的是采取降低饲养密度,优化水质,改善饲养条件,加强环境消毒等综合防控措施。
3.5 通过16SrRNA基因的序列测定,从分子遗传进化和分子水平对细菌进行鉴定,使细菌鉴定更加科学与准确[4]。当前,对链球菌属的各种细菌进行鉴定,存在一定的难度,但以16SrRNA基因序列相为基础,加上酶切分析及各种的特征性序列分析,能很好的将链球菌鉴定到种[5],16SrRNA序列测定可作为细菌鉴定的一种可靠方法。
[1] Y.M.Saif.禽病学(第十一版)[M].苏敬良,高福,索勋译.北京:中国农业出版社,2005:917-921.
[2] 韩文瑜,冯书章.现代分子病原细菌学[M].长春:吉林科学技术出版社,2003:160.
[3] 李峰,苗立中,沈志强,等.鸭链球菌病的诊断与防治[J].水禽世界,2009,2:39-40.
[4] Lee-Jene Teng,Po-Ren Hsueh,Yu-Hsuan Huang,etal.I-dentification of bacteroides thetaiotaomicron on the basis of an unexpected specific amplicon of universal 16Sribosomal DNA PCR[J].Journal of Clinical Microbiology,2004,42(4):1727-1730.
[5] Margot E,Grinwis Christopher D,Sibley Michael D,Parkins,etal.Characterization of streptococcus milleri group isolates from expectorated sputum of adult patients with cystic fibrosis[J].Journal of Clinical Microbiology,2010,48(2):395-401.

