对浓度限制条件R′的几点看法*
黑恩成 刘国杰
(华东理工大学化学系 上海 200237)
在我们的前文[1]中,已较详细地讨论了相律中的各种限制条件。可是,在现有的一些物理化学教材中,更关心的是浓度限制条件R′,并将R′表述为“在化学平衡中同一相中的浓度限制条件数”。言下之意,浓度限制条件全然是由化学平衡所致,且只限于同一相中才有。对于这样的表述,本文提出如下几点不同的看法。
(1) 浓度限制并非都是由化学平衡所致。
已知引起同一相浓度限制条件主要有两个原因:一是由化学反应的计量关系所致,例如NH4Cl固体的分解:

若容器中原先没有NH3(g)和HCl(g),则按上式的化学计量关系,在NH4Cl(s)部分分解产物中,NH3(g)与HCl(g)的物质的量必定相等,这便形成了一个浓度限制条件,即R′=1。显然,这个浓度限制条件是完全由化学平衡引起的。根据Gibbs相律,这个平衡系统的物种数S=3,相数Φ=2,独立的化学反应数R=1,故系统的自由度f为:
f=S-R-R′-Φ+2=3-1-1-2+2=1
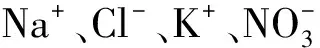
f=S-R-R′-Φ+1=5-0-2-1+1=3

和3个浓度限制条件,即:
相律计算结果是相同的。
(2) Gibbs相律是平衡态热力学中的一个普遍规律,它适用于各种相平衡系统,故不管是同一相还是异相中组分浓度间的相关,都应成为浓度限制条件。
所谓相平衡研究,实际上就是要指出,当系统达到热力学平衡时,各相强度性质的值,这与广延性质是无关的。如果不考虑外场(如电磁场、重力场和表面张力等)的影响,则强度性质便是系统中各相的T、p和xi,即各相的温度、压力和组分的浓度。对于由S个化学物种和Φ个相构成的系统,其强度性质当为:
实际上,Gibbs相律中的自由度f是要表明,在这些强度性质中,有几个可在一定范围内自由改变,而不引起系统新相形成和旧相消失。相律导出的主要依据为:
自由度f=系统的强度性质数-它们间的独立关系式数
这是鉴于系统达热力学平衡时,在上述强度性质间能够建立起很多独立的关系式,除了必须满足热平衡、力平衡、相平衡和化学平衡关系外,还有其他限制条件,诸如,同一相中组分浓度间的相关、强度性质T与p间的相关、T与xi间的相关、p与xi间的相关以及异相中组分浓度间的相关。这就是说,浓度限制条件不仅限于同一相中,而且也包括异相中组分浓度间的相关,这些关系的存在都会使系统的自由度减少。


现若定义独立组分数为:
则Gibbs相律可表示为:
(3) 为与上述NH4Cl(s)的部分分解反应相对比,教材中常以反应

为例,来说明即使系统中分解产物CaO(s)与CO2(g)物质的量相等,也没有浓度限制条件。此例很容易被认为是异相中组分浓度间的相关不能作为浓度限制条件的证明,其实这是误解。

C=S-R-R′=3-1-0=2
系统的自由度应为:
也就是说,CaCO3(s)部分分解反应本来就不存在异相中组分浓度间的相关。
综上所述,我们认为,R′应是热力学平衡系统中组分浓度的限制条件数。其中热力学平衡包括热平衡、力平衡、相平衡和化学平衡,而不只是化学平衡;而组分浓度的限制条件数则包括同一相和异相中的浓度限制条件数,而非只有同一相中组分浓度的限制条件数。
参 考 文 献
[1] 刘国杰,黑恩成.大学化学,2012,27(2):76
[2] 胡英.物理化学.第5版.北京:高等教育出版社,2007
[3] 王文亮.化学教育,1981(增刊1):60

