具有差向选择性还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯活性的微生物菌株筛选和鉴定
盛骏桢,王亚军,罗 希,郑裕国
(浙江工业大学 生物工程研究所 生物转化与生物净化教育部工程研究中心,杭州 310014)
他汀类药物作为一类高效的降血脂药物,能够竞争性抑制羟甲基戊二酰辅酶A(HMG-CoA)还原酶,限制胆固醇生物合成[1],是全球销量最高的降血脂药物[2]。作为合成阿托伐他汀药效基团的关键手性中间体,6-氰基-(3R,5R)-二羟基己酸叔丁酯的合成是生产阿托伐他汀的关键技术[3]。化学法合成6-氰基-(3R,5R)-二羟基己酸叔丁酯存在能耗大、溶剂消耗高和产物光学纯度低等缺陷,利用生物催化的高效率、高立体选择性和环境友好等特性,开发6-氰基-(3R,5R)-二羟基己酸叔丁酯手性生物合成技术具有重要的意义,也逐渐成为研究热点[4-5]。
羰基还原酶在生物催化反应中具有空间选择性的特点,因而为生物催化还原酮酯制备光学纯β-羟基酯提供了一条有效的途径[6]。然而,在立体化学方面大多数天然羰基还原酶催化的非对称还原大多遵守Prelog法则,具有反Prelog法则的羰基还原酶相对较少,反Prelog法则立体选择性酶的精确机理也尚未解析[7-8]。笔者所在课题组成功筛选得到具有非对映选择性还原 (R)-6-氰基-5-羟基 -3-羰基己酸叔丁酯活性的菌株 ZJB-09225,对其进行菌种鉴定,并研究其催化性能,以建立6-氰基-(3R,5R)-二羟基己酸叔丁酯的生物催化合成工艺(图1)。

图1 羰基还原酶不对称还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯制备6-氰基-(3R,5R)-二羟基己酸叔丁酯Fig.1 Enzymatic conversion of t-butyl 6-cyano-(5R)-hydroxy-3-oxohexanoate to t-butyl 6-cyano-(3R,5R)-dihydroxyhexanoate by ketoreductase.
1 材料与方法
1.1 实验材料
1.1.1 试剂
6-氰基-(3R,5R)-二羟基己酸叔丁酯标准品购自Toronto化学制品研究公司,(R)-6-氰基-5-羟基 -3-羰基己酸叔丁酯(质量分数约73.5%)由浙江新东港药业股份有限公司馈赠。麦芽浸粉和琼脂为市售生化材料。其他化学试剂均为市售色谱纯或分析纯试剂。
2,4-二硝基苯肼溶液:称取0.60 g 2,4-二硝基苯肼,溶解于15.0 mL浓H2SO4。充分溶解后,与90.0 mL 73.9%乙醇水溶液混合,加水定容至100.0 mL,即为6.0 g/L 2,4-二硝基苯肼溶液。
1.1.2 培养基组成
富集培养基:豆芽汁培养基(50.0 g葡萄糖,黄豆芽100.0 g煮沸30 min,过滤后加水补足至1.0 L,pH自然),灭菌后加入22.8 g(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯。
斜面与平板培养基:豆芽汁培养基(50.0 g葡萄糖,黄豆芽100.0 g煮沸30 min,过滤后加水补足至1.0 L,pH自然),琼脂质量浓度为20.0 g/L。
发酵培养基(1 L):麦芽浸粉30.0,葡萄糖20.0,(NH4)2HPO41.0,K2HPO4·3H202.28,NaCl 1.0,CuSO43.0 mg;pH 7.0。
1.2 实验方法
1.2.1 菌株筛选
土样采集自江浙一带的果园、食品厂及制药厂等地。称取 1.0 g土样,分散到 10.0 mL、0.85%生理盐水溶液中,充分混匀;移取1.0 mL菌悬液接种至29.0 mL含100 mmol/L(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯富集培养基;在28℃、150 r/min条件下,摇床振荡培养至培养液变浑浊;按照体积分数3.0%接种量转接到新鲜的无菌富集培养基中,继续在28℃、150 r/min条件下摇床振荡培养至培养液浑浊。连续富集3次后对富集培养物逐级稀释、涂布到固体平板上,30℃培养至形成明显的单菌落。将平板上形成的单菌落通过无菌牙签接种到无菌豆芽汁培养基中。30℃、150 r/min条件下培养2 d,收集发酵液。各取0.75 mL菌液与等体积30%(体积分数)甘油于EP管内混合,-20℃保藏。
移取20.0 mL发酵液,12000 r/min离心,收集菌体并用生理盐水洗涤2次。细胞分散于10.0 mL、pH 7.0磷酸缓冲液(50.0 mmol/L)中,加入0.10 g(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯,充分混合后置于30℃水浴摇床,反应24 h。转化液12000 r/min离心5 min,上清液采用0.45 μm微滤膜过滤,滤液采用2,4-二硝基苯肼法[9]、HPLC分析,计算各株菌的羰基还原酶活性。
1.2.2 菌体生理生化及分子鉴定
利用Vetik 2 Compact自动微生物鉴定系统,考察菌株对46种鉴定试验的鉴定结果。将菌株接种到酵母平板培养基,30℃恒温培养2 d,用无菌棉签拭转移形态相似菌落至无菌水中,利用浊度计调节菌悬液浊度至1.8~2.2麦氏单位。移取菌悬液至鉴定卡,培养18 h后置于 Vetik 2自动微生物鉴定系统分析。
分子鉴定首先提取ZJB-09225的基因组DNA。利用引物pITS1:5'-TCCGTAGGTGAACCTGCGG-3'和 pITS4:5'- TCCTCCGCTTATTGATATGC -3',在PCR仪PTC-200(Bio-Rad,USA)进行扩增,条件如下:95℃ 4 min;94℃ 50 s,55℃ 1 min,72℃ 1.5 min,35个循环;72℃ 10 min。扩增产物琼脂糖凝胶电泳检测,并用AxyPrep DNA凝胶回收试剂盒从琼脂糖凝胶中回收DNA。根据T/A克隆步骤(Takara,日本),将得到的目的基因与pMD18-T载体连接[10]。获得的重组质粒导入感受态E.coli JM109[11],然后接种在含有50 μg/mL氨苄青霉素的LB平板上培养,阳性克隆标记为E.coli JM109/pMD18-T-ZJB-09225。E.coli JM109/pMD18-T-ZJB-09225接种在含有50 μg/mL氨苄青霉素的LB培养基,37℃过夜培养,收集菌体,采用AxyPrep质粒DNA试剂盒提取质粒,测序,并与GenBank中的基因序列进行对比。18S rDNA全序列用 CLUSTAL W ver.1.81 A 软件包排序,使用MEGA version 2.1软件计算进化距离,利用Neighour-Joining法构建系统发育树。
1.2.3 转化条件
取1.0 g P.caribbic ZJB-09225细胞分散于10.0 mL含20.0 g/L葡萄糖酸钠的磷酸缓冲液(pH 7.0,50 mmol/L)中,加入(R)-6-氰基 -5-羟基-3-羰基己酸叔丁酯(终质量浓度14.0 g/L)。混匀后于30℃反应3 h。转化液12000 r/min离心10 min,上清液经0.45 μm微滤膜过滤。取澄清滤液测定生成的6-氰基-(3R,5R)-二羟基己酸叔丁酯浓度和残余(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯浓度。
1.2.4 高底物浓度下的转化条件
取10.0 g P.caribbic ZJB-09225细胞分散于100.0 mL含20.0 g/L葡萄糖酸钠的磷酸缓冲液(pH7.5,50 mmol/L)中,加入50 g/L(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯。混匀后于磁力搅拌锅内反应12 h,温度35℃,转速300 r/min。每小时取样 0.8 mL,加入 100.0 μL 1.0 mol/L HCl终止反应,然后再加入100 μL 1.0 mol/L NaOH溶液中和,12000 r/min离心10 min。上清液经0.45 μm微滤膜过滤,滤液采用HPLC检测生成的6-氰基-(3R,5R)-二羟基己酸叔丁酯浓度和残余的(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯浓度。
1.2.5 2,4 - 二硝基苯肼显色法
根据2,4-二硝基苯肼显色法工作原理[9],绘制(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯工作曲线。取 20.0 μL转化后的澄清滤液,与100.0 μL 2,4-二硝基苯肼溶液充分混合并静置1 h,加入5.0 mL 0.8 mol/L NaOH,混匀后静置 15 min。采用酶标仪测定样品在450 nm下的吸光值,计算出样品中残余(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯的浓度。
1.2.6 液相分析方法
6-氰基-(3R,5R)-二羟基己酸叔丁酯及其非对映异构体用LC-20AD型高效液相色谱仪(岛津)检测。色谱条件:液相色谱柱选择大连依利特Hypersil ODS2 C18 柱 (4.6 mm ×250 mm,2.5 μm),流动相为 V(乙腈)∶V(水)=1∶3,流速1.0 mL/min,柱温40 ℃。
产物6-氰基-(3R,5R)-二羟基己酸叔丁酯d.e.值按式(1)计算。

式中:A(3R,5R)表示产物6- 氰基 -(3R,5R)- 二羟基己酸叔丁酯的峰面积,A(3S,5R)为6-氰基-(3S,5R)-二羟基己酸叔丁酯的峰面积。
得率Y按式(2)计算。
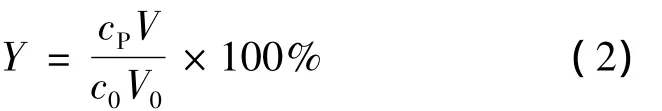
式中:c0表示(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯的起始浓度,mol/L;V0为起始时反应体系体积,L;cP为反应生成 产物6-氰基-(3R,5R)-二羟基己酸叔丁酯的浓度,mol/L;V为反应后反应体系体积,L。
2 结果与讨论
2.1 筛选结果
采用显色法进行R-羰基还原酶菌株筛选,结果如图2所示。由图2可知:筛选获得的多株菌株中,菌株ZJB-09225作用于(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯的羰基还原酶活力最好,24 h转化后残余(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯较少。通过HPLC分析检测,ZJB-09225菌株还原生成的6-氰基-(3R,5R)-二羟基己酸叔丁酯的量最高且立体选择性较好,产物构型符合反Prelog法则。
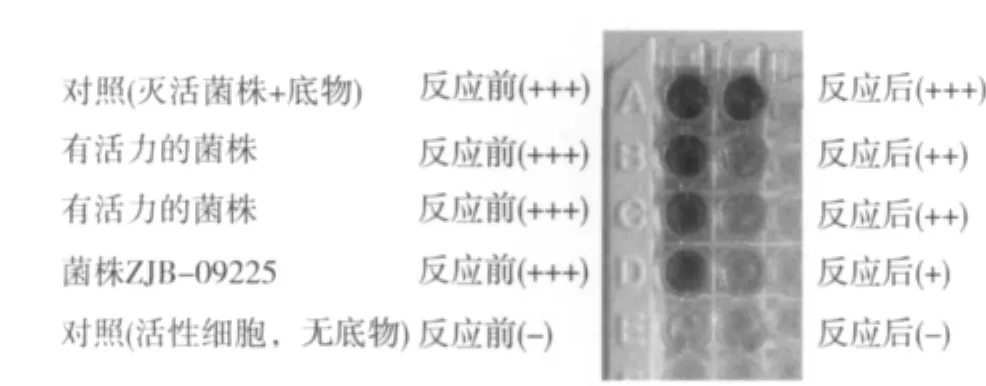
图2 显色法筛选非对映选择性还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯活性菌株示意Fig.2 Screening strains with diastereoselective ketoreductase activity towards t-butyl 6-cyano-(5R)-hydroxyl-3-oxohexanoate using colorimetric reaction
2.2 菌种鉴定结果
菌株ZJB-09225细胞呈卵圆状,细胞大小1.5 μm×2.5 μm。在豆芽汁平板上培养2 d,形成圆形、乳白色、不透明、中间凸起、表面光滑的菌落,直径约3 mm(图3)。

图3 菌落ZJB-09225在豆芽汁平板上的菌落形态Fig.3 Morphological characteristics of strain ZJB-09225
ZJB-09225生理生化鉴定结果示于表1。菌株ZJB-09225对其中的33种鉴定指标显示阳性反应,对其他13种鉴定指标显示阴性反应(表1)。基于Vetik 2 Compact自动鉴定系统分析结果,菌株ZJB-09225与Pichia caribbic A标准菌株相似,相似性指数为0.980。

表1 利用Vitek 2 Compact微生物自动鉴定系统分析菌种ZJB-09225碳/氮源利用结果Table 1 Utilization of carbon and nitrogen sources by strain ZJB-09225 detected with Vitek 2 Compact system
提取菌株ZJB-09225的18S rDNA测序。从GenBank中挑选与ZJB-0922518S rDNA序列相似的序列,采用MegAlign软件(DNAStar公司,美国)绘制进化树(图4)。将获得的序列与GenBank中保存的数据进行相似性分析发现,菌株ZJB-09225与Pichia caribbic(FN.428931.1)同源性最高 (100%,607 bps,18S rDNA)。因此,本实验鉴定的微生物属于Pichia属的caribbic种。结合生理生化与18S rDNA分子鉴定,菌株ZJB-09225被鉴定属于Pichia caribbic,已递交CCTCC保藏,保藏号CCTCC M 2012411。

图4 菌株ZJB-09225系统进化发育树Fig.4 Phylogenetic dendrogram for strain ZJB-09225 and related strains based on 18S rDNA sequence
2.3 发酵时间对P.caribbic ZJB-09225细胞羰基还原酶活性的影响
将P.caribbic ZJB-09225接种于发酵培养基,每隔4 h取样分析发酵液羰基还原酶活性,结果见图5。由图5可知:培养时间显著影响 P.caribbic ZJB-09225羰基还原酶体积酶活和生物量,培养32 h后,P.caribbic ZJB-09225发酵液体积酶活达到峰值,约7.2 U/L,生物量为8.8 g/L。
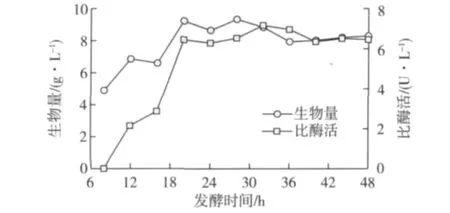
图5 P.caribbic ZJB-09225发酵进程曲线Fig.5 Profiles of biomass density,volumetric activity during P.caribbic ZJB-09225 culture
2.4 温度和pH对P.caribbic ZJB-09225细胞羰基还原酶活性的影响
温度、pH对P.caribbic ZJB-09225细胞羰基还原酶活性的影响见图6。由图6(a)可知,在转化pH7.0、转化温度 28 ~37 ℃范围内,P.caribbic ZJB-09225细胞表现出较好的差向选择性,产物d.e.值在95%左右;35℃时P.caribbic ZJB-09225细胞羰基还原酶活力达到最高,温度超过37℃时,细胞活性急剧下降。由图6(b)可知:在35℃、pH 6.0~8.0范围内,P.caribbic ZJB-09225细胞羰基还原酶具有较高的活性和立体选择性,在pH 7.5磷酸缓冲液中P.caribbic ZJB-09225细胞羰基还原酶活力最高 (图6(b))。因此,P.caribbic ZJB-09225细胞的最适作用温度为35℃,最适作用pH为7.5。

图6 转化温度和pH对P.caribbic ZJB-09225细胞羰基还原酶活性的影响Fig.6 Temperature and pH dependence of P.caribbic ZJB-09225 ketoreductase
2.5 P.caribbic ZJB-09225立体选择性还原高浓度6-氰基-(3R,5R)-二羟基己酸叔丁酯
P.caribbic ZJB-09225立体选择性还原 50.0 g/L(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯的进程曲线见图7。由图7可知:转化3 h,产物6-氰基 -(3R,5R)-二羟基己酸叔丁酯得率为3.4%,产物d.e.值99.5%以上,几乎检测不到反式6-氰基-(3,5)-二羟基己酸叔丁酯形成。转化12 h后,产物6-氰基-(3R,5R)-二羟基己酸叔丁酯得率达19.4%,产物d.e.值94.3%,提高(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯转化率导致6-氰基-(3R,5R)-二羟基己酸叔丁酯d.e.值降低。
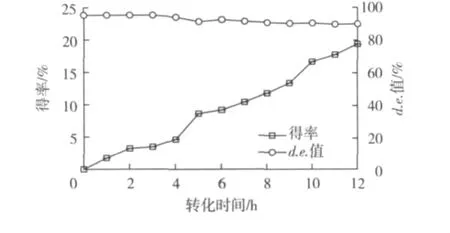
图7 P.caribbic ZJB-09225还原生成6-氰基-(3R,5R)-二羟基己酸叔丁酯的反应进程曲线Fig.7 Time course of 6-cyano-(3R,5R)-dihydroxylhexanoate formation catalyzed by P.caribbic ZJB-09225
3 结论
从土壤中筛选得到具有不对称还原6-氰基-(3R,5R)-二羟基己酸叔丁酯的羰基还原酶菌株ZJB-09225。经过生理生化和分子遗传学鉴定,确定该菌株属于Pichia caribbic。P.caribbic ZJB-09225发酵32 h后羰基还原酶活性达到最高值,体积酶活约7.2 U/L,P.caribbic ZJB -09225 生物量密度 8.8 g/L。P.caribbic ZJB-09225对(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯的最佳作用条件为35℃、pH 7.5;在转化率3.4%以内,产物d.e.值99.5%以上。利用P.caribbic ZJB-09225细胞成功建立了光学纯6-氰基-(3R,5R)-二羟基己酸叔丁酯的生物催化合成工艺,丰富了他汀药物关键手性侧链的合成技术。首次报道了P.caribbic不对称还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯制备6-氰基-(3R,5R)-二羟基己酸叔丁酯,后续P.caribbic ZJB-09225羰基还原酶纯化、基因克隆具有重要的研究价值。
[1]Endo A.Competitive inhibition of 3-hydroxy-3-methylglutaryl coenzyme areductasebyML-236A and ML-236B fungal metabolites,having hypocholesterolemic activity[J].FEBS Lett,1976,72(2):323-326.
[2]Casar Z.Historic overview and recent advances in the synthesis of super-statins[J].Curr Org Chem,2010,14(8):816-845.
[3]Wolberg M,Villela M,Bode S,et al.Chemoenzymatic synthesis of the chiralside-chain ofstatins:application ofan alcohol dehydrogenase catalysed ketone reduction on a large scale[J].Bioproc Biosyst Eng,2008,31(3):183-191.
[4]Ramesh N P.Biocatalytic synsthesis of intermediates for the synthesis of chiral drug substances[J].Curr Opin Biotechnol,2001,12(6):587-604.
[5]Pfruender H,AmidjojoM,HangF,etal.Production of Lactobacillus kefir cells for asymmetric synthesis of a 3,5-dihydroxycarboxylate[J].Appl Microbiol Biot,2005,67(5):619-622.
[6]Goldberg S,Guo Z W,Chen S,et al.Synthesis of ethyl-(3R,5S)-dihydroxy-6-benzyloxyhexanoates via diastereo-and enantioselective microbial reduction:cloning and expression of ketoreductase III from Acinetobacter sp SC 13874[J].Enzyme Microb Tech,2008,43(7):544-549.
[7]Nie Y,Xiao R,Xu Y,et al.Novel anti-Prelog stereospecific carbonyl reductases from Candida parapsilosis for asymmetric reduction of prochiral ketones[J].Org Biomol Chem,2011,9(11):4070-4078.
[8]Ltoh N,MizuguclliN.Production ofchiralalcoholby enantioselectiive reduction with NADH-dependent phenylacetaldehyde reductase[J].J Mol Catal B:Enzymatic,1999,6(2):41-50.
[9]Xue Y P,Wang Y J,Liu Z Q.Isolation of enantioselective αhydroxyacid dehydrogenase based on a high-throughput screening method[J].Bioproc Biosyst Eng,2012,35(9):1515-22.
[10]LiuZ Q,Sun Z H, Leng Y.Directed evolution and characterization of a novel d-pantonohydrolase from Fusarium moniliforme[J].J Agric Food Chem,2006,54(16):5823-5830.
[11]Chung C T,Niemela S L,Miller R H.One-step preparation of competent Escherichia coli:transformation and storage of bacterial cells in the same solution[J].Proc Natl Acad Sci USA,1989,86(7):2172-2175.

