关节腔内注射高乌甲素对兔膝骨性关节炎的影响
于 娟,李莎莎,叶莹仪,葛鸿庆,陈文治,邓晓强,余宇峰
(广东省中医院,广州 510120)
骨关节炎是一种慢性退行性关节疾病,从关节软骨退化开始,继而发生骨质和滑膜改变的关节疾病,在其防治方面尚无针对性的特效药物。目前据流行病学统计,我国成年人中膝骨关节炎的患病率为2.2%~9.6% ,而60岁以上老年人中,此病的患病率则高达49%[1]。近年来,炎症细胞因子与骨关节炎的关系日益受到重视,有研究表明 IL-1、MMP-2是参与骨关节炎进程的重要介质[2]。高乌甲素别名拉巴乌头碱或刺乌头碱,是一种非成瘾性镇痛药,具有局部麻醉、降温、解热和抗炎消肿作用[3],高乌甲素在临床应用中对膝骨性关节炎的疗效已经被证实[4,5],其治疗机制尚不明确。本实验通过观察高乌甲素对兔膝0A模型软骨细胞形态结构及血清和关节液中炎症细胞因子的改变,探讨关节软骨结构的改变和炎症细胞因子的表达与关节炎发病可能的相关规律以及高乌甲素对关节炎的治疗作用及可能的机制。
1 材料和方法
1.1 实验动物
普通级新西兰兔42只,雄性,体重(2.0~2.5)kg,质 量 合 格 证 号 0039854、0115216、0113398、0115213 0114105、0114265、4407207637,由广东省医学实验动物中心[生产许可证号:SCXK(粤)2008-0002],花都花东信华实验动物养殖场[生产许可证号:SCXK(粤)2009-0023]提供。动物实验环境设施为广东省中医院动物实验中心[使用许可证号:SYXK(粤)2008-0094]。
1.2 试剂
注射用氢溴酸高乌甲素冻干粉剂:4 mg/瓶,购于山东罗欣药业股份有限公司。兔IL-1β、兔MMP-2、酶联免疫分析试剂盒均购置于武汉华美生物制品有限公司(批号J12011870、D19011871)。
1.3 动物模型的建立及分组
新西兰兔采用Hulth法构建膝骨关节炎模型[6]。术前禁食 6 h,3% 戊巴比妥钠 i.p.(0.9 mL/kg)麻醉,选取右侧后肢内侧,先与髌韧带平行,纵行向下,至关节间隙下约0.5 cm处弧形向后,再与关节间隙平行,延伸至关节间隙后部,沿关节囊纤维走向切开关节囊,向外侧推离髌骨造成脱位。依次进入兔膝关节,屈曲膝关节,直视下可见膝交叉韧带,用眼科剪剪断前后交叉韧带并切除内侧半月板,避免损伤关节面软骨。行前后抽屉实验证实交叉韧带完全切断,生理盐水清洁关节腔积血、积屑、逐层缝合伤口,无菌包扎固定。术后所有动物每天驱赶上午、下午各强制运动30 min。术后4周随机抽取6只兔膝关节显微镜下观察,确定造模成功后,分为补肾活血法高乌甲素组、模型组,每组再按给药4、6、8周后3个时间点分配,每个点6只。
1.4 给药方法
高乌甲素4 mg用注射用水2 mL稀释,高乌甲素高乌甲素组造模后4周开始给药,关节腔内注射0.5 mL/次/只/周,共4周,模型组予同样剂量的生理盐水。
1.5 观察指标及方法
1.5.1 HE染色 取股骨内侧髁约(0.5×0.5×0.2)cm组织块标本,4%甲醛溶液固定,脱钙,石蜡包埋,4 μm连续切片。苏木素伊红染色,树胶封片,光镜下观察[7]。HE染色按 Mankin's评分标准进行。
1.5.2 Elisa法检测 于药物治疗4周、6周、8周后处死动物,通过兔耳缘静脉取血,分离血清、-20℃冻存;膝关节进行关节液的采集,取样部位消毒,切开右膝关节囊,用0.5 mL生理盐水冲洗关节腔收集关节液,离心收集上清液 -20℃保存,待测[8]。待所有标本收集完成后,用酶联免疫吸附测定法(ELISA)检测 IL-β、MMP-2的含量,步骤按说明书进行。
1.6 统计分析
2 结果
2.1 石蜡切片、HE染色结果
如图1(见封三)所示,同时期模型组软骨细胞数目多于高乌甲素组。模型组给予生理盐水4周后软骨细胞排列接近正常,软骨面较平整,6周后,HE染色不均匀,特别是表层染色减退,但潮线完整,8周后软骨表面出现裂隙,软骨细胞数量增多,结构不均匀。软骨细胞簇集,软骨破坏较重的关节面可见表层软骨变薄,有较多的血管增生。高乌甲素组给药4周后软骨细胞排列与模型组无明显差异,6周后,HE染色均匀,潮线完整,8周后软骨面糜烂明显减轻,软骨表面无明显裂隙,结构完整,软骨细胞数量增多,无明显簇集,软骨细胞血管增生明显。
2.2 Mankin's评分结果
如图2所示,治疗4周后模型组与高乌甲素组评分无明显差异,6周后,高乌甲素组较模型组比较,有显著性差异(P<0.01),至8周后,差异更明显(P<0.001),提示高乌甲素对于骨性关节炎的修复,可能通过促进细胞的自我修复来实现的。
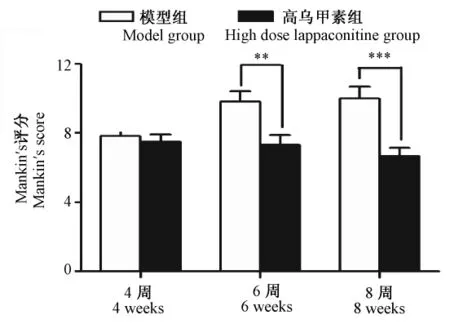
图2软骨组织切片Mankin's评分结果(,n=6)Fig.2 Mankin's score of the cartilage histology
2.3 IL-1β、MMP-2浓度检测结果
2.3.1 血清IL-1β浓度:如图3所示,结果表明,组内前后比较,在治疗4周后,IL-1β表达明显增加,提示手术后炎症反应强烈,随着时间的延长,模型组IL-1β逐渐降低,提示炎症逐渐减弱,由急性炎症反应转变为慢性炎症反应。给予高乌甲素治疗,无显著性差异。组间同期比较,差异均无显著性。提示高乌甲素对血清IL-1β影响较弱。综上分析,高乌甲素抑制 IL-1β的表达对全身炎症反应影响不大。
2.3.2 关节液MMP-2浓度:如图4所示,模型组在治疗四周后即升高,随着时间的延长,关节液MMP-2呈逐渐降低的趋势。组内前后比较,在给药4周后,高乌甲素即能显著降低MMP-2的表达(P<0.05),随着时间的延长,至6后,高乌甲素组MMP-2降低更加明显(P<0.01)。综上分析,高乌甲素能够在兔关节滑膜内显著抑制MMP-2的表达,提示高乌甲素治疗的有效性。
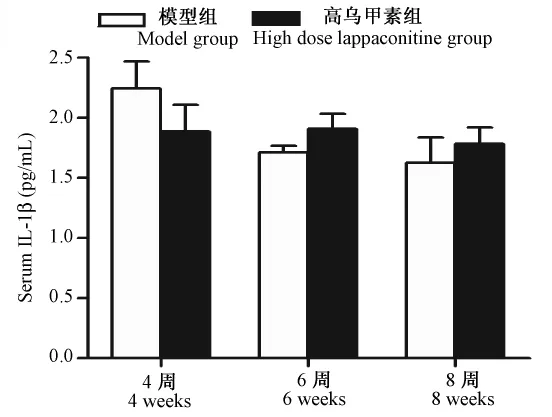
图3血清IL-1β浓度(pg/mL,ˉ±s,n=6)Fig.3 The concentration of serum IL-1β(pg/mL,ˉ±s,n=6)

图4关节液MMP-2浓度(ng/mL,,n=6)Compared with the model group,**P <0.01.Fig.4 The concentration of MMP-2(ng/mL in the joint fluid,,n=6)
3 讨论
膝骨性关节炎是影响人类健康最常见的关节疾患之一,其发病机制尚不十分清楚,但炎症细胞因子的参与已经获得认同。IL-1β是一种激素样多肽,在改变软骨细胞正常结构和功能,促进软骨细胞凋亡发生,降解软骨细胞基质等方面均发挥作用[9]。MMPs家族能够降解关节组织细胞外基质的所有成分,研究证实各种炎症性因子可增加基质金属蛋白酶的活性,从而造成关节软骨的损伤[10]。因此IL-1、MMPs的协同效应在膝骨性关节炎的发病机制中起着非常重要的作用。有研究表明,使用Hulth手术造模法建立的膝骨性关节炎模型在术后4周与人类的早期膝关节炎,特别是创伤后(如半月板损伤、交叉韧带损伤等)的膝骨性关节炎在病理、形态学等方面极为相似[11,12]。
本实验中,采用Hulth法复制关节炎模型,以探讨高乌甲素在治疗膝骨性关节炎方面可能的机制。结果显示,在高乌甲素的早期治疗下,病变组织得到修复,在关节炎发病的早期,高乌甲素作用于血清中MMP-2,给药4周后MMP-2浓度明显降低,6周后更低,说明药物作用时间有所延长并且有持续性增强作用,说明高乌甲素可以通过长时间调控MMP-2浓度以降低软骨基质的降解,从而减缓炎症的行程,尽管高乌甲素对IL-1β的调节在统计学上差异没有显著性,但从结果可以看出,给药4周后高乌甲素组的浓度是低于模型组的,而停止给药后出现反弹,但与模型组比较差异不显著,这也更进一步说明高乌甲素对IL-1β的调控作用时间具有即时性。在给药6周后,高乌甲素对关节液MMP-2的表达的显著降低作用提示高乌甲素的局部治疗作用。但在关节炎晚期,高乌甲素的治疗作用不显著,综上所述,高乌甲素治疗关节炎需在早期才能达到好的疗效。本实验结果中高乌甲素虽然不能在关节炎发病的任何时期对IL-1β、MMP-2的表达有显著作用,却也证实了关节炎的发病机制与这二种因子的异常表达有关,这与前人研究结论相一致。结合病理切片和炎症细胞因子浓度检测结果推断,关节软骨的自我修复也起到重要作用,提示高乌甲素早期治疗可能是通过调控炎症细胞因子的表达,促进关节软骨的自我修复能力而达到治疗作用的。此外,由于Hulth造模法复制的模型易造成关节通路手术创伤及炎症且病变限制于内侧室[13],提示高乌甲素直接作用于病灶的治疗方法的有效性。为高乌甲素临床治疗膝骨性关节炎提供了理论依据。
[1] 张乃峥,施金胜,张雪哲,等.膝骨关节炎的流行病学调查[J].中华内科杂志,1995,34(2):84.
[2] 宋震坤,陈文照.环氧化酶-2与关节炎[J].中国骨伤,2003,16(5):315.
[3] Easter A.Management of patients with multiple rib fractures[J].Am J Critical Care,2001,10(5):320.
[4] 邬强邹越彬.中药合氢溴酸高乌甲素片治疗膝骨关节炎52例[J].陕西中医,2006,5(9):522.
[5] 邓芳.高乌甲素关节腔阻滞治疗膝关节骨性关节炎的疗效观察[J].浙江临床医学,2003,5(12):928.
[6] 胡阿威,张磊,张功礼,等.改良Hulth法骨关节炎动物模型的建立[J].中华医学丛刊,2003,3(9):5.
[7] 周军,刘晓海,宋亚玲,等.抗骨增生胶囊对大鼠骨性关节炎的实验研究 [J].中国实验方剂学杂志,2012,18(19):145.
[8] 王桂芳,石宇,张金超.蚁龙通痹汤改善兔膝骨关节炎软骨组织骨生物力学的炎症机制[J].中国实验方剂学杂志,2012,18(15):218.
[9] Mathieu P.Interleukin l:Its role,its dosage,the difficulties in advances in arthritis.Results of a“Pilot”study with diacerheine(AR50)in gonarthrosis[J].Rev Prat,1999,Suppl 13:S15 -18.
[10] Freemont AJ,Byers RJ,Taiwo YO,et al.Resurfacing of articular cartilage by genetically-modified human chondrocytes in vitro[J].Ann Rheum Dis,1999,58(23):673.
[11] 袁琴,阚卫兵,宋朋飞,等.中医药治疗骨关节炎基础研究进展[J].辽宁中医药大学学报,2012,14(1):101.
[12] 翟云,高根德,徐守宇.膝关节骨关节炎的基础研究进展[J].中国骨伤,2012,28(1):83.
[13] Han S,Seerattan R,He~og W.Mechanical loading of in situ chondrocytes in lapine retropatellar cartilage after anterior cruciate ligament transection[J].J R Soc Interface,2010,7(47):895.

