高效毛细管电泳法同时分离检测土壤中三嗪类与磺胺类抗球虫药物的研究
苏红晓,檀华蓉,沈虎琴,田春秋
(1.安徽农业大学 茶与食品科技学院,安徽 合肥 230036;2.安徽农业大学生物技术中心,安徽 合肥 230036)
球虫病是一种对家禽肠道有损害、分布很广的寄生虫病,它不仅可以引起鸡只死亡、发育停滞,还可导致产蛋减少、饲料报酬低,对养禽业危害很大。目前球虫病的有效防治技术有药物防治、生物免疫、日粮调控等,药物防治是防治球虫病的主要手段[1-3]。而最常用的抗球虫药物为三嗪类中的地克珠利(Diclazuril)和磺胺类中的磺胺(Sulfanilamide)、磺胺氯吡嗪(Sulfaclozine)、磺胺喹啉(Sulfaquinoxaline),它们因高效、低毒、广谱的驱虫特点而在我国得到广泛应用[3-6]。
此类抗球虫药物进入到生物体后大部分以原药和代谢产物的形式经动物的粪便、尿液进入土壤、表层水体等生态环境中,在环境中降解非常缓慢,残留时间长,经长期积累对生态环境产生毒害作用,影响其中的植物、动物和微生物的正常生命活动,甚至通过生物链的传递,在人体内达到较高浓度,最终影响人体健康[7-9]。因此,此类抗生素作为一类重要的环境有机污染物应引起各方面关注。
目前,虽然抗球虫类药物的检测方法已有相关报道[10-13],但在环境中同时分析这两类抗球虫药物的方法尚未见报道。本文利用毛细管电泳的高效、快速、运行成本低等特点,建立了一种毛细管电泳方法,能够同时检测土壤中的上述4种抗球虫药物(结构式见图1),为开展抗球虫药环境行为研究及应对措施的制定提供了一种准确、简便的分析方法。
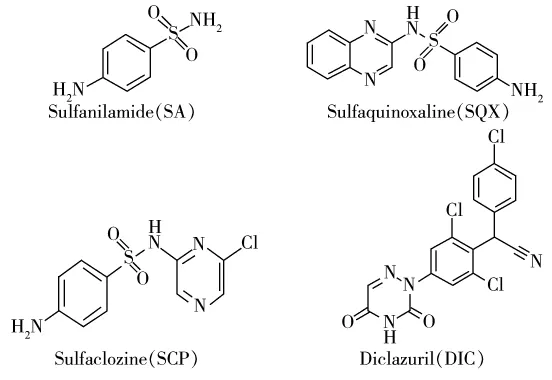
图1 4种抗球虫药物的化学结构式Fig.1 Chemical structures of four anticoccidial drugs
1 实验部分
1.1 仪器与试剂
高效毛细管电泳仪(P/ACETMMDQ,Beckman,USA)配有二极管阵列检测器和色谱工作站;未涂层熔融石英毛细管(60 cm×75 μm,河北永年与锐沣色谱器件有限公司);Seven Multi pH计(S40,Metter Toledo,CH);Milli-Q超纯水制备系统(Millipore,USA);R系列-旋转蒸发仪(上海申生科技有限公司);调速多用振荡器(上海智域分析仪器制造有限公司);H-1650台式高速离心机(上海穗康仪器有限公司)。
磺胺(SA,纯度 >99.8%)、磺胺氯吡嗪(SCP,纯度 >99.8%)、磺胺喹啉(SQX,纯度 >99.8%)、地克珠利(DIC,纯度 >99.8%)均购自中国兽医药品监察所;硼砂、硼酸、四氢呋喃(THF)、KH2PO4、NaOH(分析纯,国药集团化学试剂有限公司),乙腈为色谱纯,实验用水为超纯水。样品采自合肥周边4个养鸡场。样品经自然风干、研碎后以60目筛筛分,储存于广口瓶中备用。
1.2 溶液的配制
标准溶液:精确称取SA、SQX、SCP、DIC标准品各10.00 mg,DIC用四氢呋喃溶解定容至10 mL,其它3种药物用30 mmol/L NaOH溶液溶解定容至10 mL,分别配制成1.00 g/L标准贮备液;上机前混合4种标准贮备液并用60%乙腈-水稀释,制得质量浓度分别为50.00、25.00、12.50、6.25、3.12、1.56 mg/L的标准混合工作液,备用。
样品溶液:准确量取1.00 g土壤样品,置于50 mL离心管中,加入10 mL 0.1 mol/L NaOH/THF(3∶2,体积比)提取液,封口后在恒温振荡器中振荡24 h。静置沉淀后,将上清液在10 000 r/min速度下离心5 min,分离上清液。将上清液旋转蒸发至近干,最后用H2O/THF(3∶2)溶液定容至1 mL,过 0.22 μm 微孔滤膜,供 HPCE 分析用[14-16]。
缓冲溶液:称取一定量的硼砂,用水溶解定容,分别配制成30、50、70 mmol/L的硼砂溶液;称取一定量的硼酸,用水溶解定容,配制成200 mmol/L的硼酸溶液;根据实验需要将硼砂、硼酸溶液按一定比例混合,调pH值分别为8.4、8.6、8.8、9.0、9.2,过0.22 μm滤膜,备用。
1.3 实验方法
未涂层熔融石英毛细管柱(60 cm×75 μm);运行缓冲液为50 mmol/L硼砂-200 mmol/L硼酸缓冲液(pH 9.0);检测波长220、254 nm;分离电压23 kV;分离温度25℃;样品采用压力进样,进样压力3 448 Pa,进样时间5 s。
毛细管柱使用前用1、0.1 mol/L NaOH溶液、水分别清洗20 min。为保证实验结果的重复性,每次进样前用0.1 mol/L NaOH溶液平衡毛细管柱2 min,水冲洗3 min,分析缓冲液平衡3 min[17-18]。
2 结果与讨论
2.1 提取条件的优化
2.1.1 提取液的选择 4种抗球虫药物中的磺胺、磺胺氯吡嗪、磺胺喹啉均属于磺胺类药物,据文献报道[9],土壤中磺胺类药物多采用0.1 mol/L氢氧化钠水溶液作提取剂;而土壤中地克珠利的提取方法未见报道,因地克珠利几乎不溶于氢氧化钠水溶液,故将4种药物混合溶于乙腈的碱溶液、四氢呋喃的碱溶液、N,N-二甲基甲酰胺的碱溶液中,结果显示,4种药物在四氢呋喃碱溶液和N,N-二甲基甲酰胺碱溶液中易溶,在乙腈碱溶液中较难溶。而N,N-二甲基甲酰胺沸点较高,不利于下一步的浓缩,因此本实验选择0.1 mol/L氢氧化钠水溶液和四氢呋喃的混合液作为提取溶剂。
2.1.2 提取液体积比的确定 两种提取剂的比例直接影响4种抗球虫药物的提取效率。本实验考察了0.1 mol/L NaOH与THF提取液的体积比分别为2∶3、1∶1、3∶2、3∶1时对4种药物提取率的影响(见图2),结果表明,当NaOH与THF的体积比为3∶2时,4种药物的提取率均在80%以上。
2.1.3 提取剂用量的确定 提取剂用量会影响4种药物的提取效果,用量太少提取不完全;用量太多则会提取更多的杂质[17]。实验考察了提取剂用量为5、10、15、20 mL时的提取效果。结果表明,当提取剂用量为5 mL时,4种药物的提取率低于80%;当提取剂用量为10、15、20 mL时提取率均能达到80%以上且无明显变化。因此,实验选择提取剂用量为10 mL。
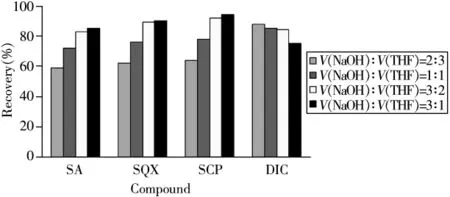
图2 提取液体积比对4种抗球虫药提取率的影响Fig.2 Effect of different extraction ratios on recoveries of four anticoccidial drugs
2.2 电泳分离条件的优化
2.2.1 检测波长的确定 对4种抗球虫药物在190~300 nm波长范围内进行全波长扫描(结果见图3),SA在200 nm和254 nm处均有最大吸收,SQX和SCP在254 nm处有最大吸收,DIC在220 nm处有最大吸收。综合考虑,选择254 nm作为3种磺胺类药物的最佳检测波长,用220 nm作为地克珠利的最佳检测波长。

图3 4种抗球虫药的紫外光谱图Fig.3 UV spectra of four anticoccidial drugs 1.SA,2.DIC,3.SQX,4.SCP
2.2.2 电泳缓冲液种类的影响 缓冲溶液种类对毛细管区带电泳分离效果有明显的影响。本实验分别考察了硼砂-硼酸、硼砂-氢氧化钠、磷酸二氢钾-硼砂3种不同缓冲体系对分离效率的影响。结果表明,磷酸二氢钾-硼砂缓冲体系的分离效果较差;硼砂-氢氧化钠缓冲体系基线漂移、噪音较大且迁移时间较长;而硼砂-硼酸缓冲体系中的峰形较理想,灵敏度较高。因此,选择硼砂-硼酸作为最佳运行缓冲液。
2.2.3 缓冲液pH值的影响 考察了50 mmol/L硼砂-200 mmol/L硼酸缓冲液的pH值为8.4、8.6、8.8、9.0、9.2时对DIC、SQX、SCP分离度的影响。结果表明,缓冲液pH值为9.0和9.2时,相邻两药物间的分离度均能达到1.2以上,但pH 9.2时,迁移时间过长。因此,实验选用pH 9.0的硼砂-硼酸缓冲液体系。
2.2.4 电泳缓冲液离子浓度的选择 考察了缓冲体系在pH 9.0,硼酸浓度为200 mmol/L,硼砂浓度为30、50、70 mmol/L时对4种药物分离的影响,结果见图4。由图可以看出,随着缓冲液离子浓度的增大,迁移时间相应增长。且迁移时间均在7.0 min左右,相邻两药物间的分离度只能达到1.2,不能完全达到基线分离。因此,选择不同离子浓度的硼砂-硼酸缓冲液作为正交实验因子。
由图还可以看出,磺胺与其它药物的分离度很大,影响分离效果的主要是其它3种药物间的分离度,所以本文重点考察了其它因素对DIC、SQX、SCP 3种药物间分离度的影响。
2.2.5 分离电压的影响 在其他条件相同的情况下,考察了分离电压分别为21、23、25、27、29 kV时对后3种药物分离的影响(结果见图5)。由图可以看出,随着分离电压的增加,迁移时间缩短,但分离度下降,当分离电压为29 kV时分离度不足1.2,而分离电压为21 kV时迁移时间太长。因此本实验选择23、25、27 kV作为正交实验因子。
2.2.6 分离温度的影响 温度变化不仅影响分离的重现性,而且影响分离效率,一般在20~30℃之间进行温度选择[18-19]。综合考虑各方面的因素,选择20、25、30℃作为正交实验因子。

图4 离子浓度对4种药物分离的影响Fig.4 Effect of ion concentrations on separation of four anticoccidial drugs
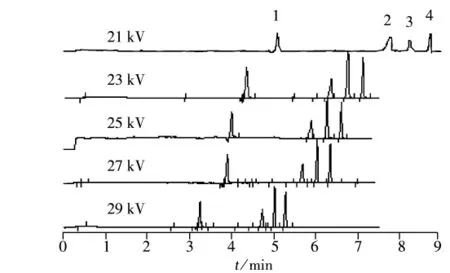
图5 分离电压对4种药物分离的影响Fig.5 Effect of voltages on separation of four anticoccidial drugs
2.3 正交实验
为了进一步优化最佳分离分析条件,根据前期探索性试验,选取3个相对重要的因素:缓冲体系的离子浓度、分离电压和温度进行正交试验,每个因素选取3个水平,以L9(33)3因素3水平实验确立最佳的毛细管电泳分离条件,结果见表1。

表1 4种抗球虫药的3因素3水平正交实验设计表Table 1 The L9(33)orthogonal experimental design table of four anticoccidial drugs
通过对以上多指标正交实验结果进行分析可知,仅依靠数学分析无法得到正确的结果,所以综合考虑实际中的分离度和迁移时间[19-20],选择第4组实验为最优试验方案。其中,第4组实验中的4种抗球虫药物的最小分离度同时达到了1.5以上,且迁移时间较短。因此最佳的电泳分离条件为:缓冲液为50 mmol/L硼砂-200 mmol/L硼酸(pH 9.0);运行电压为23 kV;运行温度为25℃。在最佳的分离条件下对4种药物进行电泳分离,结果见图6。
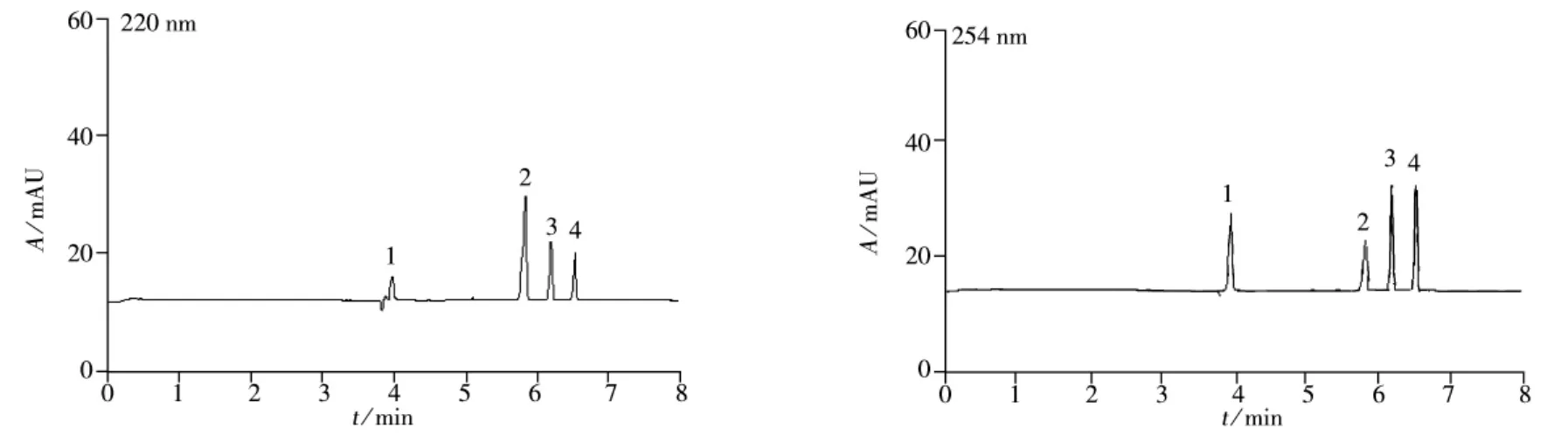
图6 4种抗球虫药混合标准液的电泳图谱Fig.6 Electropherograms of four anticoccidial drugs mixed standards 1.SA,2.DIC,3.SQX,4.SCP
2.4 线性关系与精密度
在最佳电泳条件下,对1.56~50 mg/L 4种药物的混合标准液进行分析,考察峰面积(Y)与药物质量浓度(X)的线性关系。结果显示,在该范围内,4种药物的峰面积与质量浓度呈良好线性,其回归方程及相关系数(r2)见表2。计算得到峰面积的相对标准偏差(RSDs,n=6)小于6%;迁移时间的RSD(n=6)小于0.2%,方法显示了良好的精密度。
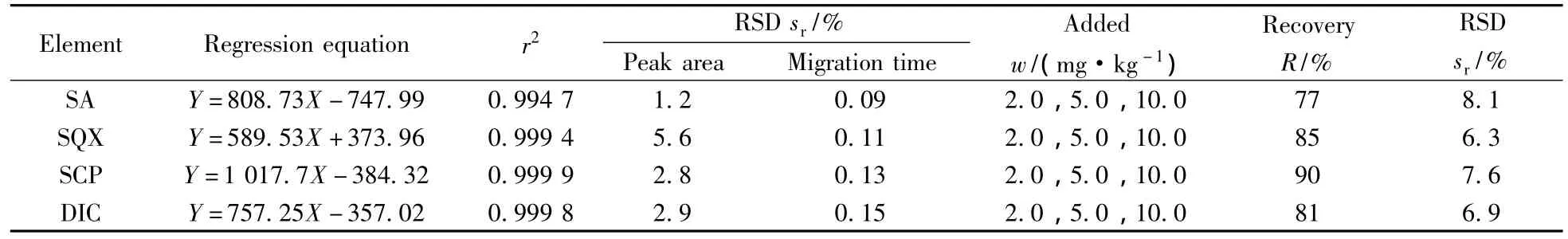
表2 4种抗球虫药的线性方程、线性系数、加标回收率与相对标准偏差Table 2 Calibration curves,correlation coefficients,spiked recoveries and RSDs of four drugs
2.5 实际样品的测定
在合肥周边4个不同养鸡场采集4份土壤样品,按照“1.2”制备样品溶液,在优化电泳条件下进行测定,每个样品做2个平行。其中1、4号样品检出地克珠利,含量分别为1.02、1.24 mg/kg;3号样品检出磺胺氯吡嗪,含量为1.65 mg/kg;而2号样品中4种药物均未检出(见图7A)。结果显示,目标组分得到了很好的分离,且基质干扰较小。
2.6 回收率实验
分别向2号土壤样品中加入2.0、5.0、10.0 mg/kg 3种水平的4种抗球虫药标准混合溶液,按照“1.2”制备样品溶液,进行加标回收率实验,在优化电泳条件下,得到加标土壤样品的电泳图(图7B)。每个水平平行测定3次,4种抗球虫药的回收率在77%~90%之间,相对标准偏差(RSDs)为6.3%~8.1%(见表2)。
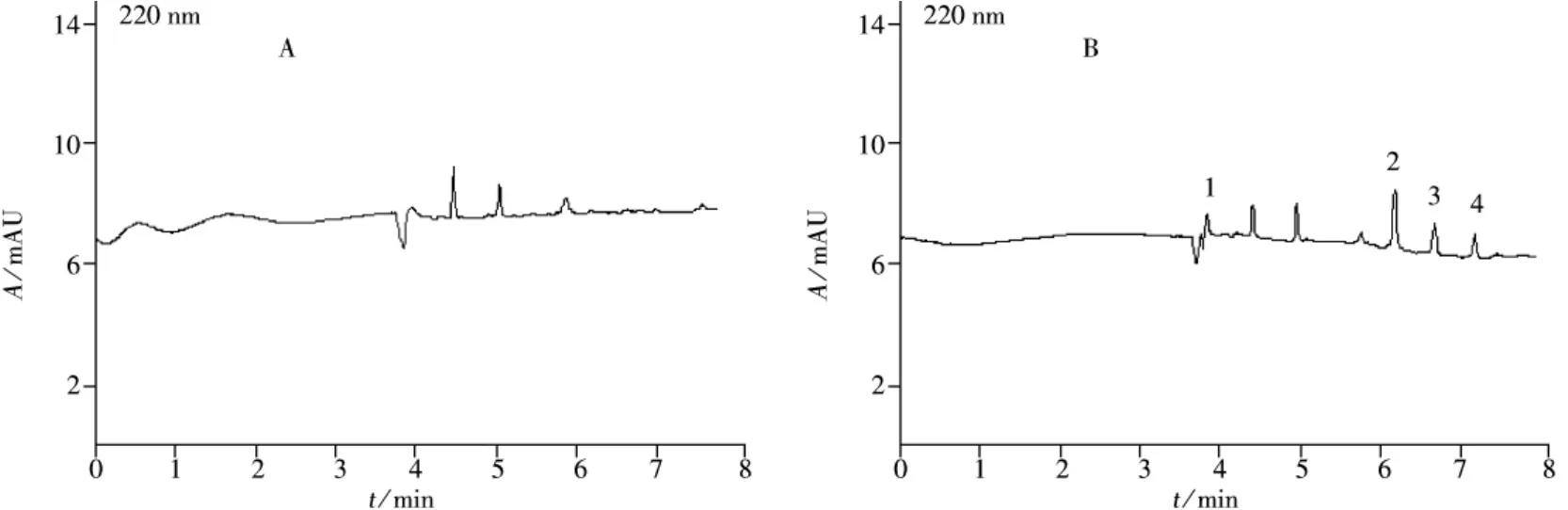
图7 2号土壤样品(A)及加标土壤样品(B)的电泳图Fig.7 Electropherograms of the second soil sample(A)and spiked the second soil sample(B)1.SA,2.DIC,3.SQX,4.SCP
3 结论
本文建立了同时提取土壤中两类抗球虫药物的前处理方法,该方法提取率高,可有效去除样品中的杂质,色谱图背景简单,无干扰峰,结果令人满意。所确立的毛细管电泳法与其他分析方法相比,简便易行、成本低,为同时快速检测土壤中两类常用抗球虫药物提供了一种更有效的分析手段。
[1]Hafez M H.Archiv.Fur.Geflugelkunde,1995,72(1):2-7.
[2]Yang X F,Zhong H,Zhao D H.J.Anhui Agric.Sci.(杨雪峰,钟华,赵东豪.安徽农业科学),2006,34(20):5257-5258.
[3]Wang X H,Liang J P,Liu Y,Guo W Z,Guo Z T.China Poultry(王学红,梁剑平,刘宇,郭文柱,郭志廷.中国家禽),2010,32(15):48-51.
[4]Hong X.Modern Animal Husbandry(洪学.当代畜禽养殖业),2011,3:18-21.
[5]Guo C J,Xu G L.J.Veter.Med.(郭春江,徐国梁.兽药),2010,10:180.
[6]Liu Y M,Peng G L.Chinese Journal of Rabbit Farming(刘以民,彭光林.中国养兔),2008,11:25-27.
[7]Jin C X,Gao R S,Wu C Y.J.Zhejiang Agric.Sci.(金彩霞,高若松,吴春艳.浙江农业科学),2011,(1):127-131.
[8]Diao X P,Sun Z J,Shen J Z.Chin.J.Appl.Ecol.(刁晓平,孙振钧,沈建忠.应用生态学报),2004,15(2):321-325.
[9]Zhang C L.The Environmental Behavior and the Related Thermodynamic Study of Sulfaclozine Drugs.Zhengzhou:Zhengzhou University(张从良.磺胺类药物环境行为及相关热力学基础研究.郑州:郑州大学),2007.
[10]Dong J,Gong X M,Zhang L,Sun J,Wang H T.Chin.J.Health Lab.Technol.(董静,宫小明,张立,孙军,王洪涛.中国卫生检验杂志),2008,18(1):26-28.
[11]Gong X M,Sun J,Dong J,Yu J L,Wang H T.Chin.J.Chromatogr.(宫小明,孙军,董静,于金玲,王洪涛.色谱),2011,3:217-222.
[12]Mortier L,Daeseleire E,Huyghebaert G,Delahaut P.J.Agric.Food Chem.,2005,53(4):905-911.
[13]Shi Z H,Lu J X,Ge Q L,Gong J S,Liu X X,Qi K Z.Chin.J.Veter.Med.(施祖灏,陆俊贤,葛庆联,龚建森,刘学贤,祁克宗.中国兽药杂志),2008,42(9):13-16.
[14]Zhang C L,Wen C B,Wang Y,Wang F A.J.Anal.Sci.(张从良,文春波,王岩,王富安.分析科学学报),2007,23(5):616-618.
[15]Elena M C,Carmen B,Sigrid S,Oliver G.Environ.Pollut.,2007,148:570 -579.
[16]Holger H,Kornelia S.Environ.Microbiol.,2007,9(3):657 -666.
[17]Shen H Q,Tan H R,Qi K Z,Tian C Q.J.Instrum.Anal.(沈虎琴,檀华蓉,祁克宗,田春秋.分析测试学报),2012,31(3):302-306.
[18]Chen Y.Technology and Application of Capillary Electrophoresis.Beijing:Chemical Industry Press(陈义.毛细管电泳技术及应用.北京:化学工业出版社),2000:40.
[19]Tian C Q,Tan H R,Gao L P,Shen H Q,Qi K Z.Chin.J.Chromatogr.(田春秋,檀华蓉,高丽萍,沈虎琴,祁克宗.色谱),2011,29(11):1128-1132.
[20]Li Y Y,Hu C R.Experiment Design and Date Processing.Beijing:Chemical Industry Press(李云雁,胡传荣.实验设计与数据处理.北京:化学工业出版社),2005:89.

