长期储藏干燥发菜超微结构和生理特性分析
张亚萍,雷晓婷,杨 佳,林 佳,周有文,梁文裕
(宁夏大学 生命科学学院,宁夏 银川750021)
发菜(Nostoc flagelliforme)是一种陆生固氮蓝藻,主要分布于干旱-半干旱荒漠草原地区,是当地重要的固氮资源和防风固沙的先锋植物[1-2]。发菜的结构和生理表现出很强的旱生生态适应性,能在极度干燥的条件下存活数十年,复吸水后仍可迅速恢复代谢活性[3]。目前有关发菜的研究主要集中在生长发育[4]、生理生态[5-6]及对极端环境的适应领域[2,7-8],而对于发菜能耐储藏及可长期保持生理活性的机理知之甚少。因此,以野生干燥发菜为对照,对储藏十年干燥发菜的超微结构及生理代谢进行研究,以期为探讨发菜耐长期储存的适应和保护机制提供依据。
1 材料与方法
1.1 试验材料
长期储藏干燥发菜(LTS)和野生干燥发菜(NGS)均采自宁夏香山同一发菜自然生长地。长期储藏干燥发菜在实验室阴凉干燥避光储藏10年,发菜含水量14.1%。野生干燥发菜为野外正常生长状态的干燥发菜,采集条件为25℃、光照强度200 μmoL·m-2·s-1、空气相对湿度 35%、光周期 14 h/10 h,发菜含水量 7.1%。
1.2 方法
1.2.1 发菜超微结构观察
发菜超薄切片的制备参照董渭祥等的方法[9]并做适当修改。将处理好的发菜样品切成1 mm×2 mm的小段,放入干净小瓶,2.5%戊二醛前固定3 h,PBS 缓冲液(pH 7.2)冲洗3 次,每次15 min;然后1.0%四氧化锇后固定4 h,再用PBS缓冲液洗涤3次,每次15 min;系列浓度梯度丙酮脱水,每次30 min;不完全树脂渗透,Epon812树脂包埋,KB 2088超薄切片机切片,厚度700~800 nm;醋酸双氧铀、柠檬酸铅双重染色。加速电压为80 kV,H-7650B透射电镜观察拍照。
1.2.2 光合活性的检测
光合活性的检测采用Zhao等方法[10]。净光合活性根据下列公式计算:

其中C/t记录的CO2浓度负斜率,V是密闭体系的体积(0.579 L),T是同化室温度,Wf样品干重。
暗呼吸采用 Krause和 Weis[3]的方法。
1.2.3 光合色素含量测定
叶绿素含量测定参照Mackinney等人方法[11]。称取1 g样品,加入15 mL无水甲醇过夜提取4℃,经5 000 r·min-1离心5 min,测定其吸光值。按公式计算
叶绿素 a含量:C a=(μg·mL-1)=16.29·A665-8.54·A652
类胡萝卜素含量:C(μg·mL-1)=7.6(A480-1.49·A510)
藻胆素含量测定采用张薇君[12]等人的方法。准确称取1 g发菜样品,用pH 7.0缓冲液,定溶于25 mL容量瓶中;置于-20℃冰箱内冷冻12 h,取出解冻后,3 000 r·min-1离心15 min,取上层清液,用提取液做空白,分别测定620 nm,652 nm,562 nm处的吸光度(整个操作过程要求避光)。
1.2.4 脯氨酸、可溶性蛋白和可溶性糖含量测定
脯氨酸含量测定参照Hyman等人[13]方法。称取1 g发菜样品,用3%的磺基水杨酸溶液研磨,磺基水杨酸的最终体积为10 mL。匀浆液转入试管中,有塑料薄膜封口,在沸水浴中浸提30 min,冷却后,以3 000 r·min-1离心10 min,取上清液待测。取2 mL上清液,加2 mL水,同标准曲线程序进行显色、萃取和比色。脯氨酸(μg·g-1)=C·Vt/(W·Vs),其中C:标线查的脯氨酸含量;Vt提取液总体积;Vs:测定用体积;W:样品干重。
蛋白质含量的测定参考Bradford的方法[14]。
可溶性糖含量测定参照Kuo等人[15]的方法。
1.2.5 丙二醛、超氧阴离子自由基和过氧化氢含量测定
丙二醛含量测定参照王跟轩等[16]人方法并做适当修改。称取1 g发菜样品,加入2 mL 10%三氯乙酸(TCA)和少许石英砂研磨,进一步加入8 mL 10%TCA充分研磨,匀浆液以4 000 r·min-1离心10 min,上清液为样品提取液。吸取2 mL提取液于试管中,加入2 mL 0.6%硫代巴比妥酸(用10%TCA配制 0.6%的 TBA 溶液),1 mL 0.1%FeCl3,混匀,塑料薄膜封口,置于沸水浴中沸煮15 min,迅速冷却,5 000 r·min-1离心10 min。取上清液测定600 nm、532 nm和450 nm的OD值。
超氧阴离子水平测定参照萧华山[17]的方法。
过氧化氢含量测定参照Patterson BD[18]等人方法。
1.2.6 SOD和CAT活性及Vc含量测定
SOD活性测定参照邵从本等人方法[19]。以能抑制反应50%的酶量为一个SOD酶单位。SOD总活性=(A0-As)×V/0.5×A0×W×Vt(A0对照管的OD值;As为样品管的OD值;V为样品总体积;Vt为测定时样品用量;W为样品干重)。
CAT活性测定参照 Chance[20]方法,并做进一步修改。称取0.5 g发菜,加入3~5 mL的65 mmol·L-1磷酸缓冲液(pH 7.4),冰浴研磨,终体积为15 mL,在 10 500 r·min-1下离心 30 min,上清液为粗酶液。取粗酶液 0.5 mL,加入 0.5 mL 10 mmol·L-1的 H2O2,37 ℃水浴 2 min,立即加入 0.3 mL 5%硫酸钛,加入1 mL饱和氯化钠,最后加入3 mL 2 mol·L-1硫酸,在415 nm下测定其 OD值,表示为A 测;取粗酶液 0.5 mL,1 mL 饱和氯化钠,0.5 mL 10 mmol·L-1的 H2O2,37 ℃ 水浴 2 min,立即加入0.3 mL 5% 硫酸钛,加入 3 mL 2 mol·L-1硫酸,在415 nm下测定其OD值表示为,A对。以分解H2O2的量表示CAT酶活性,CAT活性按如下公式计算:CAT 活性 =(C对-C测)·Vt/(V测·DW·t)。其中,C对为A对查标准曲线的值;C测为A测查标准曲线的值;Vt为提取液总体积;V测为测定用体积;DW为样品干重;t为反应时间。
Vc含量测定参照周有文[21]等人的方法。称取1 g发菜,加入5 mL草酸-EDTA研磨成匀浆,终体积为15 mL,在3 000 r·min-1下离心15 min,上清液即为Vc提取液。取上清液1 mL,加入4 mL草酸-EDTA,1.5 mL偏磷酸-醋酸,2 mL 5%硫酸,4 mL 5%钼酸铵,30℃水浴15 min,在730 nm下测定其OD值。
1.3 数据分析
本实验数据采用SPSS V17.0进行单因素方差分析Scheffe检验。表中数据为10次平均值±标准差,图中误差线为3次重复的标准差。

图1 野生干燥发菜与储存10年干燥发菜营养细胞超微结构比较Ⅰ、Ⅱ、Ⅲ野生干燥发菜营养细胞;Ⅳ、Ⅴ、Ⅵ为储存一年的发菜营养细胞;Ⅰ、Ⅳ:3 000×;Ⅱ、Ⅴ:5 000×;Ⅲ、Ⅵ:12 000×;CW.细胞壁;G.糖原颗粒;fb.假空泡;Pb.多角体;Sg.结构颗粒;S.胶质鞘;T.类囊体膜
2 结果与分析
2.1 野生和长期储存干燥发菜超微结构的比较
野生干燥发菜和储存10年的干燥发菜胶质鞘和细胞结构完整,细胞近似圆形,直径2~3μm;细胞壁分为4层,厚度为30 nm左右,细胞内有多面体、糖原颗粒等结构(图1,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ)。与野生干燥发菜相比较,储存10年的干燥发菜胶质鞘层较稀疏(图1,Ⅰ、Ⅱ、Ⅳ、Ⅴ),糖原颗粒数目减少,而结构颗粒数目没有明显变化(图1,Ⅱ、Ⅲ、Ⅴ、Ⅵ)(图1)。
2.2 野生和长期储存发菜光合生理的比较
储存10年的干燥发菜无净光合速率(图2,A),其暗呼吸速率、叶绿素a、藻蓝素、别藻蓝素和藻红素比野生干燥发菜分别降低了1400%,(p<0.01)(图 2,B)、45.83%(P <0.01)(图 2,D)、248.46%(P <0.01)(图2,E)、109.94%,(P <0.01)(图2,E)和262.19%(P <0.01)(图 2,E),而类胡萝卜素含量显著升高,增加量达96.58%(P <0.01)(图2,C)。
2.3 野生和长期储存发菜渗透调节物质的比较
与野生干燥发菜相比,长期储存干燥发菜脯氨酸(图2,A)、可溶性蛋白(图3,B)和可溶性糖含量(图 3,C)分别增加了 38.28%(P <0.05)、24.49%(P <0.05)和24.03%(P <0.05)。
2.4 野生和长期储存干燥发菜活性氧代谢的比较
与野生干燥发菜相比,长期储存干燥发菜的丙二醛含量(图4,A)、H2O2含量(图4,B)和超氧阴离子自由基含量(图4,C)分别增加了5.84%(p<0.05)、58.38%(P <0.05)和 63.46%(P <0.05)。而SOD活性(图4,D)、CAT 活性(图4,E)和 Vc含量(图 4,F)则分别增加了 6.97%(P <0.05)、12.49%(P <0.05)和27.53%(P <0.05)。
2.5 野生和长期储存干燥发菜生理学指标相关性分析
对野生和长期储存干燥发菜生理学指标相关性分析表明,净光合速率分别与叶绿素a、藻胆素呈显著正相关(p<0.05),与类胡萝卜素呈显著负相关(p<0.05),与暗呼吸速率呈极显著正相关(p<0.01);暗呼吸速率与净光合速率呈极显著正相关(p<0.01)与叶绿素a、藻胆素呈显著正相关(p<0.05),与类胡萝卜素呈极显著负相关(p<0.01);叶绿素a与藻胆素呈显著正相关(p<0.05);类胡萝卜素与暗呼吸速率呈极显著负相关(p<0.01);藻蓝素与别藻蓝素含量呈极显著正相关(p<0.01),与藻红素呈正相关(p<0.05);别藻蓝素分别与藻蓝素、藻红素含量呈极显著正相关(p<0.01);藻红素与别藻蓝素呈极显著正相关(p<0.01),与藻蓝素呈正相关(p<0.05)。而脯氨酸含量分别与可溶性蛋白、可溶性糖呈显著正相关(p<0.05),可溶性蛋白分别与脯氨酸、可溶性糖含量呈显著正相关(p<0.05),可溶性糖分别与脯氨酸、可溶性蛋白呈显著正相关(p<0.05)。此外,丙二醛含量与SOD活性呈显著正相关p<0.05),H2O2含量与Vc含量呈显著正相关p<0.05),超氧阴离子自由基含量与Vc含量量呈显著正相关p<0.05),CAT活性与Vc含量呈显著正相关p<0.05),Vc含量与H2O2含量、超氧阴离子自由基含量、CAT活性呈显著正相关p<0.05)(表1)。

图2 野生干燥发菜与储存10年干燥发菜光合活性和光合色素含量的变化
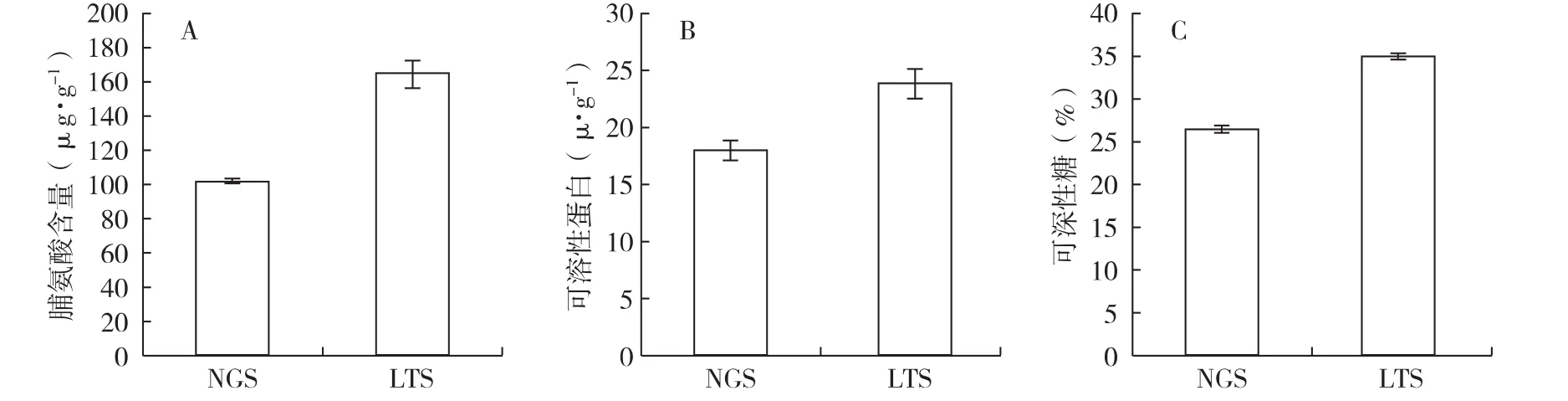
图3 野生干燥发菜与储存10年干燥发菜脯氨酸、可溶性蛋白和可溶性糖含量的比较
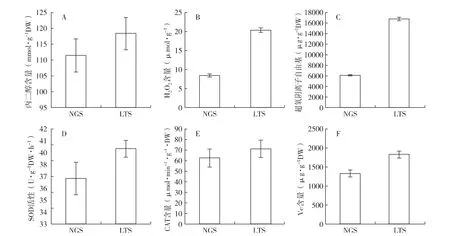
图4 野生干燥发菜与储存10年干燥发菜丙二醛、H2 O2、超氧阴离子自由基含量和SOD、CAT活性及Vc含量的变化

表1 野生干燥发菜与储存10年干燥发菜生理指标相关性分析
3 讨论
3.1 长期储存对发菜细胞结构的影响
发菜是一种生长在干旱-半干旱荒漠草原地区的陆生固氮蓝藻,经常遭受温度、水分、光照等环境因子的变化的影响,因而对极端环境有很强的适应性。Liang[22]等研究表明,持续失水48 h的发菜外表干燥、皱缩,但藻体、藻丝体、胶鞘和细胞结构完整,类囊体膜及细胞内颗粒物质无明显变化,恢复吸水4 h后,藻体膨胀,藻体和细胞结构完整,但细胞内液泡的数量和体积比干燥发菜细胞的多;周有文等[21]研究表明,发菜随着含水量降低,其胶质鞘趋于紧密,类囊体结构逐渐模糊,排列紊乱,糖原颗粒随着水分散失,数目减少,但结构颗粒数目没有明显变化。本研究表明,长期储存的发菜胶质鞘层紧密,糖原颗粒数目减少,但藻体和细胞结构完整,表明在长期储存过程中,虽然发菜的生长代谢受到抑制,但由于藻体及细胞结构完整,这就为条件适宜时恢复生理活性奠定了结构基础,是发菜耐长期储藏而仍能恢复生命活力的重要结构基础。
3.2 长期储藏对发菜光合生理的影响
发菜在干燥或脱水条件下净光合速率和暗呼吸速率呈明显下降趋势,这些变化可能与能量代谢相关的部分蛋白下调表达有关[23]。长期储存的干燥发菜能够在一定条件下恢复生理活性依赖于其独特的光恢复特性[22]。在长期储存过程中,由于干燥脱水、避光等环境因素,发菜的生理活性极度微弱,光合作用停止,呼吸作用下降,叶绿素a和藻胆素(藻蓝素、别藻蓝素和藻红素)含量下降,净光合速率分别与叶绿素a、藻胆素呈显著正相关(p<0.05),与类胡萝卜素呈显著负相关,与暗呼吸速率呈极显著正相关(p<0.01),这些变化是发菜对环境变化的一种适应与保护。此外,叶绿素a和藻胆素含量减少可使其对光能的捕获能力降低,从而降低光合系统遭受破坏的风险,这也是发菜适应长期储存的一种光保护调节机制。
3.3 长期储存对发菜抗性生理的影响
植物在呼吸作用过程中,细胞会持续不断地产生活性氧自由基(ROS)[25]。过量ROS的产生和积累会导致氧化性胁迫、细胞组成和结构的损坏及细胞功能的丧失。此外,ROS还可能充当信号分子启动一些系列信号传导途径,进而导致细胞程序性死亡(PCD)[25-26]。因此,细胞内氧化和抗氧化体系的平衡对细胞结构、功能、调控及适应多样化的生长环境是至关重要的[27]。为了克服氧化性胁迫,植物发展了依赖于酶和非酶的抗氧化防御系统,以达到清除多余ROS的目的[28]。发菜在脱水48 h时,净光合速率、暗呼吸速率、总Rubisco活性、超氧阴离子水平、SOD、CAT、POD活性以及固氮酶和谷氨酰胺合成酶活性明显下降,而H2O2、氨和脯氨酸含量增加[24]。本研究表明,长期储存发菜与野生干燥发菜相比,丙二醛、H2O2、超氧阴离子自由基和Vc含量以及SOD活性和CAT活性呈显著升高(图4),而且渗透调节物质如脯氨酸、可溶性蛋白与可溶性糖含量都明显高于野生干燥发菜(图3)。相关性分析表明,丙二醛含量与SOD活性呈显著正相关,H2O2含量与Vc含量呈显著正相关,超氧阴离子自由基含量与Vc含量量呈显著正相关,CAT活性与Vc含量呈显著正相关,Vc含量与H2O2含量、超氧阴离子自由基含量、CAT活性呈显著正相关(表1)。分析认为,发菜在长期储存过程中,虽然生理活性处于极度微弱或生理休眠状态,但仍有ROS的积累,与此相应的抗氧化酶也处于较高水平,SOD、CAT和Vc等协同作用,共同维持活性氧代谢的平衡,这也反映了发菜耐长期储存的适应和保护策略。此外,长期储存的发菜中的类胡萝卜素含量明显高于野生干燥发菜(图2,C)。类胡萝卜素作为光合作用的辅助色素,不仅参与执行光能传递和物质转化,而且具有抗光敏化作用、碎灭自由基等重要生理功能。而在长期储藏的发菜中,类胡萝卜素如何既要与SOD和CAT等抗氧化酶协调抗氧化性胁迫,又要与叶绿素a和藻胆素等协调光能传递和物质转化,这一问题有待深入研究。
[1] Gao K S.Chinese studies on the edible blue-green alga,Nostoc fiagelliforme:a review[J].JAppl Phycol,1998,(2):37-49.
[2] 钱凯先,朱浩然,陈树谷.发菜的生态条件及其规律分析[J].植物生态学与地植物学学报,1989,(2):97-105.
[3] Krause GH,Weis E.ChlorophyⅡfluorescence and photosynthesis[J].Ann Rev Plant molBiol,1991,42:313-349.
[4] 唐进年,张盹明,聂文果,等.发菜形态特征及其与环境因子的关系[J].干旱区资源与环境,2003,(1):123-128.
[5] 张盹明,唐进年,聂文果,等.发菜光合特性与水分关系的研究[J].西北植物学报,2003,23(5):739-744.
[6] 叶长鹏.陆生蓝藻发菜的光合作用研究[D].武汉:中国科学院研究生院(水生生物研究所),2005.
[7] 梅俊学,程子俊.供水和光照对发菜生理活性的影响[J].西北师范大学学报:自然科学版,1989,(1):63-68.
[8] 王发珠,张云.陆生蓝藻发菜的持水力和固氮作用[J].植物学通报,1988,(2):93-95.
[9] 董渭祥,高小彦.植物超薄切片制备技术[J].植物生理学通讯,1982,48(5):32-35.
[10] Zhao X M,Bi Y H,Chen L,et al.Responses of photosynthetic activity in the drought-tolerant cyanobacterium,Nostoc flagelliforme to rehydation at different temperature[J].Arid Environments,2008,72(4):370-377.
[11] Mackinney G.Absorption of light byx chlorophy II solition[J].BioChem,1941,140:315-322.
[12] 张薇君,郝纯彦.出口螺旋藻粉中藻胆蛋白测定方法的研究[J].光谱仪器与分析,1999,3:8-11.
[13] Rosen H.A modified ninhydrin colorimetric analysis for amino acids[J].Arch Biochem and Biophys,1957,67(1):10-15.
[14] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analti Biochem,1976,72:248-254.
[15] Kuo TM,van M JF,Worlf W J.Content of raffinose-oligosaccharides and sucrose in various plant seeds[J].Agric Food Chem,1988,36:32-36.
[16] 王根轩,杨成德,梁厚果.蚕豆叶片发育与衰老过程中超氧物歧化酶活性与丙二醛含量变化[J].植物生理学报,1989,15(1):10-13.
[17] 萧华山,何文锦,傅文庆,等.一种用分光光度计检测氧自由基的新方法[J].生物化学与生物物理进展,1999,26(2):180-183.
[18] Patterson B D,Macrae E A,Ferguson I B.Estimation of hydrogen peroxide in plant extract using titanium[J].Anal Biochem,1984,139:487-492.
[19] 邵从本.一种检测SOD活性反应的比较[J].植物生理学通讯,1983,(5):43-46.
[20] Chance B,Maethly A C.Assay of catalase and peroxidase[J].Methods in Enzymology,1955,10(2):765-775.
[21] 周有文,张亚萍,杨军,等.干旱胁迫对发菜超微结构及抗性生理的影响[J].植物研究,2012,(02):171-176.
[22] Liang Wenyu,Zhou Youwen,Wang Xin,et al.Ultrastructural,physiological and proteomic analysis of Nostoc flagelliforme in response to dehydration and rehydration [J].J Proteomics,2012,75:5604-5627.
[23] Gao K S,Qiu BS,Xia JR,et al.Light dependency of the photosynthetic recovery of Nostoc flagelliforme[J].Appli Phyco 1998,(10):51-53.
[24] Klaus A,Heribert H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annu Rev Plant Biol,2004,53:373-399.
[25] Dat JF,Pellinene R,Beeckman T,et al.Changes in hydrogen peroxide homeostasis trigger an active cell death process in tobacco.[J].Plant J,2003,33:621-632.
[26] Frank V,Breusegem,James F,et al.Reactive oxygen species in plant cell death.New tools for reactive oxygen species research[J].Plant Physiol,2006,141:379-383.
[27] Shulaev V,Oliver D J.Metabolic and proteomic markers for ox idative stress.New tools for reactive oxygen species research[J].Plant Physiol,2006,141:367-372.
[28] Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation[J].New Phytol,1993,125(1):27-58.

