JAK2/STAT3信号传导通路在脑缺血再灌注损伤中的作用
陈真珍 王凯华 黄龙坚
广西中医药大学 南宁 530001
缺血性脑卒中是危害人类健康的三大疾病之一,目前虽然早期动脉溶栓治疗能够获得满意措施,但由于其严格的时间窗和禁忌证及出血风险,将绝大多数的患者挡在门外。所以寻找缺血再灌注损伤后有效的脑保护措施,以减少神经元死亡,改善神经功能成为研究的热点。JAK (Janus kinase)/STAT (signal transducer and activator of transcription)信号转导通路参与了中枢神经系统紊乱疾病中的多种炎症病理过程[1],而JAK2/STAT3在脑缺血再灌注后损伤中扮演何种角色,调节其表达是否能够减轻脑损伤仍未明确。本研究通过建立大鼠脑缺血再灌注模型,观察P-JAK2、P-STAT3表达水平与细胞凋亡、神经功能缺损的相关性,探讨JAK2/STAT3信号传导通路在脑缺血再灌注损伤中的作用,为研究有效的治疗措施提供线索和依据。
1 材料与方法
1.1 主要试剂和抗体 兔抗鼠P-JAK2(pTyr1007/1008)多克隆抗体、兔抗鼠P-STAT3(pTyr705)多克隆抗体购于CST公司,Tunel凋亡试剂盒购自Roche公司,AG490(P-JAK2抑制剂)以及蛋白酶K 购自Sigma公司,SABC 免疫组化染色试剂盒购自武汉博士德生物工程有限公司,DAB 显色试剂盒购自碧云天公司,其余为国产分析纯。
1.2 脑缺血再灌注模型建立 72 只健康成年雄性SD 大鼠,由广西医科大学动物实验中心提供,体质量(300±20)g,标准饲料喂养,自由饮水,适应性喂养一周后随机将分为假手术组、模型组与AG490组。模型组与AG490组参照改良Longa法[2]建 立 大 脑 中 动 脉 闭 塞(middle cerebral artery occlusion,MCAO)再灌注模型。假手术组只分离动脉但不插线。苏醒后根据Longa’s的5级标准评分法进行神经功能评分:0分:正常,未见任何神经功能缺损表现;1分:垂直提起时前爪不能伸直;2分:行走时身体向右倾,向右侧旋转;3分:行走时身体向右侧跌倒;4分:不能自发行走或有意识障碍。选取1~3分的动物则进行实验。
1.3 取材与处理 分别取6h、24h、3d、7d时间点大鼠,10%水合氯醛(3.5mL/100g)腹腔注射麻醉后,心脏灌注生理盐水以及4%多聚甲醛,灌注完毕迅速断头取脑,将脑组织放于4%甲醛溶液中固定保存,以作石蜡切片,用于免疫组化检测和细胞凋亡检测。
1.4 免疫组织化学法检测P-JAK2、P-STAT3的表达 采用SABC 法,步骤简述如下:(1)常规切片脱蜡至水,3%H2O2室温封闭;(2)将切片浸入0.01M 枸橼酸盐缓冲液中,微波炉加热至沸腾,循环2~3次,间隔5~10min;(3)山羊血清封闭液;(4)分别滴加一抗,其中P-JAK2(1:500)、PSTAT3(1:350)于4℃冰箱过夜。此外,用PBS取代一抗作空白对照;(5)加二抗室温孵育20min;(6)滴加试剂链霉素亲和素-生物素符合物(SABC,1:100),室温孵育2h。以上各步骤均需0.02M PBS漂洗;(7)DAB染色,苏木素轻度复染,进行脱水、透明、封片、观察。
1.5 TUNEL 法检测神经细胞凋亡 严格按照说明进行操作。步骤如下:(1)二甲苯浸洗2 次后用梯度乙醇各浸洗1次;(2)Proteinase K 工 作 液 处 理 组 织20 min;(3)加50μL TUNEL反应混合液(阴性对照组仅加50μL 荧光素标记的dUTP液)于标本上,加盖玻片或封口膜在暗湿盒中反应37℃×1h;(4)加1滴PBS在荧光显微镜下计数凋亡细胞;(5)玻片干后加50μL converter-POD于标本上,加盖玻片或封口膜在暗湿盒中反应37℃×30 min;(6)DAB 染色,苏木素复染,进行脱水、透明、封片、光镜观察。
1.6 统计学方法 应用SPSS 17.0统计软件进行统计学处理,计量资料用±s描述,多组间比较采用单因素方差分析(One-Way ANOVA),P<0.05差异有统计学意义。
2 结果
2.1 神经功能缺损情况 各组大鼠神经功能缺损情况见表1所示,各时间点AG490组均轻于模型组。

表1 3组大鼠再灌注后各时间点神经功能缺损评分情况 (n=6)
2.2 免疫组织化学染色 假手术组各个时间点各时间点梗死区均可偶见P-JAK2、P-STAT3阳性表达,模型组自再灌注6h后即可观察到明显的P-JAK2阳性细胞,24h开始明显增高,3d达到高峰,以后逐渐下降,至7d 仍有表达。而抑制剂组6h时可观察到较少量的P-JAK2阳性细胞,3d出现高峰随后开始下降,7d 时只见少量阳性细胞。而PSTAT3则于24h达到高峰后开始下降(见表2、表3,图1)。

表2 3组大鼠再灌注后各时间点梗死区(纹状体)P-JAK2表达情况 (n=6)

表3 3组大鼠再灌注后各时间点梗死区(纹状体)P-STAT3表达情况 (n=6)
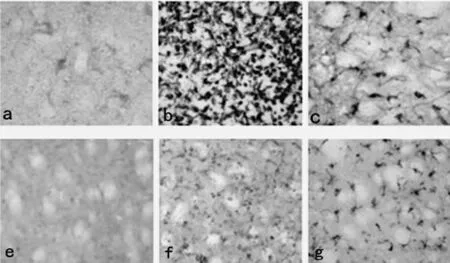
图1 72h时间点P-JAK2表达情况以及24h 时间点P-STAT3
2.3 神经细胞凋亡情况 假手术组偶见凋亡细胞,模型组与抑制剂组随着缺血再灌注时间的延长凋亡细胞逐渐增加,并于24h 阳性细胞数达高峰,随之逐渐下降,抑制剂组各时间点细胞凋亡数量均较模型组少,差异具有统计学意义,P<0.05。

表4 3组大鼠各时间点细胞凋亡情况
3 讨论
Sehindle C于1992年在一项有关干扰素的研究中发现了JAK/STAT 信号转导通路。JAK 属于非受体型的酪氨酸蛋白激酶,目前已发现JAK1~3 和TYK2 四个成员,而STAT 属于胞浆蛋白家族,由STAT1~4、STAT5a、STAT5b和STAT6组成。JAK/STAT 信号传导通路参与了细胞的增殖、分化、凋亡等多个生理病理过程,是重要的细胞因子信号转导的途径[3]。已有的研究提示JAK 和STAT 参与了中枢神经系统的发育及病理过程[4]。在脑缺血再灌注损伤的形成中,白细胞介素1、白细胞介素6、肿瘤坏死因子等炎性细胞因子大量的释放发挥了重要作用[5]。而这些细胞因子则必需通过各种受体超家族的信号转导才能发挥效应,JAK/STAT 信号传导通路则是其中一条重要路径。JAK2、STAT3作为该通路的家族成员之一,以往对其在脑缺血再灌注损伤中作用的研究结果并不一致[6],可能与不同研究的实验动物及方法学方面的差异有关。本研究结果显示JAK2、STAT3 在脑缺血再灌注后发生激活,表现为PJAK2、P-STAT3的高表达,并和神经功能缺损、神经细胞凋亡存在密切相关性。而使用JAK2特异性抑制剂AG490后,P-JAK2、P-STAT3的表达发生下调,大鼠神经细胞凋亡减少,同时神经功能缺损情况减轻,提示JAK2、STAT3的激活在脑缺血再灌注损伤中起到了破坏作用。
JAK/STAT 信号传导通路的激活不仅通过损伤神经元及各种炎症病理过程参与脑缺血再灌注的后续损伤,同时对星型胶质细胞的增殖分化产生影响,使其成为活化的星形胶质细胞,严重影响了脑卒中后的神经功能恢复[7]。本研究结果显示脑缺血再灌注后6h即可观察到P-JAK 和P-STAT免疫染色阳性细胞,并分别于24h和72h到表达高峰,并持续到7d时仍有表达,使用JAK2特异性抑制剂的大鼠在各个时间点神经细胞凋亡及神经功能缺损均轻于模型组。但P-JAK 和P-STAT 在不同大脑区域,不同细胞以及不同时间等的表达情况尚缺乏系统研究。虽然P-JAK 和P-STAT 脑缺血再灌注损伤中的机制还未完全明确,但其在脑缺再灌注损伤后表达的变化为治疗提供了新的靶点。通过应用特异性抑制剂、激动剂以及结合临床有效的干预措施进行动物实验研究将有助于进一步阐明P-JAK2和P-STAT3的作用,为研发新的缺血性脑卒中治疗措施提供实验依据。
[1]Bright JJ,Kanakasabai S,Chearwae W,et al.PPAR Regula-tion of Inflammatory Signaling in CNS Diseases[J].PPAR Res,2008,2008:658-660.
[2]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84-91.
[3]Jason S,Rawlings,Kristin M.The JAK/STAT signaling pathway[J].Cell Science,2004,117:1 281-1 283.
[4]Stephanou A,Scarabelli TM,Brar BK,et a1.Induction of Apoptosis and Fas Receptor/Fas Ligand Expression by Ischemia/Reperfusion in Cardiac Myocytes Requires Serine 727of the STAT-1 Transcription Factor but Not Tyrosine[J].J Bid Chem,2007,276:28 340-28 341.
[5]Stroll G,Jander S,Schroeter M.Detrimental and beneficial effects of injury induced infl-ammation and cytokine expression in t h e nervous system[J].Adv ExpMed Bio,2002,513:87-113.
[6]Satriotomo I,Bowen KK,Vemuganti R.JAK2and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia[J].J Neurochem,2006,98(5):1 353-1 368.
[7]Leung M,Pankhyurst SA,Dunlop,et al.Metallohione in induces a regenerative reactive astrocyte phenotype via JAKSTAT at RHOA signaling pathways[J].Experimental Neurology,2010,221:98-106.

