旱莲草凝血和溶血活性成分的研究
陈 锐,许 群,陈 昱,李汉全,杨建远,过七根,张炳火
九江学院生命科学学院,九江 332000
旱莲草是一年生草本植物,为双子叶植物菊科鲤肠属鲤肠(E.alba)的俗称,是一种重要的药用植物[1-3],具有促使毛发生长[4]、降低血脂、防止动脉粥样硬化[5]、止血和治疗炎症[6-9]、滋补肝肾等功效,为历版《中国药典》收载的药材。旱莲草最早用于止血[6],常用来治疗阴虚血热、吐血、血衄、尿血、血痢、崩漏下血及外伤出血等出血性病症,是民间外伤伤口止血最常用的中草药之一。我们研究发现,旱莲草不但含有多种凝血物质,还含有许多溶血物质。为更好开发丰富的旱莲草资源,本文以活性跟踪为指导,对其凝血和溶血活性成分进行了研究,分离到6个化合物,其中3个化合物有很强的溶血活性,2个化合物有很强的凝血活性,1个化合物首次从该植物中分离获得。
1 材料与仪器
质谱用VG Auto Spec-3000 型质谱仪测定;核磁共振用Bruker AV.DRX500 测定;薄层层析硅胶板和柱层析硅胶(200~300 目)均为青岛海洋化工厂产品;大孔吸附树脂为罗门哈斯(上海)Amberlite XAD16N;柱层析用凝胶 Sephadex LH-20 (GE Healthcare)。分离试剂均为工业重蒸试剂。
本研究所用旱莲草(E.alba)为2012 年9 月采自江西省九江市郊区,由九江学院生命科学学院廖亮教授鉴定。
2 实验方法
2.1 提取与分离
将干燥的旱莲草粉碎,并用甲醇∶乙酸乙酯∶丙酮∶去离子水=1∶1∶1∶1 的混合溶剂浸泡24 h 后过滤,收集滤液,按照该方法处理3 次,合并滤液,减压蒸馏除去滤液中的有机溶剂,得到膏状物。在膏状物中加入大量去离子水,并加热至50 ℃使样品尽可能溶解,将样品溶液加入再生好的大孔吸附树脂Amberlite XAD16N 中进行吸附,吸附后先用3 倍柱体积的去离子水洗脱,再用甲醇洗脱,收集甲醇洗脱组分。利用硅胶柱色谱和凝胶柱色谱反复分离甲醇洗脱组分,得到6个化合物。在整个分离纯化过程中,采用玻片溶血或凝血实验跟踪活性。
2.2 溶血活性实验
用真空采血器(内有抗凝剂)进行人体静脉采血,血液用0.9%的生理盐水稀释50 倍备用。用移液器定量取样品溶液涂于洁净的载玻片上,待溶剂挥发后用移液器取适量稀释血液于待检样品上,置于显微镜下观察,如果血细胞逐渐破裂则说明样品有溶血活性。
2.3 凝血活性实验
将采集的新鲜血液在10 ℃、2000 rpm 的条件下离心5 min,将血浆和血细胞分别收集,用等渗生理盐水洗涤血细胞6 次,每次生理盐水用量为血液体积的5 倍,再用50 倍血液体积的生理盐水重悬红细胞备用。用移液器定量取样品溶液涂于洁净的载玻片上,待溶剂挥发后用移液器分别取适量稀释血液、血细胞生理盐水重悬液和血浆于待检样品上,置于显微镜下观察。
3 实验结果
3.1 化合物结构鉴定
化合物1 无色针晶(甲醇),紫外线254 nm 下有暗斑,365 nm 下无吸收,碘蒸汽显黄色,anis 显色剂(大茴香醛显色剂)显紫红色。质谱ESI(+)-MS m/z:819[M+Na]+显示相对分子质量为796。13C NMR(pyridine-d5)和DEPT 显示有7个甲基C 信号,化学位移分别为:15.8、17.2、17.7、24.7、27.4、28.4 和33.3,11个亚甲基C 信号,化学位移分别为:18.7、23.9、26.7、32.3、33.6、36.1、36.2、39.0、47.3、62.3 和63.1,16个次甲基C 信号,化学位移分别为:41.4、47.3、56.0、71.2、71.9、74.2、74.5、75.8、78.3、78.8、79.0、79.4、89.0、95.9、106.9 和122.8,8个季C 信号,化学位移分别为:30.9、37.1、39.6、40.2、42.2、49.2、144.6 和176.0,以上数据和文献报道一致[10],推断该化合物eclalbasaponin I。
化合物2 白色粉末,紫外线254 nm 下有暗斑,365 nm 下无吸收,碘蒸汽显黄色,anis 显色剂显紫红色。质谱ESI(+)-MS m/z:819[M+Na]+显示相对分子质量为796。13C NMR(pyridine-d5)和DEPT 显示有7个甲基C 信号,化学位移分别为:15.7、16.9、17.6、24.8、27.3、28.3 和33.5,11个亚甲基C 信号,化学位移分别为:18.6、23.9、26.7、32.9、33.6、36.2、36.3、38.9、47.4、62.7 和62.8,16个次甲基C 信号,化学位移分别为:41.5、47.2、56.0、71.7、71.7、74.8、77.1、77.9、78.0、78.3、78.4、83.4、89.1、105.1、106.0 和122.4,8个季C信号,化学位移分别为:31.1、37.1、39.6、40.0、42.2、48.9、145.2 和180.1,以上数据与文献报道一致[10],推断化合物2 为eclalbasaponin IV。
化合物3 白色粉末,紫外线254 nm 下有暗斑,365 nm 下无吸收,碘蒸汽显黄色,anis 显色剂显紫红色。质谱ESI(-)-MS m/z:713[M-H]-显示相对分子质量为714。13C NMR(DMSO)和DEPT 显示有7个甲基C 信号,化学位移分别为:15.4、16.5、17.3、24.7、26.6、27.7 和33.0,10个亚甲基C 信号,化学位移分别为:18.0、23.0、25.6、31.1、32.7、34.8、35.4、34.8、46.4 和61.2,11个次甲基C 信号,化学位移分别为:40.5、46.4、55.2、70.2、73.3、76.3、76.6、79.4、88.7、102.9 和120.9,8个季C 信号,化学位移分别为:30.4、36.4、38.3、38.8、41.2、47.7、144.6 和180.6。以上数据与文献报道一致[10],因此推断该化合物为eclalbasaponin V。
化合物4 白色粉末,紫外线254 nm 下有暗斑,365 nm 下无吸收,碘蒸汽显黄色,anis 显色剂显黄色。质谱ESI(-)-MS m/z:555[M -H]-显示相对分子质量为556。13C NMR(DMSO)和DEPT 显示有1个甲基C 信号,化学位移为14.0,12个亚甲基C信号,化学位移分别为:22.2、24.5、28.6、28.8、28.9、29.0、29.2、31.4、33.5、54.4、65.5 和69.2,6个次甲基C 信号,化学位移分别为:67.3、68.5、72.1、73.4、74.3 和98.9,1个羰基C 信号,化学位移为173.0。1H NMR(DMSO)δ:0.82(3H),1.20(24H),1.47(2H),2.26(2H),2.49(1H),2.57(1H),2.88 (1H),2.99 (1H),3.15 (1H),3.25(1H),3.36 (1H),3.71 (1H),3.84 (1H),3.89(1H),3.91 (1H),3.99 (1H),4.55 (1H),4.62(1H),4.81(1H),5.12(1H),5.29(1H)。HSQC 显示,1.20(24H)分属于7个C 原子δC22.2、δC28.6、δC28.8、δC28.9、δC29.0、δC29.2和δC31.4,结合13C NMR 和COSY 相关信号发现,δC29.2有6个C 信号重合,因此,该化合物有17个CH2,以上数据与文献报道基本一致[11],因此,推断该化合物为3,4,5-trihydroxy-6-(2-hydroxy-3-(palmitoyloxy)propoxy)-tetrahydro-2H-pyran-yl)methanesulfonic acid。
化合物5 墨绿色粉末,紫外线254 nm 下有暗斑,365 nm 有荧光,碘蒸汽显黄色,anis 显色剂显绿色。13C NMR(DMSO-d6)和DEPT 显示有1个甲氧基C 信号,化学位移为55.8,4个次甲基C 信号,化学位移分别为:93.1、98.3、99.0 和104.6,11个季C信号,化学位移分别为:96.9、101.7、113.8、144.4、145.5、148.9、154.3、155.4、157.9、159.1 和162.4。1H NMR(DMSO-d6)δ:3.78(s,3H),6.49(s,1H),6.42(s,1H),7.14(s,1H),7.22(s,1H)。以上数据和文献报道一致[12],因此,推断化合物5 为蟛蜞菊内酯。
化合物6 墨绿色粉末,紫外线254 nm 下有暗斑,365 nm 有荧光,碘蒸汽显黄色,anis 显色剂显绿色。13C NMR(DMSO-d6)和DEPT 显示有4个次甲基C 信号,化学位移分别为:99.0、99.2、104.6 和161.3,11个季C 信号,化学位移分别为:94.9、95.5、100.9、113.9、144.3、145.3、148.8、155.4、155.5、158.1 和159.6。1H NMR(DMSO-d6)δ:6.37(s,1H),6.35(s,1H),7.14(s,1H),7.20(s,1H),9.92(br,1H)。以上数据和文献报道一致[12],因此,推断化合物6 为异去甲蟛蜞菊内酯。
3.2 溶血和凝血活性的结果
3.2.1 溶血活性
溶血活性检测结果显示,化合物2、3、4 均有很强的体外溶血活性,且呈剂量效应(图1),当样品浓度为0.6 μg/mL 时,与不加样品的对照组相比,它们对红细胞的溶解率分别达到(93.52 ±1.56)%、(82.55 ±2.72)%和(94.99 ±0.68)%,化合物1、2和3 都属于齐墩果烷型五环三萜皂甙,但是化合物1 却没有溶血活性,化合物2 和3 在0.1~0.4 μg/mL 时溶血活性差异不显著,但浓度在0.5~0.6 μg/mL 时却有极显著差异(P<0.01),这说明这些化合物中的葡萄糖残基的数量和位置可能对溶血活性有很大影响。
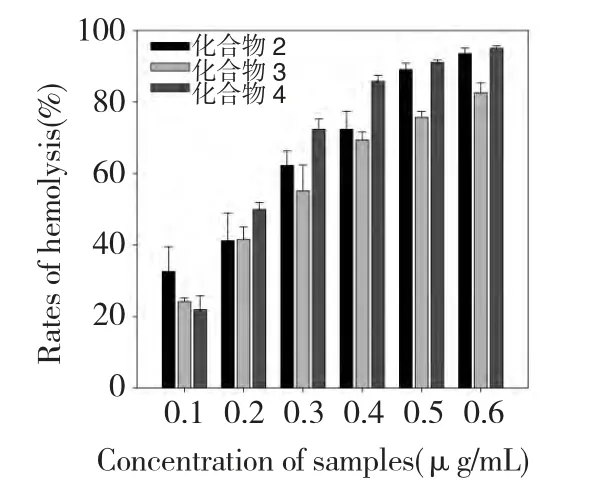
图1 化合物2、3 和4 对红细胞的溶血效果Fig.1 The rates of hemolysis induced by compounds 2,3 and 4
3.2.2 凝血活性及机理
结果显示,化合物5 和6 既能使全血中的红细胞凝聚成团,又能使充分除去血浆的红细胞凝聚成团,还能使血浆出现网状结构(图2),这说明它们既能直接凝聚红细胞又能导致纤维蛋白原转变为纤维蛋白,再由纤维蛋白凝聚红细胞。
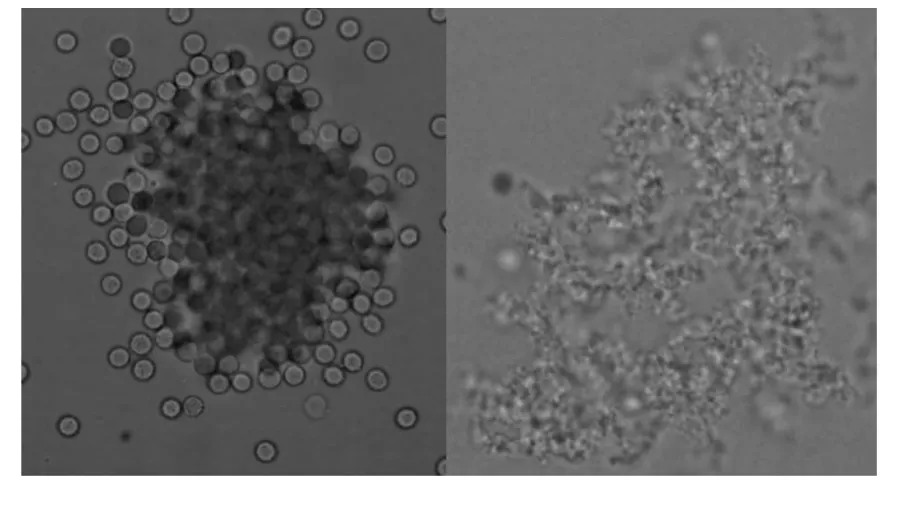
图2 化合物5 和6 对红细胞和纤维蛋白原的影响Fig.2 The influence of compounds 5 and 6 on red blood cell and fibrinogen
4 讨论
旱莲草的凝血或止血活性受到国内外的关注,但多数研究只涉及各种提取方法所得的粗提物,而很少涉及具体的单体化合物。蟛蜞菊内酯和去甲蟛蜞菊内酯是旱莲草中含有的两个凝血化合物,它们最早分离自金丝桃属(HypericumHerba)[13]。本文发现异去甲蟛蜞菊内酯也具有很强的凝血活性,这三个化合物均为香豆草醚类,因此,旱莲草中的香豆草醚类化合物是其凝血活性物质之一,这些成分可直接和间接凝聚红细胞。
文献尚未见旱莲草溶血活性的报道,我们研究发现旱莲草中含有大量溶血物质,它们既可使游离的血细胞破裂,也可以使血凝块溶解,这些溶血物质主要是三萜皂苷类化合物,研究结果显示,与这类化合物母体结构相连的其他化学基团的数量和位置,可能对其溶血活性有重要影响。这些溶血活性成分与旱莲草的功能有何关系?由于能够溶解血细胞和血凝块,血细胞的破裂会导致其中的抗菌物质和其他凝血因子迅速释放,从而促进止血,抑制炎症,因此,推测这些溶血化合物与旱莲草的止血消炎功效应该有着重要联系。
1 Baskaran P,Jayabalan N.An efficient micropropagation system for Ecliptaalba—A valuable medicinal herb.In Vitro Cell Dev-Pl,2005,41:532-539.
2 Dhaka N,Kothari SL.Micropropagation of Ecliptaalba (L.)hassk—An important medicinal plant.In vitro Cell Dev-Pl,2005,41:658-661.
3 Singh SK,Manoj K,Rai MK,et al.An improved and efficient micropropagation of Ecliptaalbathrough transverse thin cell layer culture and assessment of clonal fidelity using RAPD analysis.Ind Crop Prod,2012,37:328-333.
4 Roy RK.Thakur M,Dixit VK.Hair growth promoting activity of Ecliptaalba in male albino rats.Arch Dermatol Res,2008,300:357-364.
5 Kim DI,Lee SH,Choi JH,et al.The butanol fraction of Ecliptaprostrata (Linn)effectively reduces serum lipid levels and improves antioxidant activities in CD rats.Nut Res,2008,28:550-554.
6 Wang J(王建),Bai XZ(白秀珍),Yang XD(杨学东).The study of effect of Eclipta prostrate on blooding in stomach.J Math Med(数理医药学杂志),2005,18:375-376.
7 Chen JJ(陈建济),Shi DJ(施东捷),Li KH(李克华),et al.Effect ofEcliptaprostrata on inflammation and hemorrhage induced by the snake venom.J Snake(蛇志),2005,17(2):65-68.
8 Liu SW(刘世旺),Xu YX(徐艳霞),Xu XL(徐霞玲),et al.Primary discussion on the hemostatic activity of aqueous extracts from the leaves of Ecliptaprostrata L.J Anhui Agric Sci(安徽农业科学),2008,36:13673-13674.
9 Pithayanukul P,Laovachirasuwan S,Bavovada R,et al.Antivenom potential of butanolic extract of Ecliptaprostrata against Malayan pit viper venom.J Ethnopharmacol,2004,90:347-352.
10 Yahara S,Ding N,Nohara T.Oleananeglycosides from Ecliptaalba.Chem Pharm Bull,1994,42:1336-1338.
11 Kitagawa I,Hamamoto Y,Kobayashi M.Sulfonoglycolipid from the sea urchin Anthocidariscrassispina A.Agassiz.Chem Pharm Bull,1979,27:1934-1937.
12 Zhang JS(张金生),Guo QM(郭倩明).Study on the chemical constituents of Ecliptaalba(L).Acta Pharm Sin(药学学报),2001,36:34-37.
13 Kosuge T,Ishida H,Satoh T.Studies on antihemorrhagic substances in herbs classified as hemostatics in Chinese medicine.Ⅳ.On antihemorrhagic principles in Hypericumerectum Thunb.Chem Pharm Bull,1985,33:202-205.

