魔芋葡甘聚糖降解产物对肌原纤维蛋白的冷冻保护作用
王 俊, 汪 兰, 程 薇, 王 钰, 吴文锦, 付晓燕,王少华, 张金木, 熊光权,*
(1.湖北省农业科学院农产品加工与核农技术研究所/湖北省农业科技创新中心农产品加工研究分中心,湖北武汉 430064;2.华中农业大学食品科技学院,湖北武汉 430070)
魔芋葡甘聚糖降解产物对肌原纤维蛋白的冷冻保护作用
王 俊1, 汪 兰1, 程 薇1, 王 钰2, 吴文锦1, 付晓燕2,王少华1, 张金木1, 熊光权1,*
(1.湖北省农业科学院农产品加工与核农技术研究所/
湖北省农业科技创新中心农产品加工研究分中心,湖北武汉 430064;
2.华中农业大学食品科技学院,湖北武汉 430070)
采用酸降解、β-葡聚糖酶水解、纤维素酶水解、辐照降解、微波辅助H2O25种方式降解魔芋葡甘聚糖.以草鱼肌原纤维蛋白为研究对象,比较了不同魔芋葡甘聚糖降解产物对冻藏过程中肌原纤维蛋白的冷冻保护效果,并对不同降解产物的冰点进行测定.实验结果表明:魔芋葡甘聚糖降解产物能有效地抑制草鱼肌原纤维蛋白在冻藏过程中的蛋白质变性,其中β-葡聚糖酶水解、纤维素酶水解和辐照降解的魔芋葡甘聚糖添加量为0.5%,抗冻效果略优于商用抗冻剂.同时,魔芋葡甘聚糖降解产物作为冷冻保护剂能降低水分子的冰点和融化热焓值.
魔芋葡甘聚糖;肌原纤维蛋白;降解产物;抗冻剂
鱼糜制品的开发是淡水鱼加工方面的重要课题.鱼糜制品水分含量高,肌肉组织细嫩,易腐败变质,如果不能及时加工处理,在微生物和酶的作用下,鱼糜内蛋白质、氨基酸等分解,对产品质量产生极为不利的影响[1],淡水鱼糜的加工通常是在高温季节捕获鱼类后,采肉处理并迅速冻藏.在冷冻鱼糜的加工和冻藏过程中,水分子的运动状态改变、冰晶的生长[2]、溶质的浓缩会促进鱼肉蛋白质聚集,超分子作用增强.在鱼糜制作过程中,常添加蔗糖和山梨糖醇作为冷冻保护剂,但这种做法致使产品甜味较重和热量高,影响了产品的口味和再加工性能,并限制如糖尿病、肥胖等部分消费群体[3].已有关于替代小分子冷冻保护剂的研究,包括乳酸钠[4]、蛋白水解物[5]以及明胶、丝胶酶解肽[6-7]等,而多糖也是有效替代品之一。目前研究较多的多糖保护剂有海藻糖[8]、麦芽糖[9]、壳聚糖[10]、木寡糖[11]、聚葡萄糖[12]等,多糖的添加量(1% ~6%)显著低于蔗糖和山梨糖醇,并能有效抑制蛋白的冷冻变性.
魔芋葡甘聚糖是葡萄糖和甘露糖以糖苷键相连形成的高分子聚合物,具有很强的吸水性、凝胶性、稳定性、乳化性、增稠性和成膜性,可制作各种食品添加剂.肌原纤维蛋白是冷冻鱼糜的主要成分,其聚集变性会影响冷冻鱼糜的品质进而影响其后续加工性能.本研究以草鱼的肌原纤维蛋白作为研究对象,采用魔芋葡甘聚糖降解产物替代传统的鱼糜抗冻剂,解决传统抗冻剂热量高甜味重的缺点.分别采用辐照降解、酸降解、纤维素酶降解、β-葡聚糖酶降解、微波辅助H2O2法对魔芋胶进行降解,并比较其降解产物应用于草鱼肌原纤维蛋白后抗冻性能的差异,旨在提供一种较优的鱼糜抗冻剂的制备方法.
1 材料和方法
1.1 实验材料
魔芋葡甘聚糖(konjac glucomannan,KGM),湖北强森魔芋科技有限公司,其他试剂均为分析纯.
1.2 仪器设备
钴60γ射线辐照装置,湖北省农科院农产品加工与核农技术研究所;PL602-L型电子天平、AL104型电子天平,梅特勒-托利多仪器(上海)有限公司; HH-6型数显恒温水浴锅、JJ-1型精密增力电动搅拌器,国华电器有限公司;IKA型均质机,广州市东南科创科技有限公司;DHG-9078A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;pH-5A型酸度计,梅特勒-托利多(上海)仪器有限公司;3802型紫外-可见分光光度计,尤尼克(上海)仪器有限公司;DSC差示扫描量热仪,德国耐驰仪器公司;GL -21M型高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;G80W23MSL-C2(SO)型格兰仕微波炉,广东格兰仕集团有限公司.
1.3 实验方法
1.3.1 魔芋葡苷聚糖降解产物的制备
1.3.1.1 辐照降解方法
称取5 g魔芋粉,以1∶60的固液比(g/mL)为将魔芋精粉溶解在蒸馏水中,静态常温下分别以辐照剂量为5,10,15,20,25,30 kGy对魔芋葡苷聚糖进行辐照降解,干燥后粉碎备用[13].
1.3.1.2 酸降解方法
称取5 g的魔芋粉,以固液比(g/m L)为1∶60加入2mol/L的盐酸溶液,于60℃水浴锅中加热,缓慢搅拌使其均匀对魔芋葡苷聚糖分散在盐酸溶液中,降解时间分别为60,90,120,150min,降解结束后用1 mol/L的NaOH溶液进行中和,干燥后粉碎备用. 1.3.1.3 β-葡聚糖酶降解方法
称取5 g的魔芋粉,以固液比(g/mL)为1∶60加入pH值为5.5的稀盐酸溶液,于50℃的水浴锅中加热,并向其中加入0.03 g的β-葡聚糖酶.缓慢搅拌使其均匀分散在溶液中,降解时间分别为60,80, 100,120min,降解结束后用1 mol/L的NaOH溶液进行中和,干燥后粉碎备用[14].
1.3.1.4 纤维素酶降解方法
称取5 g的魔芋粉,以固液比(g/m L)为1∶60加入pH值为5.0的稀盐酸溶液,于45℃的水浴锅中加热,并向其加入0.03 g的纤维素酶.缓慢搅拌使其均匀分散在溶液中,降解时间分别为60,80,100, 120,140min,降解结束后用1 mol/L的NaOH溶液进行中和,干燥后粉碎备用[15].
1.3.1.5 微波辅助H2O2降解方法
称取5 g的魔芋粉,以固液比(g/mL)1∶60加入pH值为4.0的稀盐酸溶液(混入10 mL的H2O2溶液),缓慢搅拌使其均匀分散在溶液中,在780W的格兰仕微波炉中微波降解,降解时间分别为6,7,8, 9 min,降解结束后用1 mol/L的NaOH溶液进行中和,干燥后粉碎备用[16].
1.3.2 肌原纤维蛋白的制备
取160 g草鱼肉,加入10倍体积经过预冷过的20 mmol Tris-马来酸缓冲液(50 mmol KC1-20 mmol Tris-马来酸,经0.5mol/L的NaOH中和),用搅拌机匀浆,低温离心(9 000 r/min,10min,4℃),取出后弃去上清液,按此方法重复洗涤2次.沉淀与20 mmol Tris-马来酸缓冲液(0.6mol KC1-20mmol Tris-马来酸,经0.5 mol/L的NaOH中和)用搅拌机匀浆,放入冰箱于4℃提取60 min,取出后低温离心(9 000 r/min,30min,4℃),所得上清液为实验用肌原纤维蛋白溶液[17].分别在草鱼肌原纤维蛋白中添加魔芋葡甘聚糖的降解产物,魔芋葡甘聚糖降解产物的添加量为0.5%,而商用抗冻剂(4%蔗糖+ 4%山梨糖醇)的添加量为8%.
1.3.3 盐溶性蛋白的测定
采用考马斯亮蓝G250法[18].
1.3.4 抗冻剂冰点的测定
采用差示扫描量热法测定,在标准液体铝坩埚中准确称取10~30mg的样品,密封,设置扫描程序为:初温20℃以5℃/min降温至-60℃,恒温5 min,再1℃/min升温至10℃,恒温5min[19].
2 结果与分析
2.1 魔芋葡甘聚糖辐照降解产物对肌原纤维蛋白的冷冻保护作用
分析魔芋葡甘聚糖降解产物与草鱼肌原纤维蛋白盐溶性蛋白含量关系,结果见图1.由图1可看出,随着辐照剂量的增大,草鱼肌原纤维蛋白中的盐溶性蛋白含量呈上升趋势.以5 kGy的剂量辐照所得到的降解产物作为抗冻剂,盐溶性蛋白的溶出量为4.08mg/g,为原来的42.9%;辐照剂量为20 kGy 时,盐溶性蛋白质量比达 5.27 mg/g,为原来的55.3%,比5 kGy高出12.4%.而在辐照剂量为20 kGy后,上升趋势开始逐渐减缓.实验结果表明,5种辐照剂量下的样品都具有一定的抗冻效果,其中辐照剂量为20 kGy时样品的抗冻性已经达到了较好的效果,选用该剂量样品为后续研究样品.
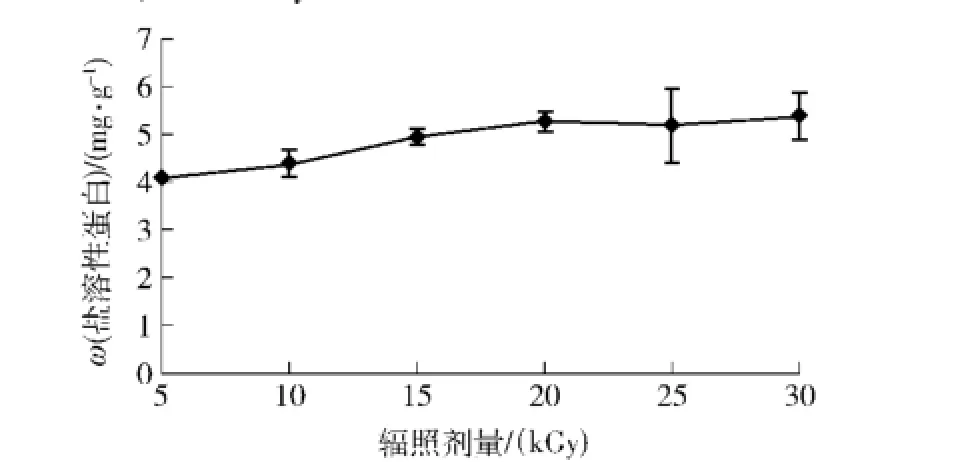
图1 不同辐照剂量魔芋葡甘聚糖降解产物对盐溶性蛋白含量的影响Fig.1 Effect of KGM degradation at different irradiation dose on content of salt soluble protein
2.2 魔芋葡甘聚糖盐酸降解产物对肌原纤维蛋白的冷冻保护作用
分析魔芋葡甘聚糖盐酸降解产物与肌原纤维蛋白中盐溶性蛋白含量的关系,结果见图2.由图2可看出,随着降解时间的增长,草鱼肌原纤维蛋白中的盐溶性蛋白含量均呈上升趋势,在2 h时趋于平稳. 以1 h所得到的降解产物作为抗冻剂,盐溶性蛋白的溶出量为2.50 mg/g,为原来的26.2%;降解2 h 时,盐溶性蛋白质量比到达高峰值3.92 mg/g,为原来的41.2%.比1 h时高出15%.实验结果表明,盐酸降解样品具有一定的抗冻效果,其中降解时间为2 h样品的抗冻性已经达到了较好的效果,选用该样品为后续研究样品.

图2 不同酸处理时间魔芋葡甘聚糖降解产物对盐溶性蛋白含量的影响Fig.2 Effect of KGM degradation at differentacid hydrolysis time on content of salt soluble protein
2.3 魔芋葡甘聚糖β-葡聚糖酶降解产物对肌原纤维蛋白的冷冻保护作用
魔芋葡甘聚糖β-葡聚糖酶降解产物与肌原纤维蛋白中盐溶性含量的关系见图3.由图3可看出,随着β-葡聚糖酶降解时间的增长,草鱼肌原纤维蛋白中的盐溶性蛋白含量均呈上升趋势,但整体的趋势较为平缓.以降解60min所得的β-葡聚糖酶降解产物作为抗冻剂,盐溶性蛋白的溶出量为4.29 mg/g,为原来的45.1%;在降解100min时盐溶性蛋白质量比到达一个高峰为5.25 mg/g,为原来的55.1%,比60min高出10%.而降解时间在100min后趋势开始逐渐变得平滑.酶解降解时间为100 min,样品的抗冻性已经达到较好的效果,选择该样品为后续研究样品.

图3 不同β-葡聚糖酶处理时间魔芋葡甘聚糖降解产物对盐溶性蛋白含量的影响Fig.3 Effect of KGM degradation at differentβ-glucanase hydrolysis time on content of salt soluble protein
2.4 魔芋葡甘聚糖纤维素酶降解产物对肌原纤维蛋白的冷冻保护作用
对魔芋葡甘聚糖纤维素酶降解产物与肌原纤维蛋白中盐溶性蛋白含量关系进行分析,结果见图4.由图4可看出,随着纤维素酶降解时间的增大,草鱼肌原纤维蛋白中的盐溶性蛋白含量均呈线性上升趋势,以降解60min所得的纤维素酶降解产物作为抗冻剂,盐溶性蛋白的溶出量为2.26 mg/g,为原来的23.7%;在降解140 min时盐溶性质量比到达最高峰为5.30 mg/g,为原来的55.7%,比降解60 min时高出32%.降解时间为140 min样品的抗冻性最佳,选用效果最好的样品为后续研究样品.
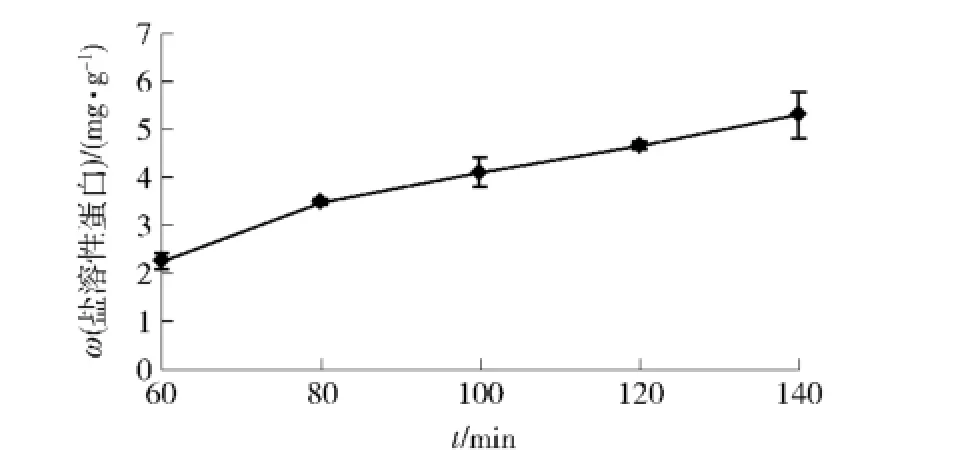
图4 不同纤维素酶处理时间魔芋葡甘聚糖降解产物对盐溶性蛋白含量的影响Fig.4 Effect of KGM degradation at different cellulase hydrolysis time on content of salt soluble protein
2.5 魔芋葡甘聚糖微波辅助H 2O2降解产物对肌原纤维蛋白的冷冻保护作用
魔芋葡甘聚糖微波辅助H2O2降解产物与肌原纤维蛋白中盐溶性蛋白关系见图5.由图5可看出,随着微波降解时间的增大,草鱼肌原纤维蛋白中的盐溶性蛋白含量呈上升趋势,以降解6 min所得的微波辅助降解产物作为抗冻剂,盐溶性蛋白的溶出量为220mg/g,为原来的23.1%;在降解9min时盐溶性质量比到达最高峰值3.37 mg/g,为原来的35.3%,比6 min时高出12.2%.微波辅助降解时间为9 min,样品的抗冻性最佳,选用该样品为后续研究样品.

图5 微波辅助H2 O2处理不同时间魔芋葡甘聚糖降解产物对盐溶性蛋白含量的影响Fig.5 Effect of KGM degradation at differentmicrowave assisted H2 O2 treatment time on content of salt soluble protein
2.6 魔芋葡甘聚糖不同降解产物的盐溶性蛋白含量比较
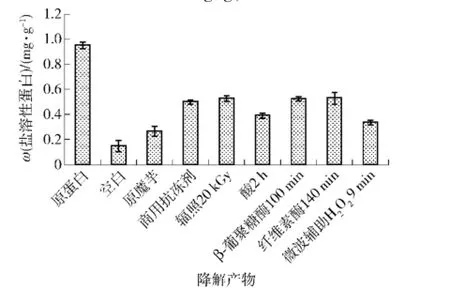
图6 魔芋葡甘聚糖的不同降解产物的盐溶性蛋白含量的对比Fig.6 Comparision of different KGM degradations on content of salt soluble protein
对魔芋葡甘聚糖不同降解产物盐溶性蛋白含量进行对比,结果见图6.由图6可知,冻藏一周之后,草鱼肌原纤维蛋白的含量都有不同程度的降低.空白组的盐溶性蛋白的质量比为1.51mg/g,比原肌原纤维蛋白含量减少了84.1%.加入了抗冻剂的几组样品的盐溶性蛋白的含量比没加抗冻剂的要略高,但以不同方法得到的降解产物作为抗冻剂,其抗冻性能有所不同,作为对照的0.5%的原魔芋作为抗冻剂所测得的盐溶性蛋白质量比为2.68mg/g,比原肌原纤维蛋白含量减少了71.8%,抗冻效果并不佳.采用市面上的商用抗冻剂,所测得的盐溶性蛋白的质量比为5.00 mg/g,为原肌原纤维蛋白的52.5%.在5种方法降解的产物中,辐照剂量为20 kGy、β-葡聚糖酶降解100 min以及纤维素酶降解140min得到的降解产物作为抗冻剂的效果较好,测得样品中的肌原纤维蛋白质量比为 5.27,5.25, 5.30 mg/g,分别是原来的55.4%,55.1%,55.6%,与市面上的商用抗冻剂的抗冻效果相当.纤维素酶降解140min所得的降解产物的抗冻性能最好,但是纤维素酶价格较高;辐照剂量为20 kGy,所得的降解产物不仅添加量为0.5%,远小于商用抗冻剂的8%,热量释放较小,实用经济,操作简便,而且抗冻效果与纤维素酶降解140 min相当,是一种较好的抗冻剂的选择.
2.7 不同抗冻剂的冰点测定
不同抗冻剂冰点测定结果见表1.由表1可知,纯水的熔融温区为-0.7~6.0℃,0.6mol缓冲液的熔融温区为-2.1~4.1℃,原魔芋葡甘聚糖的熔融温区为-0.7~5.6℃.商用抗冻剂(蔗糖和山梨糖醇的混合物)、辐照20 kGy降解、酸降解2 h、β-葡聚糖酶降解100min、纤维素酶降解140min、微波辅助H2O2降解9 min熔融温区分别为-6.3~0.2℃, -0.6~4.8℃,-1.2~4.3℃,-0.8~5.1℃, -0.8~5.9℃,-0.8~4.5℃.5种降解产物的冰点温度分别为3.8,3.0,3.5,4.0,3.7℃,均低于蒸馏水的冰点温度,其中商用抗冻剂的冰点最低为-0.8.由表中的热焓值可以看出,蒸馏水略低于纯水的热焓值(343.8 J/g),可能是其中蒸馏水中仍含有少量杂质,干扰水分子冰晶体的形成.1%原魔芋葡甘聚糖的水溶液热焓值略高于蒸馏水的热焓值,可能是由于魔芋葡甘聚糖是大分子物质,与水分子形成凝胶结构,其中的水分子大部分是截留水,也与水在食品加工中表现的特性几乎与纯水相似,但其流动性受到限制,在水-冰转变的过程中需要更多的能量,从而使熔融热焓略高于蒸馏水;蔗糖和山梨糖醇混合物的热焓值小于蒸馏水的热焓值,可能是由于蔗糖和山梨糖醇属于小分子糖类,它们可以与水分子产生氢键,氢键键合的部位和去向在几何构型上与纯水分子之间不同,这样的溶质在水分子结晶时,会破坏了水分子的有序排列,使冰晶体的结构不稳定,降低其熔融所需的能量.5种降解产物的热焓值也有一定的差异,可能是由于不同方法的降解程度不同.在这些样品中可能既存在着降解程度较低的大分子物质,也存在着降解程度比较高的小分子物质.产物中的大分子、小分子同时与水分子发生作用,同时产生着大分子中的截留水和小分子-水分子形成氢键两种作用效应,破坏水分子的有序结构,在这两种相反方向力的作用下,这5种样品的热焓值处于原魔芋葡甘聚糖及蔗糖和山梨糖醇混合物热焓值之间.
冰点值的降低可以说明,魔芋葡甘聚糖的降解产物中的极性基团与水分子之间不同程度、不同方向的作用都会干扰水分形成规律的晶体,破坏水分子的正常结冰,最终导致水的凝固点下降.在超低温保护作用时,与低分子量糖类的溶液排除机理不同,高分子量的多糖可以固定水分子或形成玻璃态结构使蛋白质更加稳定[20].降解产物热焓值的差异可以说明,它们对于这种干扰作用所需能量的大小不同,其中商用抗冻剂抗冻作用所需的能量最小. 在5种降解产物中,辐照20 kGy、酸降解2 h、β-葡聚糖酶降解100min所需的能量较小,其中酸降解2 h的样品所消耗能量最小,但是由图6可以看出,酸降解2 h的抗冻效果并不如辐照20 kGy和β-葡聚糖酶降解100 min的抗冻效果好.辐照20 kGy与β-葡聚糖酶降解100 min所耗能量相当,但前者抗冻性要略高于后者,操作简便,是一种较好的降解方法.

表1 不同魔芋葡甘聚糖降解产物熔融相变热特性参数Tab.1 Melting transition parameters of different KGM degradations
3 结 论
鱼肉蛋白质在冻藏过程中会发生两种变性,一是蛋白质分子的聚集,二是蛋白质多肽链的展开[21].在冻藏中,肌原纤维蛋白分子间由于氢键、疏水键、二硫键、盐键的形成而聚集变性,因而其盐溶性下降.通过测定草鱼肌原纤维蛋白的盐溶性蛋白的含量和魔芋葡甘聚糖的降解产物的冰点,表明魔芋葡甘聚糖的降解产物能有效地抑制草鱼肌原纤维蛋白在冻藏过程中的蛋白质变性,提高鱼糜制品的品质.采用DSC测定不同降解产物的冰点,从冰点值的降低可以说明,魔芋葡甘聚糖的降解产物中的极性基团与水分子之间不同程度、不同方向的作用都会干扰水分子形成规律的晶体,破坏水分子的正常结冰,最终导致水的凝固点下降,说明魔芋葡甘聚糖降解产物对肌原纤维蛋白有冷冻保护作用.β-葡聚糖酶水解、纤维素酶水解和辐照降解的魔芋葡甘聚糖作为抗冻剂的添加量为0.5%,远小于添加量为8%商用抗冻剂(4%蔗糖+4%山梨糖醇),且抗冻效果与商用抗冻剂相当.此外,魔芋葡甘聚糖降解产物作为冷冻保护剂能降低水分子的冰点和融化热焓值.辐照降解法比酶降解法操作简单,且前者抗冻性要略高于后者,是一种较好的降解方法.将魔芋葡甘聚糖的降解物作为新的抗冻剂应用到淡水鱼类加工、冷冻鱼糜及其鱼糜制品加工中具有非常广阔的应用前景.
[1] 唐裕芳.鱼肉的腐败机理及其防腐措施[J].肉类工业,2000,25(2):30-32.
[2] Michael S.Ice crystal growth in skeletal muscle fibres [J].Journal of Microscopy,1975,105(1):67-80.
[3] 潘锦锋,罗永康.鲢鱼鱼糜在冻藏过程中理化特性的变化[J].肉类研究,2008,6(9):45-49.
[4] 刘欣,周爱梅,赵力超,等.海藻糖、乳酸钠对冻藏鳙鱼鱼糜蛋白抗冻效果的影响[J].食品与发酵工业,2007 (8):60-64.
[5] Zhang Yanan,Zhao Li,Liu Hua,et al.Effect of eel head protein hydrolysates on the denaturation ofgrass carp surimi during frozen storage[J].Procedia Engineering, 2012,37:223-228.
[6] Phanat K,Soottawat B,Wonnop V,et al.Cryoprotective effect of gelatin hydrolysate from blacktip shark skin on surimi subjected to different freeze-thaw cycles[J].Food Science and Technology,2012,47(2):437-442.
[7] Wu Jinhong,Wang Shaoyun,Wu Yan,etal.Cryoprotective effect of sericin enzymatic peptides on the freeze-induced denaturation of grass carp surimi[J].Applied Mechanics and Materials,2011,140:291-295.
[8] Pan Jinfeng,Shen Huixiong,Luo Yongkang.Cryprotective effects of trehalose on grass carp(cteopharyngodon idellus)surimi during frozen storage[J].Journal of Food Processing and Preservation,2010,34(4):715-727.
[9] Kovacevic D JJ,Mastanjevic K JJ.Cryoprotective effect of trehalose and maltose on washed and frozen stored beef meat[J].Czech Journal of Food Sciences-UZEI,2011, 29(1):15-23.
[10] Satya SD,Krushna C D.Suitability of chitosan as cryoprotectant on croaker fish(Johniusgangeticus)surimi during frozen storage[J].Journal of Food Science and Technology,2011,48(6):699-705.
[11] Chou Yite,Lin Kuowei.Effects of xylooligosaccharides and sugars on the functionality of porcine myofibrillar proteins during heating and frozen storage[J].Food Chemistry,2010,121(1):127-131.
[12] Liu Anjun,Yin Shi,Zheng Jie,et al.Cryoprotective effects of polydextrose in bighead carp surimi during frozen storage[J].Modern Food Science and Technology, 2011,27(10):1179-1181.
[13] 徐振林,杨幼慧,孙远明,等.辐照魔芋葡甘露聚糖的应用研究[J].中国食品学报,2008,8(1):78-82.
[14] 李剑芳,邬敏辰,程科.β-葡聚糖酶制备魔芋葡甘露低聚糖的研究[J].食品与发酵工业,2007,33(1):21-23.
[15] 高金,罗丹,刘凯.纤维素酶降解魔芋葡甘聚糖的条件[J].内江师范学院学报,2010,25(8):48-50.
[16] 黄永春,谢清若,何仁,等.微波辅助H2O2降解魔芋葡甘聚糖的研究[J].食品科学,2005,26(8):197-199.
[17] Xiong Guangquan,ChengWei,Ye Lixiu,et al.Effects of konjac glucomannan on physicochem ical properties of myofibrillar protein and surimi gels from grass carp[J]. Food Chemistry,2009,116:413-418.
[18] 李志江.考马斯亮蓝G250染色法测定啤酒中蛋白质含量[J].酿酒,2008,35(1):70-71.
[19] 鲁长新,赵思明,熊善柏.鲢鱼肉相变区间的热特性研究[J].农业工程学报,2007,23(6):39-41.
[20] Patricio A C,Grant A M,Tyre C L.Cryostabilization mechanism of fish muscle proteins bymaltodextrins[J]. Cryobiology,1999,38(1):16-26.
[21] Xia Xiufang,Kong Baohua,Xiong Youling,et al.Decreased gelling and emulsifying properties ofmyofibrillar protein from repeatedly frozen-thawed porcine longissimusmuscle are due to proteindenaturation and susceptibility to aggregation[J].Meat Science,2010,85(3): 481-486.
The cryoprotective effectof degraded konjac glucomannan(KGM)on the grass carpmyofibrillar was studied and five degradation methods including acid hydrolysis,enzymatic hydrolysis(dextranase,cellulase),γ-irradiation hydrolysis,and microwave assisted hydrolysis with hydrogen peroxide were used.The cryoprotective effects of KGM with different degradation products were compared and freezing pointswere alsomeasured.The results showed that the degradation products of KGM had a cryoprotective effect on the grass carp myofibrillar during the frozen storage.When the amount of degraded KGM(enzymatic hydrolysis,γ-irradiation hydrolysis)was 0.5%,the cryoprotective effect was better than thatof commercial cryoprotector.The degraded KGM could decrease the freezing pointand enthalpy ofwater as a new cryoprotector.
Cryoprotective Effect of Degraded Konjac G lucomannan on Grass Carp M yofibrillar
WANG Jun1, WANG Lan1, CHENGWei1, WANG Yu2, WUWenjing1, FU Xiaoyan2, WANG Shaohua1, ZHANG Jinmu1, XIONG Guangquan1,*
(1.Institute ofAgricultural Products Processing and Nuclear-agricultural Technology, Hubei Academy of Agricultural Sciences/Farm Products Processing Research Sub-center ofHubei Innovation Center ofAgriculture Science and Technology, Wuhan 430064,China;
2.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
konjac glucomannan;myofibrillar protein;degradation products;cryoprotector
叶红波)
TS202;S984.1
A
10.3969/j.issn.2095-6002.2014.05.004
2095-6002(2014)05-0015-06
王俊,汪兰,程薇,等.魔芋葡甘聚糖降解产物对肌原纤维蛋白的冷冻保护作用.食品科学技术学报,2014,32(5): 15-20. WANG Jun,WANG Lan,CHENGWei,et al.Cryoprotective effect of degraded konjac glucomannan on grass carp myofibrillar.Journal of Food Science and Technology,2014,32(5):15-20.
2013-12-19
国家科技支撑计划项目(2012BAD28B06).
王 俊,女,助理研究员,主要从事水产品加工及副产物综合利用方面的研究;*熊光权,男,研究员,主要从事水产品加工及副产物综合利用方面的研究.通讯作者.

