虹鳟肠道植物乳杆菌的分离及特性研究
刘 敏,张 英,张琳琳,蒋 烨,崔 文,姜艳萍,乔薪瑗,唐丽杰,李一经
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.东北农业大学动物医学学院,哈尔滨 150030)
虹鳟肠道植物乳杆菌的分离及特性研究
刘 敏1,张 英1,张琳琳1,蒋 烨1,崔 文2,姜艳萍2,乔薪瑗2,唐丽杰2,李一经2
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.东北农业大学动物医学学院,哈尔滨 150030)
为筛选一株乳杆菌用于鱼类口服疫苗的活载体,研究从健康养殖的虹鳟肠道分离出58株形态特征不同的菌株,通过革兰氏染色、氧化酶、触酶反应筛选出18株革兰氏阳性杆菌,再通过生化反应筛选出5株表型不同的菌株。经16S rRNA序列同源性分析,5株均为植物乳杆菌。在8%NaCl,0.5%胆盐,pH 3.0,7 g·L-1胰蛋白酶,10 g·L-1胃蛋白酶,60℃处理10 min时,几乎不影响菌体存活。5株菌对多种抗生素敏感,对革兰氏阳性及阴性细菌均有抑菌活性。通过荧光分子探针cFDA-SE标记细菌,分离株L1212在15 d的检测期内能在虹鳟肠粘膜定植,并有继续繁殖倾向。因此,植物乳杆菌L1212可作为益生菌应用于虹鳟口服疫苗载体及鱼类饲料添加剂开发。
植物乳杆菌;药物敏感性;抑菌活性;体内定植力;虹鳟
Key words:Lactobacillus plantarum;antibiotic susceptibility;antimicrobial activity;colonization; rainbow trout
乳酸杆菌是一类革兰氏阳性、不运动、无芽孢、发酵产生乳酸、过氧化氢酶阴性的细菌。通常存在于哺乳动物胃肠道[1],奶制品和海鲜[2],以及某些植物表面。除极少数乳酸菌外,大部分乳酸菌都是益生菌。益生菌可通过改善宿主肠道菌群、促进生长等影响宿主的健康状况。来源于哺乳动物乳酸杆菌已被广泛研究和应用,但是鱼源肠道乳酸杆菌的研究报道很少。乳酸菌在鸟类及哺乳动物的肠道内属于优势菌群,而鱼体内的乳酸菌则处于略势[3]。链球菌属(Streptococcus)、明串珠菌属(Leuconostoc)、乳酸杆菌属(Lactobacillus)及肉杆菌属(Carnobacterium)是健康鱼胃肠道内正常菌群,特别是肉杆菌在北极红点鲑(Salvelinus alpinus)、大西洋鲑(Salmo salar)、虹鳟(Oncorhynchus mykiss)及褐鳟(Salmo trutta)肠道内容物中均有存在,此外,从河流以及池塘养殖的鱼肠道内也发现不同种类乳酸杆菌存在[4]。
近年来,由于抗生素的滥用导致细菌耐药性产生,许多学者提倡用益生菌来替代抗生素[5],使用益生菌还可激发机体的非特异性免疫功能[6]。能够在生产中应用的益生菌可耐受各种环境胁迫,具有较强的抗逆性。选择来自宿主自身且能够定植于肠道内菌株具有更大优势[7-9]。本研究首次从健康养殖的虹鳟肠道分离乳酸菌,进行形态、生化反应及分子鉴定,通过耐受性、药物敏感性、抑菌活性及体内定植试验,筛选出能够应用于水产养殖生产中的鱼源乳酸菌。
1 材料与方法
1.1 材料
1.1.1 菌种
植物乳杆菌KLDS1.0344由东北农业大学乳品科学教育部重点实验室惠赠;大肠杆菌(Colibacillus)、金黄色葡萄球菌(Staphylococcus aureus)、李斯特菌(Listeria)、巴氏杆菌(Pasteurella)、鼠伤寒沙门氏菌(Salmonella typhimurium)、停乳链球菌(Streptococcus dysgalactiae)、海豚链球菌(Streptococcus iniae)、迟缓爱德华氏菌(Edwardsiella tarda)、嗜水气单胞菌(Aeromonas hydrophila)由东北农业大学兽医微生物与免疫实验室保存。
1.1.2 实验动物
36周龄健康虹鳟幼鱼(平均体重30.58± 4.516 g)购自中国水产科学院黑龙江省水产研究所渤海试验站。
1.1.3 引物
根据已发表的乳酸杆菌基因组16S rRNA基因序列合成引物,27F(5′AGAGTTTGATCCTGGCTCA G 3′)及1495R(5′CTACGGCTACCTTGTTACGA 3′)引物由哈尔滨博仕生物有限公司合成。
1.2 方法
1.2.1 虹鳟鱼肠道乳酸菌的分离
健康的虹鳟幼鱼,于(16±1)℃水族箱中饲养。麻醉处死后,用70%乙醇擦洗体表,刮去体表粘液。无菌条件下分离肠道,将肠道用灭菌PBS冲洗3次,去除肠内容物,纵向切开肠道,用1 mL灭菌PBS洗去残余粪便,将肠道剪碎后加入1 mL PBS匀浆,12 000 r·min-1离心5 min。吸取上层液体加入乳酸杆菌选择性培养基MRS中(9 mL MRS肉汤加入1 mL上清液),37℃静置培养。观察菌液浑浊后,10倍倍比稀释,每一个稀释度的菌液涂布MRS琼脂平板,37℃厌氧培养。
挑取单菌落做革兰氏染色,选择革兰氏阳性、不运动、无芽孢、杆状细菌,进一步进行过氧化氢酶、氧化酶和硝酸盐还原活性实验,均为阴性者初步判定视为乳酸杆菌。将得到的菌株纯化,直到镜下观察菌体形态大小单一、无杂菌,用60%(V/V)甘油保存于-80℃。
1.2.2 乳酸杆菌的鉴定
分离菌株进行生化反应的表型鉴定,鉴定结果与《伯杰细菌分类手册》[10]作比照后归类。用细菌基因组提取试剂盒提取菌株DNA,以乳酸杆菌属16S rRNA通用引物27F、1495R扩增目的片段。用DNA回收试剂盒纯化回收。测定序列后用DNAMAN对序列进行分析,并通过Blastn对种属进行鉴定(http://www.ncbi.nlm.nih.gov)。
1.2.3 压力耐受性试验
取接种过夜的菌液,用生理盐水调至107~108cfu·mL-1;将菌液分别接种于各压力条件,37℃培养5 h;5 h后,各菌液以PBS进行10倍系列倍比稀释,分别取100 μL涂布MRS营养琼脂平板,37℃24~36 h后菌落计数。压力条件包括:pH 2.0、3.0、4.0及对照5.6;NaCl浓度2、4、6 to 8%(W/V);牛胆盐从0、0.1、0.2、0.3、0.4到0.5%(W/V),胰蛋白酶0、1、3、5、7 g·L-1,胃蛋白酶0、4、6、8 到10 g·L-1。此外,温度耐受性是将菌液接种至MRS肉汤后,分别置于37、60、80、100℃培养10 min,被比稀释后做菌落计数。
1.2.4 抑菌活性试验
采用打孔法对筛选的5株乳杆菌进行9种病原菌(致病性大肠杆菌、金黄色葡萄球菌、李氏杆菌、巴氏杆菌、鼠伤寒沙门氏菌及4株鱼源致病菌停乳链球菌、海豚链球菌、鮰爱德华氏菌、嗜水气单胞菌)的抑菌活性测试试验。分离菌株于MRS肉汤中37℃培养24 h,指示菌株于LB肉汤中培养12~16 h。指示菌菌液用LB液体调整OD600至1.0;将调好OD600的指示菌菌液涂布LB营养琼脂平板,100 μL·板-1;待干后,打孔器打孔,4孔·板-1;每孔分别加入分离株菌悬液,37℃静置向上培养,16~24 h后用游标卡尺(0.02 mm精度)测量抑菌圈直径,以肉眼看不到菌落生长为边界,记录结果。
1.2.5 药物敏感性试验
用微生物药敏纸片(6 mm)测试筛选的5株乳杆菌对8大类24种抗生素的药物敏感性。当抑菌圈直径大于相应抗生素的临界点时,认为对该种抗生素敏感。取培养过夜的菌液,测其OD600,菌液12 000 r·min-1离心5 min;用灭菌生理盐水重悬菌体,12 000 r·min-1离心3 min;重复上述步骤;用灭菌生理盐水调节菌体OD600值在0.08至0.1之间;取350 uL调节好浓度的菌液涂布MRS琼脂平板;待干后(约需15 min),贴放标准药敏纸片,4片·板-1;37℃倒置培养,18~24 h后测量抑菌圈直径。
1.2.6 定植试验
5′,6′-羧基二乙酸琥珀酰亚胺酯(cFDA-SE)工作液的配制:按cFDA-SE试剂说明书,将1管A物质(cFDA-SE)中加入90 μL B物质(DMSO),制备成10 mmol·L-1的储存液;用灭菌PBS稀释成50 umol·L-1的工作液(1 μL 10 mmol·L-1储存液加199 μL无菌PBS)。
虹鳟肠道乳杆菌的标记[11]:筛选的乳杆菌菌株L1026、L1212及植物乳杆菌KLDS1.0344(作对照)分别接种MRS肉汤,37℃静置,厌氧培养至OD600=1.0;菌体培养物4 000 r·min-1离心10 min,无菌PBS洗两次;菌体沉淀按1∶1的比例加入50 umol·L-1的cFDA-SE和无菌PBS缓冲液,调整菌体浓度为1010cfu·mL-1,37℃水浴作用25 min;4 000 r·min-1离心10 min,无菌PBS缓冲液洗2次,去除未标记上的cFDA-SE荧光标记物,用无菌PBS悬浮菌体,加入0.75%甲醛溶液固定,通过流式细胞仪检测带有cFDA-SE标记的阳性菌的比例。
动物试验:平均体重30 g的虹鳟分成3组,15 尾·组-1,饲养于循环水族箱,水温(16±1)℃;每尾虹鳟口服灌喂浓度为1010cfu·mL-1的cFDA-SE标记的乳杆菌L1026、L1212及KLDS1.0344(对照)。
在灌喂后1、2、4、6、10及15 d后,每组取3尾处死。在无菌条件下,分别取前、中、后肠,纵向切开,除去肠道食物和粪便残渣,以1 cm肠段加150 uL无菌PBS的比例反复冲洗肠道,收集洗液;加0.75%甲醛溶液固定;通过流式细胞仪检测洗液中带有cFDA-SE标记的阳性菌比例。
2 结果与分析
2.1 虹鳟肠道乳酸菌鉴定结果
从健康养殖的虹鳟肠道共分离出58株形态特征不同的菌株,通过革兰氏染色、氧化酶、触酶反应筛选出18株革兰氏阳性杆菌。对18株菌测定生化反应(见表1),筛选出5株表型不同的菌株,进行16S rRNA序列同源性分析。经DNAMAN分析,5株菌序列同源性>99%;Blastn比对,5株菌均与已公布的植物乳杆菌序列同源性100%。将序列上传GenBank,菌株L1026、L1129-1、L1129-2、L1212及G-2的序列登录号分别为:KF583521,KF583522,KF583523,KF583524及KF583525。
2.2 压力耐受性试验结果
在8%NaCl、0.5%牛胆盐、pH 3.0,7 g·L-1胰蛋白酶,10 g·L-1胃蛋白酶,以及60℃处理10 min时,仍有106~107菌落存活(见图1)。但是所有菌株在80或100℃处理10 min后均不能存活。
2.3 抑菌试验结果
所筛选的5株鱼源乳杆菌对9种致病菌的抑菌圈直径在11~25 mm之间(见表2)。5株菌对大肠杆菌、金黄色葡萄球菌、李斯特菌、巴氏杆菌、停乳链球菌表现出较强的抑制活性,抑菌圈直径>16 mm。
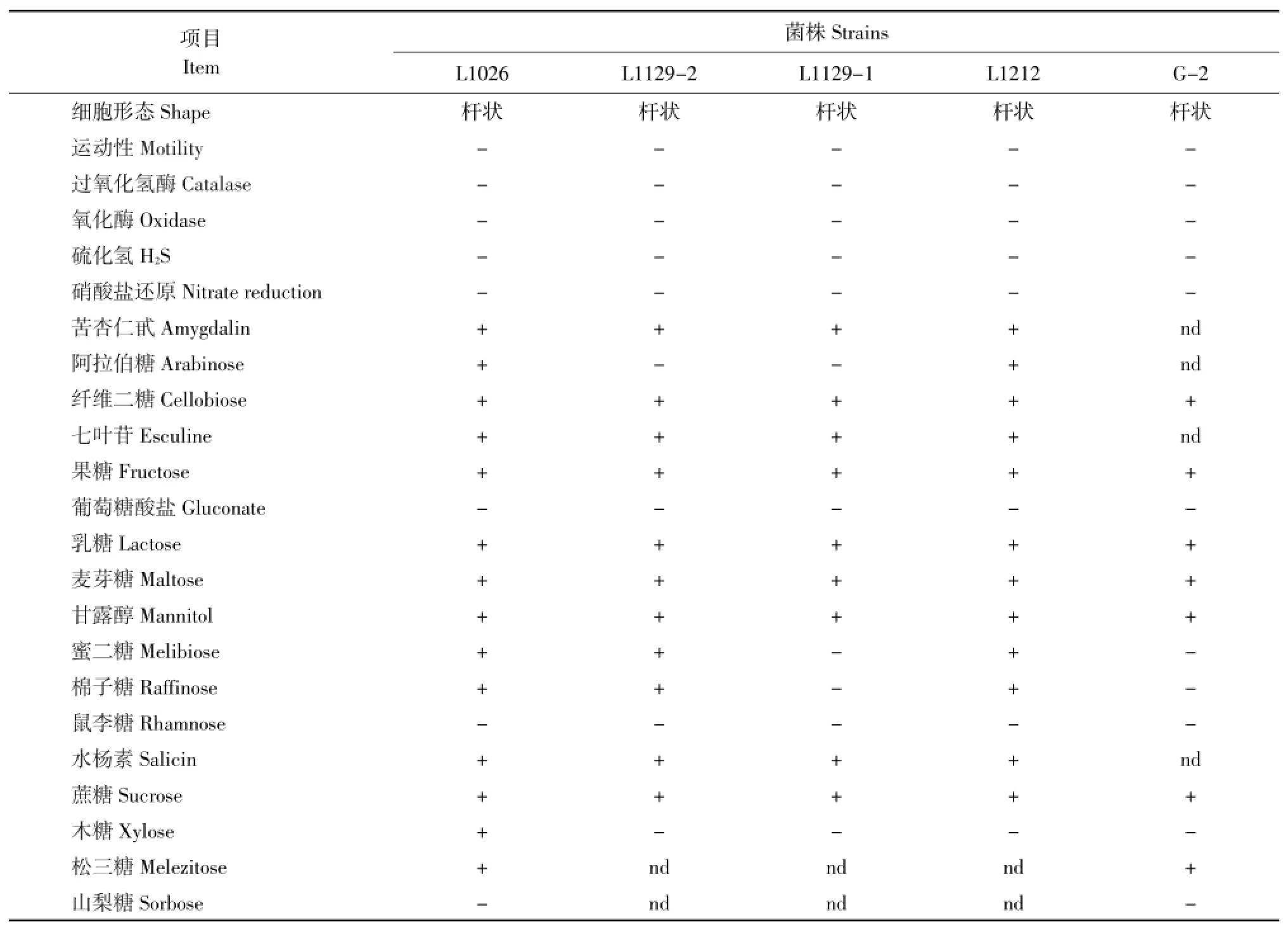
表1 虹鳟肠道分离菌生化反应结果Table 1 Biochemical characteristics of Lactobacillus species isolated from the intestines of rainbow trout

图1 植物乳杆菌在各指标中处理5 h后活菌数Table 1 Survival curves of the Lactobacillus plantarumin after treatment 5h

表2 抑菌试验结果Table 2 Antibiotic activity of the isolates against pathogenic bacteria
2.4 药物敏感性试验结果
5株菌表现出广泛的抗生素敏感性(见表3)。L1026,L1129-1,L1129-2,L1212以及G-2对呋喃妥因(Nitrofurantoin)、麦迪霉素(Midecamycin)、头孢哌酮(Cefoperazone)、红霉素(Erythrocin),氯霉素(Chloromycetin)、头孢他定(Ceftazidime)、头孢克洛(Cefaclor)、阿莫西林(Amoxicillin)敏感,L1212和G-2对强力霉素(Doxycycline)、米诺环素(Minocycline)、头孢噻吩(Cefalotin)、和四环素(Tetracycline)也敏感。5株菌对万古霉素(Vancomycin),链霉素(Streptomycin)、庆大霉素(Gentamicin)、新霉素(Neomycin)、替考拉宁(Teicoplanin)、卡那霉素(Kanamycin)、氨苄青霉素(Ampicillin)、苯唑西林(Oxacillin)不敏感。

表3 药敏试验结果Table 3 Antibiotic sensitivity of the isolates
2.5 定植试验结果
虹鳟体内定植结果见图2。
由图2可知,统计各组每天前、中、后肠存留荧光标记菌的平均数。1~4 d,所有组残留的荧光标记菌数量均呈现下降。分离株L1026的前、中、后肠的荧光标记菌平均数于第6天稍微有所上升,第10天再次下跌,随后的第15天又增加;L1212的各部位平均荧光菌数从6~15 d逐渐上升;对照组灌喂植物乳杆菌KLDS1.0344的荧光菌数在15 d内持续下降。
3 讨论与结论
在野生和人工饲养的淡水鱼肠道中均有乳酸菌存在[12]。本研究从养殖的虹鳟肠道内分离乳酸菌,通过表型特征鉴定,筛选乳酸杆菌,根据糖发酵反应的不同从所有分离到的菌株中筛选出5株。由于乳酸杆菌属内,部分种之间的糖发酵反应仅存在细微差异,这种差异有时不明显,因此需进一步进行鉴定[13]。基于16S rRNA序列分析表明5株菌均为植物乳杆菌。植物乳杆菌具有优良的益生菌特性[14],分离出植物乳杆菌的报道已有很多,但从虹鳟肠道内分离出植物乳杆菌尚属首次报道。
能否耐受一系列的环境压力,是一株菌能否被用作益生菌的重要参考指标[15]。本研究中分离筛选的5株植物乳杆菌进入体内后,能够顺利通过胃肠道环境。但是5株菌80℃处理10 min全部死亡,表明分离株不能耐受工业中饲料加工的温度压力,因此,分离的菌株不能直接参与饲料成型过程。
乳酸菌可以作为一种很好的抗生素替代品防治疾病的发生。本试验筛选的5株候选益生菌对万古霉素不敏感,对红霉素表现高度敏感,这与之前许多学者对植物乳杆菌的药敏性报道一致[11,16]。部分菌株表现出对多种抗生素的耐药性,耐药性产生机制有待进一步研究。从绿青鳕体内分离到的植物乳杆菌生长于苏云金芽孢杆菌培养滤液中时,能够产生一种物质抑制弧菌的生长[17]。David等将非致病性益生菌饲喂感染嗜冷黄杆菌的虹鳟[18],结果试验组与对照组相比死亡率明显降低(P<0.05)。5株选定菌株具有广泛的抑菌活性,不仅能够抑制革兰氏阳性菌(金黄色葡萄球菌、李斯特菌、停乳链球菌、链球菌病链球菌),而且对革兰氏阴性菌(大肠杆菌、巴氏杆菌、鼠伤寒沙门菌、爱德华氏菌、嗜水气单胞菌)也有较好抑制作用。如能定植于鱼消化道中有利于维持肠道正常菌群平衡,改善宿主健康状况。
粘附是定植的第一步,乳酸菌在哺乳动物胃肠道内的粘附表现出宿主特异性。在啮齿类动物肠道中分离出的乳酸菌不能够粘附在鸡的消化道上,从鸡的消化道中分离出的乳酸菌也不能粘附啮齿类动物的消化道上皮细胞。抑制病原菌在肠道粘膜的粘附、定植可能是益生菌引起非特异性免疫调节的机制。此外,两种细菌物质之间对粘膜表面受体的竞争取决于细菌浓度以及细菌与受体间的亲和力[9]。虹鳟口服分离到植物乳杆菌L1026及L1212后能够定植肠粘膜,且L1212有继续繁殖的倾向;而对照组则呈现直线下降趋势。
本研究分离到的虹鳟肠道植物乳杆菌L1212有优良的益生菌特性,可作为微生物制剂在水产养殖上广泛应用。
[1]Adimpong D B,Nielsen D S,Sørensen K I,et al.Genotypic characterization and safety assessment of lactic acid bacteria from indigenous African fermented food products[J].BMC Microbiology,2012,12(1)∶75.
[2]Ghanbari M,Jami M,Domig K J,et al.Seafood biopreservation by lactic acid bacteria-a review[J].LWT-Food Science and Technology,2013,54(2)∶315-324.
[3]Muñoz-Atienza E,Gómez-Sala B,Araújo C,et al.Antimicrobial activity,antibiotic susceptibility and virulence factors of Lactic Acid Bacteria of aquatic origin intended for use as probiotics in aquaculture[J].BMC microbiology,2013,13(1)∶15.
[4]Pandiyan P,Balaraman D,Thirunavukkarasu R,et al.Probiotics in aquaculture[J].Drug Invention Today,2013,5(1)∶55-59.
[5]Pan J,Li L,Liu L Y.Application of probiotics in Aquaculture[J]. Animal Husbandry and Feed Science,2012,4∶44.
[6]王劲松,陈志峰,马志刚,等.益生菌制剂对仔鹅生长性能,血清免疫球蛋白及免疫器官指数的影响[J].东北农业大学学报, 2009,40(11)∶81-85.
[7]Ringø E,Løvmo L,Kristiansen M,et al.Lactic acid bacteria vs. pathogens in the gastrointestinal tract of fish∶a review[J]. Aquaculture Research,2010,41(4)∶451-467.
[8]Merrifield D L,Harper G M,Dimitroglou A,et al.Possible influence of probiotic adhesion to intestinal mucosa on the activity and morphology of rainbow trout(Oncorhynchus mykiss)enterocytes[J].Aquaculture research,2010,41(8)∶1268-1272.
[9]Rendueles O,Ferrières L,Frétaud M,et al.A new zebrafish model of oro-intestinal pathogen colonization reveals a key role for adhesion in protection by probiotic bacteria[J].PLoS pathogens, 2012,8(7)∶e1002815.
[10]Garrity G M,Winter S M,Sparles N B.Bergry′s manual of systematic Bacteriology[M].2ed.Berlin∶Springer-Verlag,2004.
[11]Lee Y,Ho P,Low C,et al.Permanent colonization by Lactobacillus casei is hindered by the low rate of cell division in mouse gut[J].Applied and environmental microbiology,2004,70(2)∶670-674.
[12]Rai A K.Isolation and characterization of potential lactic acid bacteria(LAB)from freshwater fish processing wastes for application in fermentative utilisation of fish processing waste[J].Brazilian Journal of Microbiology,2011,42(4)∶1516-1525.
[13]Rahkila R,Nieminen T,Johansson P,et al.Characterization and evaluation of the spoilage potential of Lactococcus piscium isolates from modified atmosphere packaged meat[J].International journal of food microbiology,2012,156(1)∶50-59.
[14]Lee H I,Kim M H,Kim K Y,et al.Screening and selection of stress resistant Lactobacillus spp.isolated from the marine oyster (Crassostrea gigas)[J].Anaerobe,2010,16(5)∶522-526.
[15]Mathur S,Singh R.Antibiotic resistance in food lactic acidbacteria-a review[J].International Journal of Food Microbiology, 2005,105(3)∶281-295.
[16]Vesterlund S,Paltta J,Karp M,et al.Measurement of bacterial adhesion-in vitro evaluation of different methods[J].Journal of Microbiological Methods,2005,60(2)∶225-233.
[17]Mergeay M,Monchy S,Vallaeys T,et al.Ralstonia metallidurans,
[18]Burbank D R,Shah D H,LaPatra S E,et al.Enhanced resistance to coldwater disease following feeding of probiotic bacterial strains to rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,2011,321 (3)∶185-190.
Isolation and characterization of indigenousLactobacillus plantarum from rainbow trout intestine
LIU Min1,ZHANG Ying1,ZHANG Linlin1,JIANG Ye1,CUI Wen2,JIANG Yanping2,QIAO Xinyuan2,TANG Lijie2,LI Yijing2(1.School of Animal Sciences and Technology,Northeast Agricultural University,Harbin 150030,China;2.School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
In order to select a suitable candidate probiotic for use as a live vaccine carrier,58 strains of bacteria with different characters were isolated from the intestine of rainbow trout.By Gram staining,oxidase,catalase reaction,18 Gram-positive bacilli were screened.Then by biochemical reactions,5 strains with different phenotype were carried 16S rRNA sequence analysis,and the results showed that all of the 5 strains wereLactobacillus plantarum.A series of tolerance test was carried out, neither 7 g·L-1trypsin,10 g·L-1pepsin,8%NaCl,0.5%bile,pH 3.0,nor exposure to 60℃for 10 min significantly reduced their survival rates.Five strains exhibited sensitivity to various antibiotics,and inhibited the growth of both Gram-positive and Gram-negative bacteria.The intestinal epithelium of rainbow trout was colonized by cFDA-SE-labeledL.plantarumL1212 at 15 days post-inoculation,and have a potential to continue reproduction.TheL.plantarumL1212 is a suitable candidate probiotic for use as a live vaccine carrier or feed additive for rainbow trout and other fishes.
S965.199
A
1005-9369(2014)12-0024-07
时间2014-12-29 9∶03∶05 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20141229.0903.009.html
刘敏,张英,张琳琳,等.虹鳟肠道植物乳杆菌的分离及特性研究[J].东北农业大学学报,2014,45(12):24-30.
Liu Min,Zhang Ying,Zhang Linlin,et al.Isolation and characterization of indigenousLactobacillus plantarumfrom rainbow trout intestine[J].Journal of Northeast Agricultural University,2014,45(12):24-30.(in Chinese with English abstract)
2014-04-08
国家自然科学基金(31372568);国家科技支撑计划(2012BAD25B02)
刘敏(1965-),女,教授,博士,研究方向为水产动物疾病及免疫学研究。E-mail∶liumin-707@163.com

