Cu2+对苦荞过敏蛋白TBt的结构和IgG结合能力的影响
杨 欢,崔晓东,李玉英,王转花*
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
Cu2+对苦荞过敏蛋白TBt的结构和IgG结合能力的影响
杨 欢,崔晓东,李玉英,王转花*
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
TBt是苦荞中的主要过敏蛋白,为了研究Cu2+对其结构及致敏性的影响,本实验采用荧光光谱法探讨Cu2+与TBt的相互作用;圆二色光谱及非变性聚丙烯酰胺凝胶电泳测定其结构变化;间接性酶联免疫和抑制性酶联免疫法鉴定C u2+对TBt的IgG结合能 力的影响。结果表明:Cu2+和TBt之间存在相互作用,二者以浓度比1∶1形成稳定的复合物;圆二色光谱分析表明,TBt的二 级结构并未发生明显的改变;但非变性聚丙烯酰胺凝胶电泳分析显示,Cu2+与TBt作用后,可促使TBt由三聚体进一步聚合形成六聚体。 同时抑制性酶联免疫和间接性 酶联免疫也表明,Cu2+与TBt作用形成六聚体后,由于抗原决定簇被部分遮挡,与IgG抗体结合能力降低。
苦荞麦;过敏蛋白;金属离子;致敏性
荞麦是我国重要的传统杂粮作物,具有较高的营养、药用及保健价值[1]。荞麦中富含矿物质、膳食纤维、蛋白质、维生素等生物活性物质,尤其是富含其他粮食作物没有的黄酮类化合物(芦丁和槲皮素),这些物质 能有效地预防糖尿病、高血压和冠心病等多种慢性疾病[2],近年来,受到科学家和消费者的普遍关注,有诸多荞麦功能食品问世,并被大众认可。然而,荞麦中也存在着一些致敏成分,部分人食用或接触荞麦产品会引起过敏症状,如哮喘、皮炎等,甚至可致人死亡[3-4]。研究发现荞麦中的致敏源主要包括9~12、16~19、22~24、35、 58 kD分子质量不等的几种蛋白质,其中24 kD过敏蛋白被认为是主要过敏原[5]。先前,本课题组以苦荞麦为材料,先后通过分离纯化和基因克隆等方法获得天然和重组24 kD(TBa)和34 kD(TBb)过敏蛋白,并对其结构及致敏性进行了较系统的研究[5-6],发现TBa和TBb可通过一对链间二硫键形成分子质量为56 kD(TBt)的过敏蛋白。进一步研究发现,TBt在天然状态下以三聚体的形成存在[7],经序列比对等结果表明TBt与普通荞麦中13S球蛋白[8-9]、苦杏仁中的11S球蛋白等具有较高的同源性[10],但后两者在天然状态下是以六聚体的形式存在,并且苦杏仁中11S球蛋白每个单体可结合一个Ca2+。有文献报道,荞麦中含有多种微量元素,其中,Cu是荞麦资源的特征微量元素[11],这些微量元素对功能蛋白质和酶的表达及活性可能起着重要的调控作用。为了深入研究杂粮作物荞麦中的过敏成分与金属离子或小分子活性物质间的相互关系,本实验通过分离、纯化获得天然苦荞主要过敏原TBt,采用荧光光谱法研究了TBt与Cu2+的相互作用,并且采用圆二色光谱和非变性聚丙烯酰胺凝胶电泳(native-polyacrylamide gel electropheresis,native-PAGE)观察其二级结构和空间结构变化,酶联免疫检测Cu2+引起的TBt结构变化及其IgG结合能力的影响。本研究旨在阐明Cu2+对TBt的结构及功能的影响,这也有助于了解金属离子对植物贮藏蛋白的调控作用。
1 材料与方法
1.1 材料、试剂与仪器
苦荞麦品种为湖南一号,系当年收获的种子。
辣根过氧化物酶标记的羊抗兔IgG 美国Southern Biotech公司;底物-邻苯二胺溶液 美国Sigma公司;特异性过敏原TBt多克隆抗体 本实验室自制[12];其他试剂均为国产分析纯。
Resource Q、Superdex G-75层析柱、AKTA Explorer蛋白质纯化系统 美国GE公司;Bio-kine. PMS 450圆二色光谱仪 法国Bio-Logic公司;ELx800酶标仪 美国宝特公司。
1.2 方法
1.2.1 苦荞过敏蛋白的分离和纯化
参照本实验室之前建立的制备天然过敏蛋白的方法[7],脱脂荞麦粉经过缓冲液抽提、盐析、离子交换层析、凝胶层析等分离纯化步骤,获得电泳纯的过敏蛋白TBt。
1.2.2 荧光光谱分析
在荧光比色皿中准确加入1 mL 1×10-6mol/L TBt溶液,并逐次加入1~100 μL 1×10-4mol/L的Cu2+溶液进行荧光滴定,每次加入溶液后混合均匀,在设定的温度(298、310 K)条件下作用3 min,以波长280 nm为激发波长,激发光和发射光的狭缝宽度均为5 nm,在荧光分光光度计上记录300~400 nm波长范围内的发射光谱。将330 nm波长处的荧光强度差值(F-F0)对Cu2+与TBt浓度比(c(Cu2+)∶c(TBt))作图,判断Cu2+与TBt的结合位点数。F0为只有TBt存在时反应体系在330 nm波长处的荧光强度;F为滴加Cu2+后的反应体系在330 nm波长处的荧光强度。
1.2.3 圆二色光谱分析
室温下以缓冲液为参比,在Bio-kine. PMS 450仪中测定TBt和Cu2+作用后的圆二色光谱(加样方法同上)。实验中共扫描3次,取平均值,采用K2D2 server和CD Pro软件计算二级结构的百分含量。
1.2.4 Native-PAGE分析
非变性聚丙烯酰胺凝胶电泳采用4%浓缩胶,10%分离胶,恒流20 mA,电泳完毕经染色、脱色后分析。
1.2.5 抑制性酶联免疫和间接性酶联免疫
抑制性酶联免疫按照以下步骤进行:将TBt用抗原包被液稀释为100 μg/mL,每孔加入100 μL,包被96孔酶标板,4 ℃过夜,弃去孔内液体,洗涤液洗3次,每次5 min。加入100 μL/孔1%脱脂奶粉,37 ℃封闭1 h,洗涤液洗3次,每次10 min。测试样品包括阳性对照组(包被缓冲液100 μL),阴性对照组(TBt 100 μL,质量浓度为100 μg/mL),样品组3组(Cu2+-TBt混合溶液100 μL,c(Cu2+)∶c(TBt)浓度比分别为1∶1、5∶1、10∶1),各组样品经37 ℃孵育30 min后加入稀释的TBt多克隆抗体(1∶30 000)100 μL/孔,同时设空白对照组(不加多克隆抗体)。各组样品经37 ℃孵育30 min后,加入96孔酶标板,100 μL/孔,37 ℃孵育1 h,洗涤3次,每次10 min。加入1∶1 000稀释的辣根过氧化物酶标记的羊抗兔IgG,每孔100 μL,37 ℃孵育1 h,洗涤液洗3次,每次10 min,加入100 μL 0.8 mg/mL底物邻苯二胺溶液,暗处显色15 min,每孔加入50 μL 1 mol/L的稀硫酸,终止反应,酶标仪上测波长490 nm处的光密度值,每组数据设定3个复孔,每次重复3次,计算平均值。
间接性酶联免疫按照文献[13]进行,每组数据设定3个复孔,每次重复3次,计算平均值。
2 结果与分析
2.1 TBt的纯化
按照方法1.2.1节经两步纯化,获得纯度达到95%以上的苦荞过敏原TBt(图1),可用于后续的实验。

图1 非还原SDS-PAGE分析TBt蛋白Fig.1 Non-reducing SDS-PAGE analysis of purified TBt
2.2 荧光光谱分析
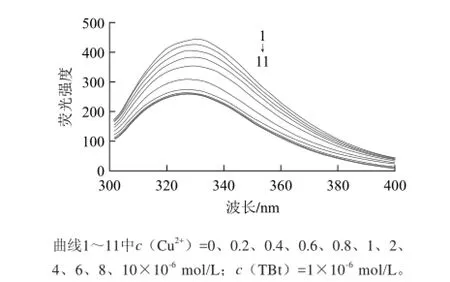
图2 TBt与Cu2+的荧光发射光谱Fig.2 Fluorescence emission spectra of TBt-Cu2+complexes

图3 Cu 3 Cu2+2+与TBt结合位点数的确定Fig.3 Binding sites of TBt with Cu2+
如图2所示,随着Cu2+的不断滴加,在330 nm处TBt内源荧光发生淬灭。如图3所示,随着Cu2+浓度的滴加,荧光强度在c(Cu2+)∶c(TBt)<1∶1之前基本呈线性降低趋势,表明在这部分的滴定中加入的Cu2+完全与过敏蛋白TBt作用;c(Cu2+)∶c(TBt)>1∶1后,荧光强度随着c(Cu2+)∶c(TBt)的增加而减少的程度逐渐减低。当c(Cu2+)∶c(TBt)>5∶1以后,Cu2+与TBt的结合达到饱和状态,起始的直线与饱和时的直线交于c(Cu2+)∶c(TBt)为1.15∶1,表明Cu2+与TBt之间的结合位点约为1∶1。
2.3 圆二色光谱分析

图4 Cu 4 Cu2+2+-TBt作用后的圆二色光谱Fig.4 Circular dichroism spectra of TBt-Cu2+complexes
蛋白质的二级结构和分子中的肽键是高度并且有规律排列的。本实验中,当TBt与Cu2+作用后圆二色光谱峰发生了微小变化,通过K2D2 server和CD Pro软件分别计算TBt及Cu2+与TBt作用后二级结构含量表明(图4),TBt的α-螺旋含量为15.1%,β-折叠的含量为35.27%。Cu2+与TBt作用后α-螺旋含量在14.62%到15.1%之间(P值均大于0.05),β-折叠含量在35.27%到36.57%之间(P值均大于0.05),说明Cu2+的存在,TBt的二级结构并未发生明显变化,主要以β-折叠结构为主,这与Cupin家族蛋白的结构特征相一致[13]。
2.4 Native-PAGE分析

图5 Native-PAGE分析TBt与Cu2+的相互作用Fig.5 Interaction analysis of TBt with Cu2+by native PAGE
已知牛血清白蛋白(bovine serum albumin,BSA)在Native-PAGE中通常会出现多种聚合体,本实验以BSA为参照,通过电泳表征在TBt中加入Cu2+后对其聚合状态的影响。从图5可见,TBt(泳道2)呈现明显的单一条带,与BSA比对,TBt大部分以三聚体的天然构象存在(与BSA三聚体位置接近),而加入Cu2+后(泳道3),在TBt三聚体上方有明显的条带出现,TBt发生了聚合。由此推断TBt与Cu2+相互作用后,使典型Cupin家族的过敏原TBt由三聚体进一步聚合形成部分六聚体。虽然在圆二色光谱实验中未见二级结构改变,但此处显示Cu2+可使TBt的高级结构发生明显变化。
2.5 抑制性酶联免疫和间接酶联免疫检测
由图6A可见,抑制性酶联免疫检测结果,Cu2+的加入会不同程度的减弱苦荞过敏蛋白TBt的致敏性。结合Native-PAGE的结果进一步推出,Cu2+的存在可能改变了苦荞过敏蛋白TBt的天然构象,促使TBt结构由三聚体转变为六聚体,TBt由两个三聚体靠弱作用力相互结合形成六聚体,结合部位的抗原决定簇被部分遮挡,从而使其IgG结合能力降低。但间接酶联免疫(图6B)显示,用TBt以及TBt与不同浓度Cu2+复合物包被酶标板后,检测结果未见明显的变化。可能原因是TBt形成的六聚体的稳定性较差,在非离子去污剂等的作用下会发生解离。

图6 TBt的ELISA检测结果Fig.6 Detection of TBt by ELISA

图7 TBt与Cu2+作用后的空间结构变化Fig.7 Changes in spatial structure after Cu2+-TBt interactions
根据已报道的苦杏仁和大豆中11S球蛋白的结构特点[10,14],结合上述实验结果,本实验提出TBt以及TBt-Cu2+相互作用的模型(图7)。图中表明TBt主要以三聚体的形式存在,而当加入Cu2+后,两个三聚体以“面对面”的形式聚合形成六聚体,从而使其比表面积降低,在与抗体结合时,结合的IgG量减少。
3 讨 论
研究表明,荞麦中的矿物元素含量明显高于其他粮食作物,含有微量元素Fe、Ca、P、Cu、Zn、Mg和极微量的B、I、Ni、Co、Se等[15]。苟君波等[11]应用主成分和聚类分析法对荞麦资源中金属元素进行分析,结果表明,Cu、Mg、Mo、Cd是荞麦资源的特征元素。金属离子对植物种子中贮藏蛋白的结构及活性有较大的影响,如大豆的ASR蛋白(abscisic acid-, stress-, and ripeninginduced protein)在Fe3+和Zn2+的作用下可以发生聚合[16]。许多已经发现的植物过敏原也都可以和金属离子发生作用,进而影响其致敏活性,如榛子过敏原Cor h 1[17]、狗牙草过敏原Cyn d 7[18]、橄榄树过敏原Ole e 3[19]、桦树花粉过敏原Bet v 3和Bet v 4[20-21]等都可以和Ca2+结合,并且这些过敏原的IgG结合能力在一定程度上会受Ca2+的调控。本实验在研究Cu2+与TBt作用的同时,分别研究了Fe2+、Ca2+、Mg2+、Zn2+、Mn2+与TBt的相互作用,结果表明,除了Cu2+外,其余5种金属离子对TBt的作用均不明显(结果略)。
目前,荞麦功能产品受到了国内外消费者的广泛关注,但食用和接触后的过敏症状也时有报道。先前的研究已对其过敏的可能机制进行了探讨,通过基因突变,提出过敏原表位关键氨基酸的重要作用[5],但有关金属离子与荞麦过敏原的结构及致敏性之间的关系还未见报道。上述实验通过光谱法(荧光光谱,圆二色光谱)和酶联免疫法对Cu2+与TBt作用后的一系列变化进行了研究,实验表明TBt易受到Cu2+的影响,Cu2+与TBt有较强的结合作用,通过静态猝灭的方式导致TBt内源荧光减弱;对两者结合后的结合常数、结合位点数和热力学参数计算,推测静电作用力为两者的主要结合力;圆二色光谱探讨了Cu2+对TBt二级结构的影响,得出Cu2+与TBt相互作用后其二级结构未发生明显变化。Native-PAGE分析和酶联免疫检测均显示,Cu2+与TBt作用后,可使典型Cupin家族的过敏原TBt由三聚体进一步聚合形成部分六聚体,IgG结合能力有所降低。食物或环境因素等引起的过敏是一个非常复杂的生化和免疫学问题。有关金属离子对过敏蛋白IgG结合能力的影响及其与过敏蛋白结合后的空间结构变化等有待进一步研究。
[1] GABROVSKA D, FIEDLEROVA V, HOLASOVA M, et al. The nutritional evaluation of underutilized cereals and buckwheat[J]. Food and Nutrition Bulletin, 2002, 23(3): 246-249.
[2] GRIFFITH J Q, COUCH J F, LINDAUER A. Effect of rutin on increased capillary fragility in man[J]. Proceedings of the Society for Experimental Biology and Medicine, 1994, 55(1): 228-229.
[3] CAMILLE S, RAPHAE C, CLAUDE G, et al. IgE-binding epitopic peptide mapping on a three dimensional model built for the 13S globulin allergen of buckwheat (Fagopyrum esculentum)[J]. Peptides, 2009, 30(6): 1021-1027.
[4] DEMOLY P, BOUSQUET J. Drug allergy diagnosis work up[J]. Allergy, 2002, 57(1): 37-40.
[5] 任晓霞, 张昕, 王转花, 等.苦荞过敏原TBa表位区段的表达及免疫活性分析[J]. 细胞与分子免疫学杂志, 2010, 26(6): 543-545.
[6] 赵小珍, 张政, 王转花, 等.苦荞麦主要过敏蛋白N端基因片段的克隆及序列分析[J]. 食品科学, 2006, 27(10): 41-44.
[7] ZHANG Xin, CUI Xiaodong, LI Yuying, et al. Purification and biochemical characterization of a novel allergenic protein from tatary buckwheat seeds[J]. Planta Medica, 2008, 74(15): 1837-1841.
[8] ZHANG Xin, CUI Xiaodong, YUAN Jingming, et al. Molecular cloning, recombinant expression, and immunological characterization of a novel allergen from tartary buckwheat[J]. Jourmal of Agricultural and Food Chemistry, 2008, 56(1): 10947-10953.
[9] CHOI S M, MA C Y. Study of thermal aggregation of globulin from common buckwheat (Fagopyrum esculentum Moench) by sizeexclusion chromatography and laser light scattering[J]. Jourmal of Agricultural and Food Chemistry, 2006, 54(1): 554-561.
[10] ZHANG Yuzhu, KOTHARY M H, FU Tongjen, et al. Crystal structure of prunin-1, a major component of the almond (Prunus dulcis) allergen amandin[J]. Jourmal of Agricultural and Food Chemistry, 2009, 57(1): 8643-8651.
[11] 苟君波, 胡洪利, 吴琦, 等. 荞麦中金属元素的主成分和聚类分析[J].食品科学, 2011, 32(16): 318-321.
[12] 杨振煌, 崔晓东, 李平, 等.特异性过敏原TBt多克隆抗体的制备与鉴定[J]. 细胞与分子学免疫杂志, 2011, 27(9): 1000-1002.
[13] YANG Zhenhuang, LI Yuying, LI Chen, et al. Synthesis of hypoallergenic derivatives of the major allergen Fag t 1 from tartary buckwheat via sequence restructuring[J]. Food and Chemical Toxocology, 2012, 50(8): 2675-2680.
[14] ADACHI M, KANAMORI J, MASUDA T, et al. Crystal structure of soybean 11S globulin: glycinin A3B4 homohexamer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(12): 7395-7400.
[15] 姜忠丽, 康艳红, 辛士刚.ICP-AES法测定苦荞麦中的矿物元素[J].粮食与饲料工业, 2008, 8(1): 45-46.
[16] LI R H, LIU G B, WANG H, et al. Effect of Fe3+and Zn2+on the structural and thermodynamic properties of a soybean ASR protein[J]. Bioscience Biotechnology and Biochemistry, 2013, 77(3): 475-481.
[17] 吴海强, 王晓娟, 邬玉兰, 等.Ca2+离子对榛子过敏原Corh1二级结构和抗原活性影响研究[J]. 中国免疫学杂志, 2012, 28(1): 24-27.
[18] SUPHIOGLU C, FERREIRA F, KNOX R B. Molecular cloning and immunological characterisation of Cyn d 7, a novel calcium-binding allergen from Bermuda grass pollen[J]. Febs Letters, 1997, 402(1): 167-172.
[19] LEDESMA A, VILLALBA M, BATANERO E, et al. Molecular cloning and expression of active Ole e 3, a major allergen from olivetree pollen and member of a novel family of Ca2+-binding proteins (polcalcins) involved in allergy[J]. European Journal of Biochemistry, 1998, 258(2): 454-459.
[20] SEIBERLER S, SCHEINER O, KRAFT D, et al. Characterization of a birch pollen allergen, Bet v III, representing a novel class of Ca2+binding proteins: specific expression in mature pollen and dependence of patients’ IgE binding on protein-bound Ca2+[J]. Embo Journal, 1994, 13(15): 3481-3486.
[21] TWARDOSZ A, HAYEK B, SEIBERLER S, et al. Molecu lar characterization, expression in Escherichia coli, and epitope analysis of a two EF-hand calcium-binding birch pollen allergen, Bet v 4[J]. Biochemical and Biophysical Research Communications, 1997, 239(1): 197-204.
Effects of Cu2+on Molecular Structure and IgG Binding Capacity of the Tartary Buckwheat Allergic Protein TBt
YANG Huan, CUI Xiao-d ong, LI Yu-ying, WANG Zhuan-hua*
(Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006, China)
This study aimed to examined the effect of Cu2+on the structure and allergenicity of TBt, a major allergen in tartary buckwheat. Experiments were carried out to explore the interaction between TBt and Cu2+by fluorescence spectroscopy, analyze the structural change of TBt by circular dichroism (CD) spectroscopy and native polyacrylamide gel electrophoresis (PAGE), and identify the effect of Cu2+on its IgG binding capacity by indirect ELISA and inhibitory ELISA. The results of the fluorescence spectroscopic analysis indicated that Cu2+could be bound to TBt at a molar ratio of 1:1. CD analysis showed the secondary structure of TBt did not change, but the spatial structure of TBt was changed in native PAGE. Briefly, the spatial structures of TBt changed into hexamers after interaction with Cu2+. Inhibitory ELISA and indirect ELISA showed that TBt became a hexamer, and a part of epitopes were covered and the IgG binding capacity was decreased.
tartary buckwheat; allergenic protein; metallic ions; allergenicity
Q516;R392
A
1002-6630(2014)05-0028-05
10.7506/spkx1002-6630-201405006
2013-09-23
国家自然科学基金面上项目(31171659);太原市科技攻关项目(100622)
杨欢(1988—),男,硕士研究生,研究方向为蛋白质化学与工程。E-mail:201123002014@sxu.edu.cn
*通信作者:王转花(1956—),女,教授,博士,研究方向为蛋白质工程与生物活性物质。E-mail:zhwang@sxu.edu.cn

