人子宫内膜基质细胞的分离纯化和体外培养方法研究*
高红艳,陈继明,何援利
(1.南方医科大学附属珠江医院妇产科,广州 510280;2.苏州大学附属第三医院妇产科,江苏常州 213003)
宫腔粘连(intrauterine adhesions,IUA)是子宫内膜损伤后发生的纤维化病变[1],其治疗是临床工作的一大难题。子宫内膜由2层组成,即单层柱状上皮与固有层。柱状上皮主要由具有分泌功能的子宫内膜腺上皮细胞(endometrial epithelial cell,EEC)构成;固有层的结缔组织细胞主要为子宫内膜基质细胞(endometrial stromal cel1,ESC),属于成纤维细胞[2-6]。为研究ESC的生理功能,细胞间相互作用的应答机制,建立ESC体外培养体系进行分析是最理想的试验模型。本研究采用二次酶消化、一次网筛和差时贴壁纯化等方法成功分离和纯化了人ESC,建立了一种简单高效的ESC原代培养方法,为进一步深入研究IUA的机制奠定了基础,并提供了可靠的体外细胞试验研究平台。现报道如下。
1 资料与方法
1.1一般资料 选取2013年12月至2014年3月苏州大学附属第三医院妇产科因子宫肌瘤行全子宫切除术的患者10 例,年龄40~45 岁。10例患者术前3 个月均未用过激素治疗,无内分泌疾病及全身性疾病,在开腹行全子宫切除术后,2例于无菌条件下刮取部分子宫内膜,8例切取部分子宫内膜,术后经病理学确诊均为增生期子宫内膜,于2 h内用冰盒运往试验室进行分离培养。
1.2方法
1.2.1试验仪器及试剂 (1)仪器:二氧化碳培养箱(3111 型),购自Thermo公司;倒置荧光显微镜(EcellSens19),购自Olympus公司;净化工作台(SW-CF-2FD),购自苏州净化设备有限公司;台式低速离心机(80-2 型),购自上海医疗器械(集团)有限公司;细胞培养瓶,购自Fisher Scientific 公司;细胞培养孔板,购自Fisher Scientific 公司;冰箱(BCD-216 型),购自青岛海尔股份有限公司;电热恒温培养箱(DRP-9082 型),购自上海森信试验仪器有限公司;微量移液器,购自Thermo公司。(2)试剂:DMEM/F12 培养基、胰蛋白酶购自Gibco公司;FBS购自Hyclone公司;Ⅰ型胶原酶购自Sigma公司;SP 免疫组织化学染色试剂盒购自福州迈新生物技术开发有限公司;Triton X-100购自Sigma Aldrich公司;3%H2O2购自北京中杉金桥生物技术有限公司;苏木素染液(批号:041M0014V)购自Sigma公司;PBS柠檬酸缓冲液 (pH=7.4)购自福州迈新生物技术有限公司;DAB 显色试剂盒购自福州迈新生物技术有限公司;波形蛋白抗体:santa,sc-32322;角蛋白抗体:sc-8018;羊抗兔辣根过氧化物酶标记抗体:abcam,ab136817。
1.2.2ESC分离 收集临床手术子宫内膜及刮取的子宫内膜立即放入盛有Dmem-F12培养基(DMEM培养基与F12培养基1∶1 混合,含10% 胎牛血清,100 U/mL 青霉素,0.2 mg/mL 链霉素,以下简称D-F培养基) 的无菌平皿中,2 h内进行分离培养。于超净台中无菌操作,用PBS液洗涤3次,剔除血块及黏液,剪碎至糊状,转移至15 mL离心管,加入0.125 mg/mL胰酶,37 ℃、5%CO2培养箱中消化5~10 min。1 000 r/min,离心3 min,弃上清液。向组织沉淀中加入0.8 mg/mL 的Ⅰ型胶原酶(体积比1∶5),37 ℃、5% CO2培养箱中消化约60 min,每15 min 震荡离心管1次。反复吹打消化悬液,静止,待剩余糊状组织沉淀后,小心吸取细胞悬液,经400目筛网过滤。滤液1 000 r/min,离心8 min,沉淀获得较高纯度的基质细胞及少量腺上皮细胞和红细胞。60 min大部分基质细胞贴壁后换液,PBS漂洗2次后置入新鲜培养液,即获得较高纯度的腺上皮细胞。24 h后换液除去未贴壁的死细胞和血细胞。
1.2.3细胞培养 将分离所得的ESC分别用血细胞计数板计数后,在 100 mL培养瓶中按(2~5)×105个/cm2的密度进行接种,放置在5% CO237 ℃培养箱进行培养,每48 h 观察并换液1次。
1.2.4传代培养 在倒置显微镜下进行观察,可见细胞在约5~6 d后长满培养瓶底,即可传代。吸去培养上清液后,加入2.5 mg/mL的胰蛋白酶进行消化,在显微境下观察到细胞收缩变圆后,再吸去消化液,重新加入培养液,然后用吸管吹打使细胞从培养瓶壁吹打下来,按(2~5)×105个/cm2扩大培养。
1.2.5ESC表型纯度免疫组织化学鉴定 细胞爬片培养后,用4%甲醛固定15 min,加入鼠抗人波形蛋白单抗和细胞角蛋白单抗(PBS代替一抗作空白对照),4 ℃过夜,加入经生物素标记的二抗,严格按照说明书进行操作,以DAB显色后,采用苏木精进行复染,放置光镜下观察。阳性结果为细胞质被染成棕黄染色,而阴性结果为细胞质未被染色。
2 结 果
2.1细胞培养结果 10份子宫内膜组织标本中,7份培养成功,培养未成功的3份标本均为分离得到的基质细胞过少所致,其中2例为刮宫手术获得,另1例从切取的子宫标本中获得。本研究中,细胞培养液及运送液中均加入100 U/mL青霉素及0.2 mg/mL链霉素,未发生真菌或其他细菌感染,但冻存细胞复苏后发现70%有细菌污染。
2.2形态学观察 分离所得的间质细胞为单个细胞,细胞在接种30 min后开始出现贴壁,2 h贴壁基本完成。间质细胞初贴壁时为多边形,在4~6 d后爬满瓶壁的细胞变为长梭形或是纺锤形,胞体较小,具有成纤维细胞形态。本研究获得了纯度超过95%的ESC,间质细胞中偶见上皮细胞团出现(<5%),培养至P5代基本停止增殖。间质细胞传代的次数越多,其纯度就越高。
2.3免疫组织化学方法鉴定结果 波形蛋白在ESC中呈阳性表达,其细胞质显棕黄色颗粒(图1),而EEC表达角蛋白,PBS空白对照细胞质均未着色。随机取5个×200倍视野,计算波形蛋白着色细胞即基质细胞比例。在原代培养的人子宫内膜上皮细胞中,波形蛋白在95%以上的基质细胞的细胞质区域为强阳性表达,同时角蛋白为阴性表达。见图1。
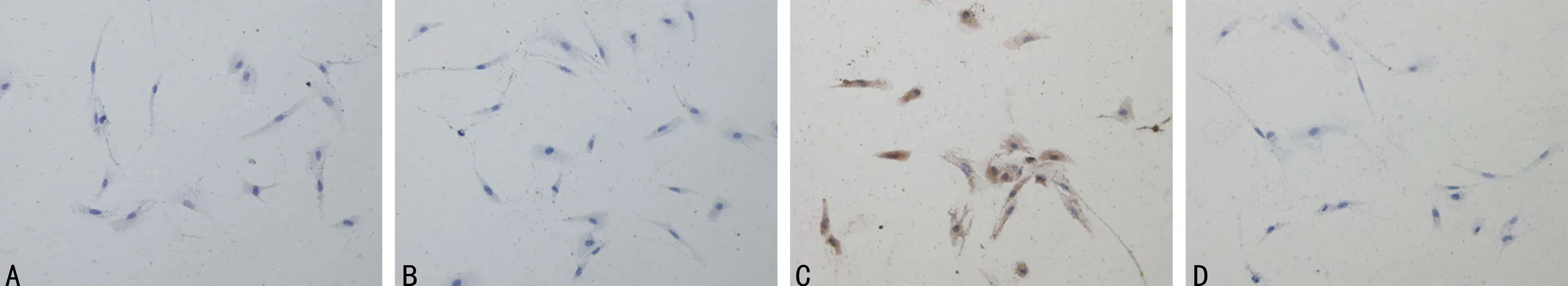
A:波形蛋白阴性对照(×200);B:角蛋白阴性对照(×200);C:波形蛋白阳性表达(×200);角蛋白阴性表达(×200)。
图1免疫组织化学鉴定结果
3 讨 论
IUA是子宫内膜损伤后发生的纤维化病变。子宫内膜主要由基质细胞和腺上皮细胞组成,基质细胞属于成纤维细胞。因此,为研究ESC的生理功能及细胞间的相互作用的应答机制,建立ESC体外培养体系进行分析是最理想的试验模型。
有研究发现,分离的细胞活力、纯度及接种密度直接关系到ESC原代培养的成功与否[7]。在增生期,子宫内膜以基质细胞为主[8],根据这一特点,本研究在分离细胞时,收集增生期子宫内膜,从而提高了原代细胞的产量。正常的子宫内膜由单层柱状上皮和固有层组成。本研究分离基质细胞的子宫内膜有2个来源,分别是从手术切除后的子宫刮取和切取获得。10份子宫内膜组织标本中,7份培养成功,培养成功率与Ryan等[3]的研究结果相似。试验中发现,2例刮取的子宫内膜组织经消化后取得的细胞主要为腺上皮细胞,基质细胞较少而失败,另1例从子宫标本切取的内膜组织也因基质细胞较少而失败。总结以上的经验教训,后试验改为切取组织至少厚度达5 mm,面积大于1.5 cm2,余下的所有7例均获成功。这与相关研究通过刮宫取材即可成功高效分离ESC的经验不同[9-10]。
据文献报道,ESC易受到阴道细菌的污染而可能导致培养失败[4]。在本研究中,培养液及运送液中都加了100 U/mL青霉素及0.2 mg/mL链霉素,没有发生真菌或其他细菌感染。但冻存细胞复苏后发现70%有细菌污染,有待后续试验进一步改进。对于纤维较多的内膜组织来说,酶法是最常用的方法。大多数研究者选用胶原酶,酶浓度为0.1%~1.0%,消化时间为40~120 min[8,11-13]。本研究先用0.125 mg/mL胰酶消化5~10 min,再用0.8 mg/mL 的Ⅰ型胶原酶(体积比1∶5)消化约60 min,在较短的时间内消化获得了较多的组织细胞,降低了对细胞的破坏。Osteen等[5]学者使用二次过滤法分离EEC和ESC,获得的ESC纯度较高,但EEC生长不良。蒋洲梅等[6]通过低速离心与高密度接种的方法分离此2种细胞,提高了EEC的纯度,但降低了ESC的纯度。本试验目的仅分离基质细胞,根据基质细胞体积小,腺上皮细胞体积大且易成团的特点,仅行一次400目网筛法,有效降低了细胞的丢失。分离所得的体积小的间质细胞多在2 h内完成贴壁;而体积较大的腺上皮细胞则相互聚集,无法通过400目的筛网,在2 h后才开始贴壁。本研究有效利用这种差异,采用一次性的400目筛网进行过滤及分时段的贴壁方法成功纯化细胞,同时对混杂在子宫内膜中的大量红细胞,采用逐次换液的方法进行清除,取得了良好的效果,且将其他干预因素对培养细胞的影响有效排除,获得了纯度超过95%的ESC,此与谭先杰等[4]的试验结果相类似。此外,细胞特异性蛋白的表达不随原代细胞的分离过程而改变,因而在鉴定培养结果时,可采用针对在体细胞抗原的特异抗体对离体细胞进行免疫标记[14-16]。本试验细胞鉴定中波形蛋白成功免疫染色,证明采用本试验方法培养所得的原代细胞并未改变其固有的细胞免疫特征,可进一步满足将来的研究需要。但原代细胞培养至P5代基本停止增殖,如何提高细胞活性及细胞传代有待进一步探索。
本研究通过合理取材,使用二次酶消化,降低了对细胞的破坏,一次网筛和差时贴壁纯化,在较短的时间内获得了较多的组织细胞,成功分离和纯化了人ESC,为进一步研究IUA的发病机制及女性不孕不育体外细胞研究治疗奠定了体外细胞学水平试验基础。
[1]Panayotidis C,Weyers S,Bosteels J,et al.Intrauterine adhesions (IUA) has there been progress in understanding and treatment over the last 20 years[J].Gynecol Surg,2009,6(3):197-211.
[2]Chan RW,Schwab KE,Gargett CE.Clonogenicity of hum an endometrial epithelial and stromal cells[J].Bio Rep rod,2004,70(6):1738-1750.
[3]Ryan IP,Schriock ED,Taylor RN.Isolation characterization and comparison of human endometrial and endometriosis cells in vitro[J].Clin Endocrinol Metab,1994,78(3):642-649.
[4]谭先杰,刘东远,郎景和,等.子宫内膜腺上皮及基质细胞分离、培养作为子宫内膜异位症体外细胞模型的探索[J].现代妇产科进展,2002,11(1):30-32.
[5]Osteen KG,Hill GA,Hargrove JT,et al.Development of a method to isolate and culture highly purified populations of stromal and epithelial cells from human endometrial biopsy specimens[J].Fertil Steril,1989,52(6):965-972.
[6]蒋洲梅,黄玉珠,洪淡华,等.人子宫内膜细胞培养及形态学观察[J].生殖与避孕,1994,14(4):271-274.
[7]Saleh L,Otti GR,Fiala C,et al.Evaluation of human first trimester decidual and telomerase-transformed endometrial stromal cells as model systems of in vitro decidualization[J].Reprod Biol Endocrinol,2011,9:155.
[8]Zhang L,Guo W,Chen Q,et al.Adam12 plays a role during uterine decidualization in mice[J].Cell Tissue Res,2009,338(3):413-421.
[9]陈晓岚,黄仁彬,欧海燕,等.人子宫内膜细胞的体外纯化和培养[J].生殖与避孕,2006,26(9):530-532.
[10]陈诚,常青,梁志清,等.人子宫内膜细胞原代培养方法的改良[J].第三军医大学学报,2007,29(6):507-509.
[11]Krishnaswamy N,Chapdelaine P,Tremblay JP,et al.Development and characterization of a simian virus 40 immortalized bovine endometrial stromal cell line [J].Endocrinology,2009,150(1):485-491.
[12]Ramathal CY,Bagchi IC,Taylor RN,et al.Endometrial decidualization:of mice and men [J].Semin Reprod Med,2010,28(1):17-26.
[13]Mori M,Kitazume M,Ose R,et al.Death effect or domain-containing protein (DEDD) is required for uterine decidualization during early pregnancy in mice[J].J Clin Invest,2011,121(1):318-327.
[14]Das SK.Cell cycle regulatory control for uterine stromal cell decidualization in implantation [J].Reproduction,2009,137(6):889-899.
[15]Itoh H,Kishore AH,Lindqvist A,et al.Transforming Growth Factor β1 (TGFβ1) and Progesterone Regulate Matrix Metalloproteinases (MMP) in Human Endometrial Stromal Cells[J].J Clin Endocrinol Metab,2012,97(6):E888-897.
[16]Matsumoto K,Yamauchi N,Watanabe R,et al.In vitro decidualization of rat endometrial stromal cells[J].Cell Tissue Res,2009,335(3):575-583.

