三种 HLA-A / 0201 限制性表位肽尤文肉瘤树突状细胞疫苗的抗肿瘤免疫作用
彭 伟 黄迅悟 赵伟鹏 赵 铭 杨大志
. 论著 Original article .
三种 HLA-A / 0201 限制性表位肽尤文肉瘤树突状细胞疫苗的抗肿瘤免疫作用
彭 伟 黄迅悟 赵伟鹏 赵 铭 杨大志
目的比较不同 EWS / FLI-1 蛋白 HLA-A / 0201 限制性表位肽对尤文肉瘤树突状细胞( dendritic cell,DC ) 疫苗的抗肿瘤作用。方法综合运用 BIMAS、SYFPEITHI 软件筛选与人白细胞抗原HLA-A / 0201 结合力强的 EWS / FLI-1 蛋白 9 肽表位,并合成其表位肽。采用 4 h 标准51Cr 释放实验检测刺激细胞毒性 T 淋巴细胞 ( cytotoxic T lymphocytes,CTLs ) 对肿瘤细胞的杀伤效应。应用酶联免疫斑点法 ( enzyme linked immunospot assay,ELISPOT ) 检测表位肽对 DC 疫苗刺激的效应细胞 γ-干扰素 ( interferon,IFN-γ ) 的释放。在此基础上,进行免疫治疗的动物实验,比较其体内抗肿瘤作用。结果筛选出 EWS 306、EWS 289 及EWS 401 与 HLA-A / 0201 具较强的结合性,其合成出的表位肽分别为:QLWQFLLEL ( EWS 306 )、ILGPTSSRL ( EWS 289 ) 和 SMYKYPSDI ( EWS 401 )。3 组表位肽均有较强的杀伤力,当效-靶比为 50∶1 时,杀伤率 EWS 306 组 ( 20.2±1.8 ) %、EWS 289 组 ( 12.6±0.3 ) %、EWS 401 组 ( 11.9±0.2 ) %,而对照组为 ( 6.7±0.1 ) %;当效-靶比为 100∶1 时,表位肽的三组杀伤作用明显提升,杀伤率 EWS 306 组最高为 ( 51.2±3.7 ) %、EWS 289组 ( 24.6±2.1 ) %、EWS 401 组 ( 17.8±0.9 ) %,对照组为 ( 7.2±0.2 ) %。EWS 306 组同其它组比较,差异有统计学 ( P<0.05 )。EWS 306 组分泌的 IFN-γ 为 ( 118.3±3.6 ) 个点明显高于 EWS401 组 ( 35.1±1.0 ) 个和 EWS 289 组 ( 34.2±0.9 ) 个,对照组为 ( 5.0±0.1 ) 个 ( P<0.05 )。EWS 306 组肿瘤的体积 ( 978.9±28.2 ) mm3明显小于阴性对照组 ( 1992.9±16.1 ) mm3和空白对照组 ( 2001.9±12.3 ) mm3( P<0.05 )。接种后第 35 天,EWS 306 组存活率为 80% 大于空白对照组为 0%、阴性对照组为 10% ( P<0.05 );接种后第 40 天,空白对照组降为 0%,EWS 306 组为 80% 明显大于和 2 个对照组 ( P<0.05 )。结论EWS / FLI-1 蛋白表位肽中 EWS 306 较 EWS 289和 EWS 401 对 DC 的抗肿瘤作用更强,能够有效激活 CTLs 对肿瘤细胞的杀伤效应,为尤文肉瘤的免疫治疗提供了新的方向。
肽类;药物筛选试验,抗肿瘤;抗肿瘤药;限制性表位肽;尤文肉瘤
尤文肉瘤是发生率仅次于骨肉瘤,好发于青少年儿童的恶性肿瘤,约占儿童肿瘤发生率的1%[1-3]。虽然放疗、化疗联合手术治疗使生存率有了明显提高,但仍有 30%~40% 的患者复发,23%以上的患者死于复发和全身转移[4-6]。因此寻求新兴的免疫治疗方法成为尤文氏肉瘤的研究热点[7-9]。郭义等[10]实验证实,EWS / FLI-1 基因修饰的树突状细胞疫苗对尤文肉瘤细胞具有杀伤效果。曹凯等[11]通过分子模拟实验证明,不同的表位肽与HLA-A / 0201 的结合能力有所差异,而人类白细胞抗原 HLA-A / 0201 在抗原提呈和细胞毒性 T 淋巴细胞识别过程中起关键作用。因此,本研究将对EWS / FLI-1 蛋白进行 HLA-A / 0201 限制性细胞毒性 T 淋巴细胞表位进行预测和筛选,并进一步比较结合力好的表位肽对尤文肉瘤的树突状细胞疫苗的抗肿瘤作用,为临床应用提供理论依据。
资料与方法
一、细胞株和实验动物
人类 TAP 缺陷的 T2细胞株、BB7.2 细胞株 ( 可产生抗 HLA-A2 的单克隆抗体 )、人尤文肉瘤细胞株A673 购买于美国菌种保藏中心 ( ATCC,Manassas,VA,USA )。细胞采用含 10% 胎牛血清和含 1% 青霉素+链霉素溶液 DMEM 培养基中培养,孵育于37 ℃、5% CO2的恒温培养箱中。
实验动物选用非肥胖型糖尿病 / 重症联合免疫缺陷 ( NOD / SCID ) 小鼠和 BALB / c ( H-2d ) 小鼠,6~10 周龄,购自军事医学科学院动物所。动物的饲养采用 SPF 级饲养,所有动物实验遵守动物伦理委员会原则。
二、表位肽的筛选及合成
从 Genbank 检索获得 EWS / FLI-1 蛋白氨基酸序列全长,应用 BIMAS 和 SYFPEITHI 软件[12-13]对EWS / FLI-1 蛋白 476 个氨基酸序列进行 HLA-A / 0201 限制性细胞毒性 T 淋巴细胞表位进行分析,筛选出得分最高的 3 组 9 肽表位。通过表位肽亲和力检测试验,比较筛选出的表位肽与 HLA-A / 0201 的亲合力大小。其亲和力结果采用荧光系数( FI,Fluorescence index ) 表示,当 IF≥1.5 时,两者亲和力较强;当 1≤FI<1.5 时,亲和力中等;当0.5≤FI<1 时,亲和力较低;当 IF<0.5 时,两者无亲和力。
应用标准 Fmoc 方案合成筛选出的表位多肽,并对表位肽进行纯化处理,以供后续试验用 ( 由世纪亚光公司完成 )。
三、树突状细胞 ( dendritic cell,DC ) 的培养
从健康人 ( HLA-A2+ ) 外周抗凝血 200 ml 血膜的 20 ml 处,应用淋巴细胞分离液 Ficoll-Hypaque梯度离心分离外周血单核细胞 ( peripheral blood mononuclear cells,PBMC )。吸弃上清,用预热的无血清 RPMI1640 洗取非贴壁细胞,贴壁细胞用RPMI1640+10% 胎牛血清培养基培养。加入 75 cm2培养瓶中 ( corning ),在 37 ℃、5% ( V / V ) CO2孵育 2 h。培养后第 5 天,加入 1000 U / ml 粒-巨噬细胞集落刺激因子 hGM-CSF ( R & D Systems,Minneapoils,MN,美国 ) 和 1000 U / m 白细胞介素( interleukin-4,IL-4 ) ( R & D Systems,Minneapoils,MN,美国 ),隔日半量换液并补充细胞因子。培养后第 7 天加入肿瘤坏死因子 α ( tumor necrosisfactor α,TNF-α ) ( R & D Systems,Minneapoils,MN,美国 ) 1000 U / ml,继续培养 2 天促进其成熟。对成熟的 DC 表型采用流式细胞仪进行检测。
四、表位肽冲击致敏 DC 疫苗和 DC 递呈抗原、效应细胞的制备
在 3 组 DC 细胞中分别加入 100 μg / ml 的QLWQFLLEL ( EWS 306 ),ILGPTSSRL ( EWS 289 )和 SMYKYPSDI ( EWS 401 ) 表位多肽,孵育 4 h,经20 Gy 照射后 15 min,洗涤 2 次,加入复苏的淋巴细胞,进行肽冲击,然后加入 20 U / ml 的 IL-2,如此每周 1 次,共 3 次后收集效应细胞。
五、4 h 标准51Cr 释放实验
检测和比较各组 DC 疫苗刺激产生特异性细胞毒性 T 淋巴细胞 ( cytotoxic T lymphocyte,CTL )的体外杀伤效果。以 A673 细胞为靶细胞, 与51Cr ( 100 μCi / 106个细胞 ) 于 37 ℃ 水浴箱内共同温育2 h,磷酸盐缓冲液 ( PBS ) 洗涤细胞 3 次,用 RPM I-1640 重悬并按不同效-靶比 ( 25∶1、50∶1 以及 100∶1 ) 与效应细胞混合。设置负载病毒 HBcAg 18-27 组作为对照组。孵育后 4 h 收集上清液,利用γ 放射免疫计数器测定各孔的每分钟脉冲值,计算公式如下:特异性杀伤率 ( % )=( 试验孔 cpm-自然释放孔 cpm ) / ( 最大释放孔 cpm-自然释放孔 cpm ) ×100%。
六、酶联免疫斑点法 ( enzyme linked immunospot assay,ELISPOT ) 检测表位肽负载的 DC 疫苗效应细胞释放 IFN-γ 的实验。操作步骤按照说明书进行。
七、体内抗肿瘤免疫作用的检测
6 周龄非肥胖型糖尿病 / 重症免疫缺陷 ( NOD / SCID ) 小鼠 30 只,随机分成 3 组:EWS 306 组为实验组,HBcAg18-27 组为阴性对照组,PBS 组为空白对照组,每组 10 只。A673 细胞以 1×106个 / 100 μl 在小鼠左腋窝皮下接种,构建人尤文肉瘤小鼠模型。EWS 306 组:接种后 3 天,以 100 μl 肽冲击 DC 细胞悬液 ( 1×106) 通过尾根部注射,每 5 天重复注射 1 次,共 4 次。阴性对照组接种同样数量和体积的细胞悬液,空白对照组接种相同体积的PBS。瘤体可触及后,用游标卡尺测量肿瘤最长径( a ) 和最短径 ( b )。肿瘤体积 ( mm3) 计算公式为:肿瘤体积 ( V )=1 / 2a×b2,绘制肿瘤生长曲线。观察小鼠生存情况,并绘制生存曲线。
八、统计学方法
结 果
一、表位肽的筛选及合成
筛选出了 3 组 9 肽表位和 HLA-A / 0201 的有较强的亲合力,分别为 EWS 306、EWS 289 及 EWS 401。其合成的表位肽序列分别为:QLWQFLLEL ( EWS 306 )、ILGPTSSRL ( EWS 289 ) 和 SMYKYPSDI ( EWS 401 ) ( 表 1 )。
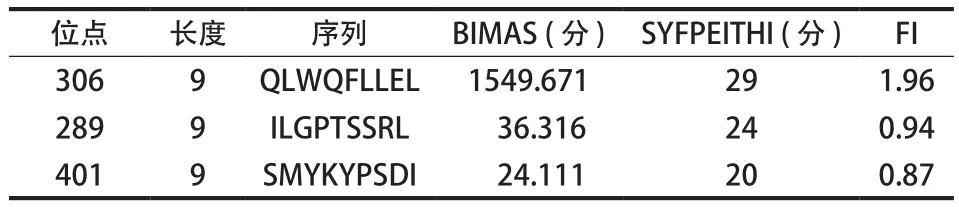
表1 3种 EWS / FLI-1 蛋白 HLA-A / 0201 限制性表位肽Tab.1 Three kinds of HLA-A / 0201-restricted epitope peptides of EWS / FLI-1 protein
二、DC 疫苗杀伤实验
三组表位肽 DC 疫苗诱导的 CTL 都能对 A673进行特异性杀伤:当效-靶比为 25∶1 时作用不太明显,杀伤率 EWS 306 组 ( 6.8±0.2 ) %、EWS 289 组 ( 6.6±0.1 ) %、EWS 401 组 ( 6.4±0.1 ) %、对照组为 ( 6.2±0.1 ) %;当效-靶比为 50∶1 时,表位肽的三组杀伤作用提升,杀伤率 EWS 306 组( 20.2±1.8 ) %、EWS 289 组 ( 12.6±0.3 ) %、EWS 401 组 ( 11.9±0.2 ) %,而对照组为 ( 6.7±0.1 ) %,且 EWS 306 组同其它组比较,差异有统计学意义( P<0.05 );当效-靶比为 100∶1 时,表位肽的三组杀伤作用明显提升,杀伤率 EWS 306 组最高为( 51.2±3.7 ) %、EWS 289 组 ( 24.6±2.1 ) %、EWS 401 组 ( 17.8±0.9 ) %,对照组杀伤作用变化不大,为 ( 7.2±0.2 ) %,EWS 306 组同其它组比较,差异有统计学意义 ( P<0.05 ) ( 图 1 )。
三、效应细胞 IFN-γ 释放的检测
用 ELISPOT 方法比较不同表位肽冲击 DC 疫苗刺激效应细胞分泌 IFN-γ 的差异。EWS 306 组分泌的 IFN-γ 为 ( 118.3±3.6 ) 个点明显高于 EWS 401 组( 35.1±1.0 ) 个和 EWS 289 组 ( 34.2±0.9 ) 个,对照组为 ( 5.0±0.1 ) 个。EWS 306 组同其它三组比较,差异有统计学意义 ( P<0. 05 ) ( 图 2 )。
四、肿瘤生长抑制
EWS 306 组肿瘤的体积 ( 978.9±28.2 ) mm3明显小于阴性对照组 ( 1992.9±16.1 ) mm3和空白对照组( 2001.9±12.3 ) mm3,差异有统计学意义 ( P<0.05 ) ( 图 3a )。接种后第 35 天,空白对照组存活率为0%,阴性对照组为 10%,EWS 306 组为 80%;接种后第 40 天,空白对照组和阴性对照组均为 0%,EWS 306 组为 80%。无论是接种后第 35 天,还是接种后第 40 天,EWS 306 组同阴性对照组和空白对照组比较,肿瘤因受到抑制而生长明显减慢,其存活率得以提高,且存活时间明显延长,差异有统计学意义 ( P<0.05 ) ( 图 3b )。
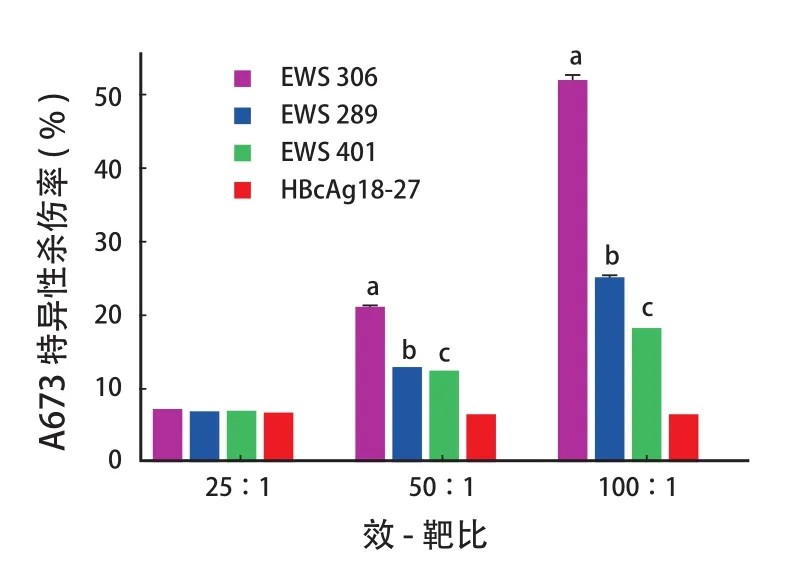
图1 不同表位肽免疫激活 CTL 的杀伤效应Fig.1 Immune activation of lethal effects of CTLs by different epitope peptides注:a代表 EWS 306 与其它各组比较 ( P < 0.05 );b代表 EWS 289 与其它各组比较 ( P < 0.05 );c代表 EWS 401 与其它各组比较 ( P < 0.05 )Note:aReferred to the comparison between EWS 306 group and the other groups ( P<0.05 );bReferred to the comparison between EWS 289 group and the other groups ( P<0.05 );cReferred to the comparison between EWS 401 group and the other groups ( P<0.05 )
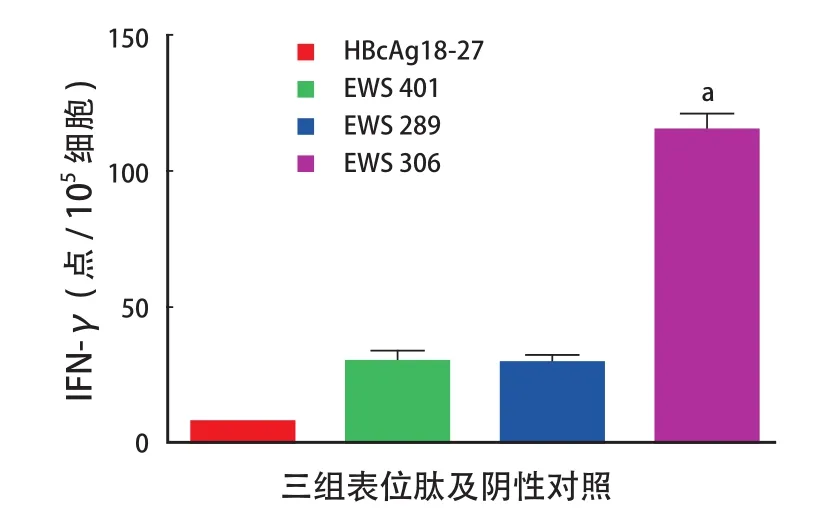
图2 a不同表位肽冲击 DC 疫苗刺激效应细胞 IFN-γ 释放的影响Fig.2aIFN-γ releasing of effector cells induced by DC vaccines of different epitope peptides注:a代表 EWS 306 与其它各组比较 ( P < 0.05 )Note:aReferred to the comparison between EWS 306 group and the other groups ( P<0.05 )
讨 论
尤文肉瘤好发于 20 岁以下青少年,95% 以上的尤文肉瘤具有特异性的染色体易位 t ( 11;22 ) ( q24;q12 ),由 22 号染色体 EWS 基因 5’ 氨基末端与 11 号染色体 FLI1 基因 3’ 羧基末端融合从而形成一种新的融合基因 EWS-FLI1,并表达融合蛋白EWS-FLI1。EWS-FLI1 是尤文肉瘤发生、发展的关键,是诊断和预后的标志物,同时也治疗尤文肉瘤的理想的靶点[14-16]。本研究选用 A673 细胞系,其具有尤文肉瘤特有的特征,即染色体易位 t ( 11;22 )和融合基因 EWS-FLI1 的表达。
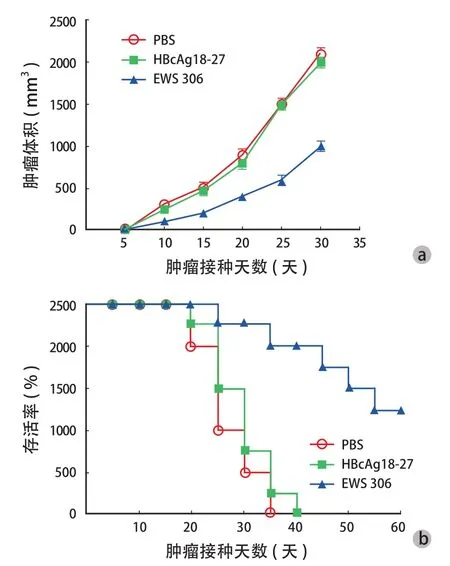
图3 EWS 306 表位肽抑制肿瘤生长情况 a:肿瘤生长情况;b:荷瘤小鼠的存活率Fig.3 Tumor growth inhibited by EWS 306 a: Tumor growth; b: Survival rates of tumor-burdened mice
免疫疫苗对尤文肉瘤细胞的杀伤效应产生的机理是由表位肽刺激、活化 CTL 产生的效应[17-19]。树突细胞是目前已知的体内功能最强大的抗原呈递细胞,也是公认最具有潜力的免疫疫苗。然而,在应用过程中发现免疫效果欠佳[20]。这可能和很多因素有关,如传代过程中肿瘤抗原的丢失、MHC 表达的减少等[21-23]。因此,研究表位肽结构对树突疫苗的免疫治疗效果有重要的意义。在本研究中首先综合运用 BIMAS、SYFPEITHI 对 EWS-FLI1 蛋白进行HLA-A / 0201 限制性细胞毒性 T 淋巴细胞表位进行筛选,通过亲和力实验检测出 QLWQFLLEL ( EWS 306 ),ILGPTSSRL ( EWS 289 ) 和 SMYKYPSDI ( EWS 401 ) 表位肽与 HLA-A / 0201 结合较好。
我们通过 4 h51Cr 释放实验和 IFN-γ 释放实验对每一个表位肽进行检测。结果发现,EWS 306 的特异性杀伤率最高,并且能够明显提高 IFN-γ 的释放量,增强了机体的非特异性抗肿瘤能力。本研究通过体外实验表明 EWS 306 表位在体外细胞试验中具有较强免疫原性和抗肿瘤的作用;通过动物试验发现,EWS 306 肽冲击树突疫苗能够有效阻止肿瘤的生长和提高小鼠的生存期。
总之,EWS 306 是一个重要的表位肽,具有较强激活 CTLs 的潜力,能够有效杀死肿瘤细胞,为我们研究尤文氏肉瘤的免疫治疗提供了新思路和新方法。
[1]Kilic-Eren M, Boylu T, Tabor V. Targeting PI3K/Akt represses Hypoxia inducible factor-1α activation and sensitizes Rhabdomyosarcoma and Ewing’s sarcoma cells for apoptosis. Cancer Cell Int, 2013, 13:36.doi:10.1186/1475-2867-13-36.
[2]Morris P, Dickman PS, Seidel MJ. Ewing’s sarcoma/primitive neuroectodermal tumor of the proximal humeral epiphysis. Orthopedics, 2013, 36(1):113-116.
[3]Pirker-Frühauf UM, Friesenbichler J, Urban EC, et al. Osteoporosis in children and young adults: a late effect after chemotherapy for bone sarcoma. Clin Orthop Relat Res, 2012, 470(10):2874-2885.
[4]Hong AM, Millington S, Ahern V, et al. Limb preservation surgery with extracorporeal irradiation in the management of malignant bone tumor: the oncological outcomes of 101 patients. Ann Oncol, 2013, 24(10):2676-2680.
[5]Zhu Q, Zhang J, Xiao J. Primary dumbbell-shaped Ewing’s sarcoma of the cervical vertebra in adults: Four case reports and literature review. Oncol Lett, 2012, 3(3):721-725.
[6]Tural D, Molinas Mandel N, Dervisoglu S, et al. Extraskeletal Ewing’s sarcoma family of tumors in adults: prognostic factors and clinical outcome. Jpn J Clin Oncol, 2012, 42(5):420-426.
[7]Pahl JH, Ruslan SE, Buddingh EP, et al. Anti-EGFR antibody cetuximab enhances the cytolytic activity of natural killer cells toward osteosarcoma. Clin Cancer Res, 2012, 18(2):432-441.
[8]Ahn YO, Weigel B, Verneris MR. Killing the killer: natural killer cells to treat Ewing’s sarcoma. Clin Cancer Res, 2010, 16(15):3819-3821.
[9]Mackall CL, Rhee EH, Read EJ, et al. A pilot study of consolidative immunotherapy in patients with high-risk pediatric sarcomas. Clin Cancer Res, 2008, 14(15):4850-4858.
[10]郭义, 郭卫, 汤小东, 等. 尤文肉瘤基因免疫治疗的研究. 中华实验外科杂志, 2004, 21(7):848-851.
[11]曹凯, 黄路, 林治华, 等. 分子模拟用于尤文肉瘤EWS-FLI1蛋白HLA-A2.1限制性CTL表位的筛选. 化学学报, 2010, 68(13):1277-1284.
[12]Parker KC, Bednarek MA, Coligan JE. Scheme for ranking potential HLA-A2 binding peptides based on independent binding of individual peptide side-chains. J Immunol, 1994, 152(1):163-175.
[13]Rammensee H, Bachmann J, Emmerich NP, et al. SYFPEITHI: database for MHC ligands and peptide motifs. Immunogenetics, 1999, 50(3-4):213-219.
[14]Huang L, Kuwahara I, Matsumoto K. EWS represses cofilin 1 expression by inducing nuclear retention of cofilin 1 mRNA. Oncogene, 2014, 33(23):2995-3003.
[15]Gascoyne DM, Dunne J, Behjati S, et al. EWS/ETS proteins promote expression and regulate function of the homeodomain transcription factor BRN3A. Oncogene, 2010, 29(21): 3134-3145.
[16]Nagano A, Ohno T, Shimizu K, et al. EWS/Fli-1 chimeric fusion gene upregulates vascular endothelial growth factor-A. Int J Cancer, 2010, 126(12):2790-2798.
[17]Gerdemann U, Katari U, Christin AS, et al. Cytotoxic T lymphocytes simultaneously targeting multiple tumorassociated antigens to treat EBV negative lymphoma. Mol Ther, 2011, 19(12):2258-2268.
[18]Imai K, Hirata S, Irie A, et al. Identification of HLA-A2-restricted CTL epitopes of a novel tumour-associated antigen, KIF20A,overexpressed in pancreatic cancer. Br J Cancer, 2011, 104(2):300-307.
[19]Murao A, Oka Y, Tsuboi A, et al. High frequencies of less differentiated and more proliferative WT1-specific CD8+ T cells in bone marrow in tumor-bearing patients: an important role of bone marrow as a secondary lymphoid organ. Cancer Sci, 2010, 101(4):848-854.
[20]Kiessling A, Wehner R, Füssel S, et al. Tumor-associated antigens for specific immunotherapy of prostate cancer. Cancers (Basel), 2012, 4(1):193-217.
[21]Bhargava A, Mishra D, Banerjee S, et al. Engineered dendritic cells for gastrointestinal tumor immunotherapy: opportunities in translational research. J Drug Target, 2013, 21(2):126-136.
[22]Palma M, Hansson L, Choudhury A, et al. Vaccination with dendritic cells loaded with tumor apoptotic bodies (Apo-DC) in patients with chronic lymphocytic leukemia: effects of various adjuvants and definition of immune response criteria. Cancer Immunol Immunother, 2012, 61(6):865-879.
[23]Bray SM, Vujanovic L, Butterfield LH. Dendritic cell-based vaccines positively impact natural killer and regulatory T cells in hepatocellular carcinoma patients. Clin Dev Immunol, 2011, 2011:249281.doi:10.1155/2011/249281.
( 本文编辑:代琴 )
Antitumor immune response induced by three kinds of human leukocyte antigen-antigen / 0201-restricted epitope peptides in Ewing’s sarcoma dendritic cell vaccine
PENG Wei, HUANG Xun-wu, ZHAO Wei-peng, ZHAO Ming, YANG Da-zhi. Department of Orthopedics, the 309th Hospital of CPLA, Beijing, 100091, PRC
ObjectiveTo compare the antitumor effects of Ewing’s sarcoma protein ( EWS ) 306, EWS 289 and EWS 401 of human leukocyte antigen ( HLA )-antigen ( A ) / 0201-restricted epitope peptides against dendritic cells ( DCs ) of Ewing’s sarcoma.MethodsThe peptide 9 of EWS / FLI-1 protein, which was easily combined with HLA-A / 0201 of human cell antigen was screened by Operating software of BIMAS and SYFPEITHI. And then the corresponding epitope peptide was generated. The standard 4 h-51Cr release experiment was used to test the lethal effects of cytotoxic T lymphocytes ( CTLs ) against tumor cells. Enzyme linked immunospot assay ( ELISPOT ) was applied to detect the interferon-γ ( IFN-γ ) releasing of effector cells induced by DC vaccines of epitope peptides. Accordingly, the antitumor effects in vitro were compared in an animal experiment, and all these animals received immunotherapy.ResultsA strong binding force with HLA-A / 0201 was noticed in the screened EWS 306, EWS 289 and EWS 401, and the generated epitope peptides were QLWQFLLEL ( EWS 306 ), ILGPTSSRL ( EWS 289 ) and SMYKYPSDI ( EWS 401 ) respectively. A high lethality was noticed in EWS 306, EWS 289 and EWS 401 groups. When the effector /target cell ratio was 50 : 1, the lethalities in EWS 306, EWS 289 and EWS 401 groups were ( 20.2±1.8 ) %, ( 12.6±0.3 ) % and ( 11.9±0.2 ) % respectively. And while in the control group, the lethality was ( 6.7±0.1 ) %. When the effector / target cell ratio was 100:1, the lethalities in EWS 306, EWS 289, EWS 401 and the control groups were ( 51.2±3.7 ) %, ( 24.6±2.1 ) %, ( 17.8±0.9 ) % and ( 7.2±0.2 ) % respectively. There were statistically signifcant differences when the lethality between the EWS 306 group and the others was compared ( P<0.05 ). The number of secreted IFN-γ in EWS 306 group was 118.3±3.6, which was obviously higher than 35.1±1.0 in EWS 401 group, 34.2±0.9 in EWS 289 group and 5.0±0.1 in the control group ( P<0.05 ). The tumor volume was ( 978.9±28.2 ) mm3in EWS 306 group, which was obviously smaller than ( 1992.9±16.1 ) mm3in the negative control group and ( 2001.9±12.3 ) mm3in the blank control group. At the 35 day after inoculation, the survival rate in EWS 306 group was 80%, which was higher than 0% in the blank control group and 10% in the negative control group ( P<0.05 ). At 40 day after inoculation, the survival rate in the blank control group was reduced to 0%, and 80% in EWS 306 group was obviously higher than that of the other control groups ( P<0.05 ).ConclusionsStronger antitumor effects against DCs are noticed in EWS 306 when compared with that of EWS 289 and EWS 401. EWS 306 can effectively activate the lethal effects of CTLs against tumor cells and provide a new direction for the immunotherapy for Ewing's sarcoma.
Peptides; Drug screening assays, antitumor; Antineoplastic agents; Restrictive epitope peptide; Ewing's sarcoma
10.3969/j.issn.2095-252X.2014.10.015
R738.1
国家自然科学基金 ( 81472183 )
100091 北京,解放军第 309 医院全军骨科中心 ( 彭伟,黄迅悟,赵铭 );300060 天津医科大学附属肿瘤医院( 赵伟鹏 );400014 重庆医科大学附属儿童医院重点实验室 ( 杨大志 )
黄迅悟,Email: hxw309@163.com
2014-07-25 )

