开放式微波消融结合减压内固定治疗椎体转移瘤的随访报告
陈秉耀 韦兴 史亚民 李南 马云青 宋光泽 张增亮 王硕 侯树勋
开放式微波消融结合减压内固定治疗椎体转移瘤的随访报告
陈秉耀 韦兴 史亚民 李南 马云青 宋光泽 张增亮 王硕 侯树勋
目的评价开放微波消融技术和减压内固定技术结合治疗椎体转移瘤的初步临床结果。方法2006 年 3 月至 2010 年 12 月,本科收治的椎体转移瘤 76 例,男 48 例、女 28 例,年龄 34~80( 平均 57.4 )岁,累及单一椎体 51 例、2 个椎体受累 22 例、3 个椎体受累 3 例。累及胸椎 44 例、腰椎 16 例、颈椎 6 例、骶椎 2 例、颈胸段和胸腰段各 4 例。神经功能障碍 55 例,其中 6 例表现为脊髓完全损伤。Tomita 分型中,IV~VI 型占 88.2%。Tomita 预后评分主要集中在 3~6 分。采用开放微波消融和减压内固定结合的方法治疗。在行椎板减压后,经椎弓根置入微波刀头进行消融,通过盐水灌注维持椎管内温度以保护脊髓,辅以短节段椎弓根系统内固定。结果76 例均随访 2~57 个月,中位随访时间 24 个月。平均手术时间 120 min,术中平均出血 457 ml。术后疼痛缓解明显,疼痛 VAS 评分术前平均 6.4,术后 1 个月平均 2.2,与术前比较明显下降,差异有统计学意义( P<0.05 )。存活 54 例,其余 22 例在术后 2~33( 平均 9.9 )个月死亡,总生存率71%。术前存在神经功能障碍的 55 例中,除 6 例脊髓完全损伤者外,其余均恢复行走能力。复发 9 例,其中胸椎 6 例,腰椎 2 例,颈椎及骶椎各 1 例,复发率 12%,复发时间为术后 2~18( 平均 9.1 )个月。神经并发症3 例;伤口延迟愈合 6 例;继发感染 1 例,经清创手术后愈合;脑脊液漏 9 例、下肢深静脉血栓 3 例、肺部感染 3 例,均经保守治疗治愈。结论开放式微波消融结合减压内固定手术创伤相对较小、疼痛缓解理想、患者术后功能康复理想、局部控制率相对较高,是治疗椎体转移瘤一种可行的手段。
导管消融术;内固定器;减压术,外科;脊椎肿瘤;肿瘤转移
骨骼是除肺及肝脏外转移瘤第三好发部位,而椎体是骨转移最好发的部位。在脊柱肿瘤中转移癌占 95% 以上,在恶性肿瘤中 60% 以上会发生椎体转移。随着内科治疗手段的进步,即便晚期肿瘤发生了转移,也有可能获得较长的存活时间。其中椎体转移导致的骨折、疼痛及神经功能损害成为影响椎体转移瘤患者生存质量的重要因素,由其导致的卧床并发症也有可能危及患者生命。对椎体转移癌,如出现药物或放疗无法缓解的疼痛、神经功能损害进行性加重或神经压迫严重短期内可能导致严重神经功能丧失、脊柱稳定性严重破坏等情况时,应考虑手术治疗。传统的减压内固定手术虽然可以即刻达到稳定脊柱及神经减压的目的,但由于肿瘤残留,短期内可能导致症状复发。由于椎体整块切除及重建技术的操作复杂、时间长、创伤大,对晚期肿瘤患者不适合。2006 年以来,我们尝试将开放微波消融技术和减压内固定技术结合治疗椎体转移瘤,现介绍如下。
资料与方法
一、一般资料
2006 年 3 月至 2010 年 12 月,本科收治的椎体转移瘤 76 例,男 48 例、女 28 例,年龄 34~80( 平均 57.4 )岁,累及单一椎体 51 例、2 个椎体受累 22 例、3 个椎体受累 3 例。累及胸椎 44 例、腰椎 16 例、颈椎 6 例、骶椎 2 例、颈胸段和胸腰段各 4 例。神经功能障碍 55 例,其中 6 例表现为脊髓完全损伤。从原发灶来源来看,骨髓瘤、肺癌及淋巴瘤占据前三位,分别占 31%、21% 和 16%( 有人认为造血来源肿瘤属于骨原发肿瘤,但因其多骨发病特点,手术原则及方法选择和转移瘤类似,故本文将其归入 )。Tomita 分型中,IV~VI 型占 88.2%( 图1 )。本研究采用 Tomita 系统指导治疗方法的选择[1]。Tomita 预后评分主要集中在 3~6 分( 图2 )。经研究,采用开放微波消融技术和减压内固定技术结合的方法治疗椎体转移瘤。
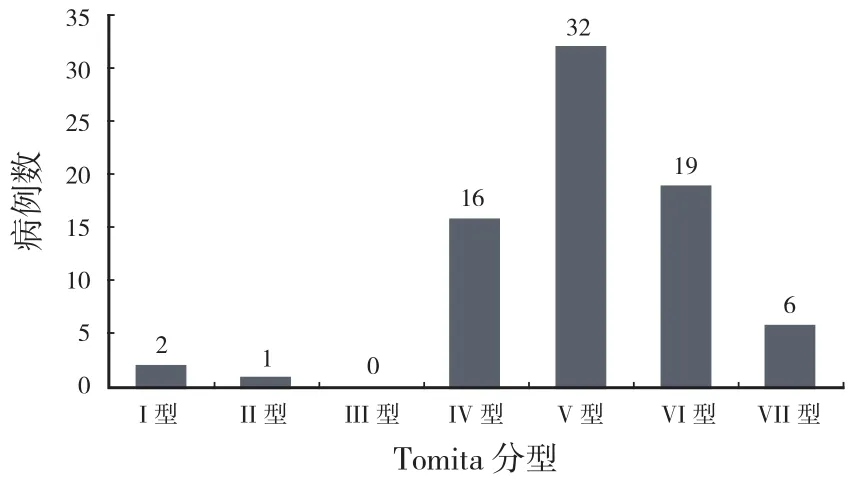
图1 Tomita 分型Fig.1 Tomita classifcation
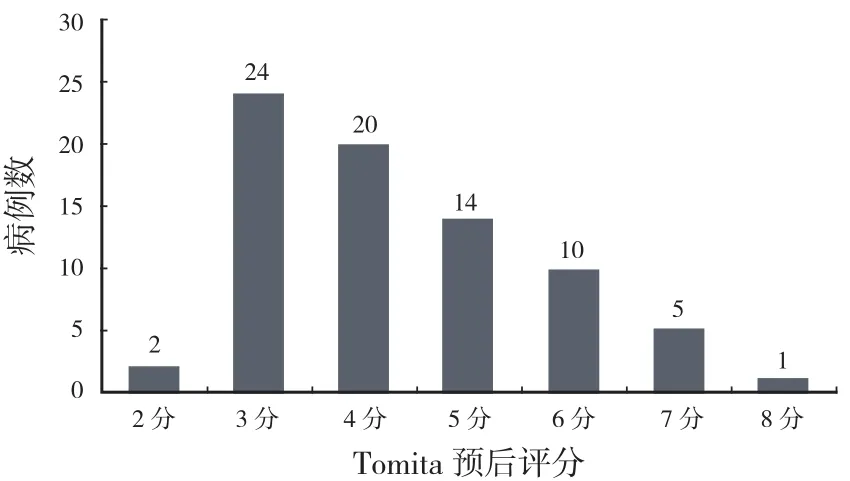
图2 Tomita 预后评分Fig.2 Tomita prognostic scores
二、手术方法
全麻俯卧位,取后正中入路,骨膜下剥离椎旁肌,显露至关节突外缘。先行椎弓根系统内固定,颈椎及腰椎上下各固定 1 个节段,胸椎、颈胸及胸腰交界区上下各固定 2 个节段,连续多个椎体受累行跨节段固定者,则多固定 1~2 个节段。完成固定后,对病椎行全椎板切除。经椎弓根置入微波刀头,椎体前缘及椎体后壁置热电偶测温针。消融功率 50 W,中心温度 80 ℃~100 ℃,消融过程中椎管内盐水灌洗降温,监测椎管内温度不超过 42 ℃、椎体前缘温度不超过 50 ℃,单点合并消融时间 10 min左右,根据肿瘤范围可调整微波刀头方向或深度重复消融。消融完成后,对椎管内肿瘤行彻底清除,椎体一般不行病灶刮除,对个别溶骨破坏严重者行椎体成形( 图3 )。
三、术后处理
术后引流 3~5 天,期间应用广谱抗生素预防感染。引流管拔除后戴支具下地( 颈椎病变佩戴颈托 )。伤口愈合后转内科行全身抗肿瘤治疗。
四、术后评估及随访
术前、术后 1 个月行疼痛视觉模拟评分( visual analog scale,VAS )[2]。术后每 3 个月复查 1 次,行平片、CT 或 MRI 扫描评价患者术后生存情况、神经功能、复发情况、并发症。
五、统计学分析
应用 SPSS15.0 软件行统计学分析。对疼痛评分行 t 检验。P<0.05 为差异有统计学意义。
结 果
随访截止时间 2011 年 12 月,所有病例均获2~57 个月的随访,中位随访时间 24 个月( 图4 )。手术时间 80~260 min,平均 120 min;术中出血量100~2500 ml,平均 457 ml。
一、疼痛评分
本组 76 例术前均有不同程度颈背部或腰骶部疼痛,其中 69 例伴根性疼痛症状,VAS 评分平均6.4。术后 1 个月平均 2.2,与术前比较明显下降,差异有统计学意义( P<0.05 )。
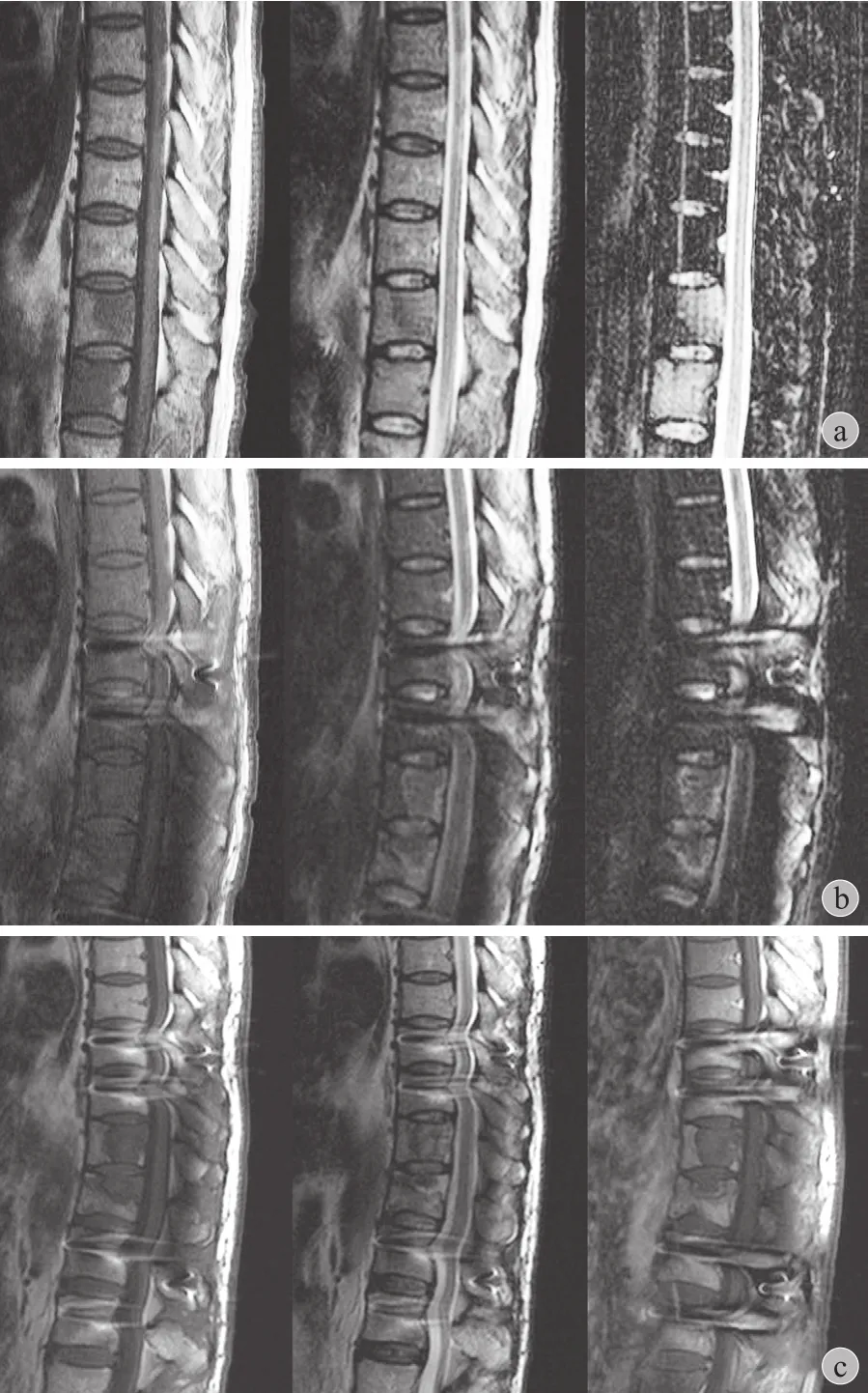
图4 患者,男,62 岁,肺癌 T11-12转移术后 MRI 随访 a:术前;b:术后 3 个月;c:术后 10 个月Fig.4 The MRI of a 62-year-old male patient after the operation of lung cancer metastases in T11-12 a: The preoperative MRI; b: The MRI at 3 months after the operation; c: The MRI at 10 months after the operation
二、生存情况
截止随访结束时,随访期内,存活 54 例,术后存活时间为 10~57( 平均 31.8 )个月;22 例死亡,术后死亡时间为 2~33 个月,平均生存期 9.9 个月。总生存率 71%。
三、神经功能
除 6 例脊髓完全损伤患者外,其余 49 例神经功能障碍者术后肌力均恢复,全部恢复行走能力。
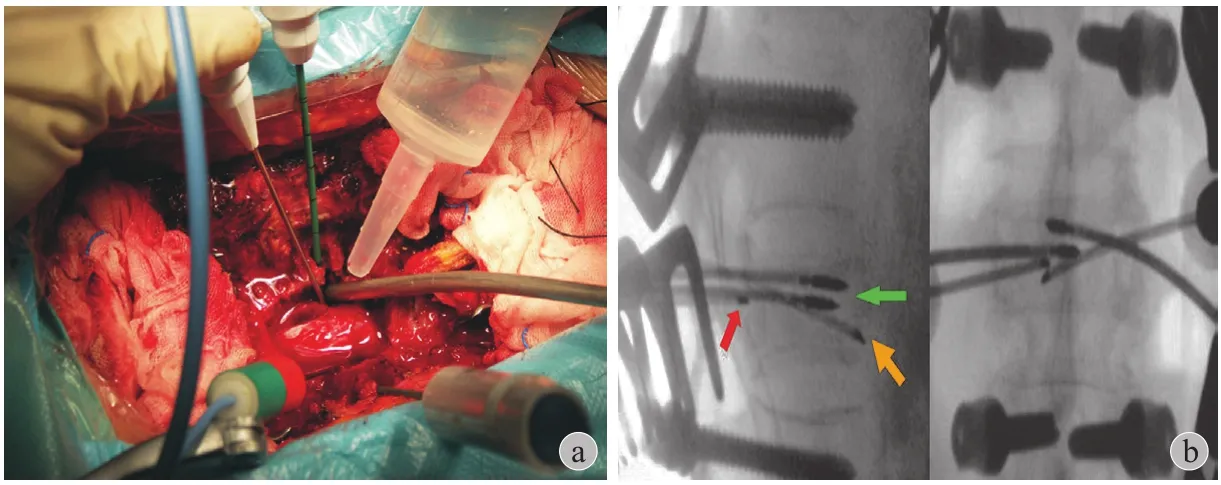
图3 微波消融过程 a:全椎板减压后,经双侧椎弓根置入微波刀头。消融过程中,椎管内盐水滴注降温,监测椎管内温度不超过 42 ℃、椎体前缘温度不超过 50 ℃;b:透视示微波刀头( 绿色箭头 )及测温针( 红色及黄色箭头 )位置Fig.3 The microwave ablation process a: Following total laminectomy, 2 microwave antennas were inserted via the bilateral pedicles. During the ablation, temperature was monitored with thermal needles and the dura was cooled with saline. The intraspinal temperature was lower than 42 ℃ and the temperature of the anterior vertebral body was lower than 50 ℃; b: Fluoroscopy showed the position of microwave antennas( green arrow )and the thermal needle anterior to the vertebrae( red arrow )and posterior to the vertebrae( yellow arrow )
四、复发情况
9 例复发,其中胸椎复发 6 例,腰椎 2 例,颈椎及骶椎各 1 例,复发率 12%。复发时间为术后2~18( 平均 9.1 )个月。
五、并发症情况
神经并发症 3 例:1 例 C5浆细胞瘤者术后出现交感干和 C5神经根损害,术后半年左右完全恢复;1 例 T12椎体肾透明细胞癌者术后脊髓损伤症状加重,术后 1 个月左右恢复;1 例术后腰椎出现根性感觉功能减退。伤口延迟愈合 6 例,其中放疗3 例、脂肪液化 3 例。继发感染 1 例,经清创手术后愈合。脑脊液漏 9 例、下肢深静脉血栓 3 例、肺部感染 3 例、均经保守治疗治愈。所有病例均无内固定松动断裂。
讨 论
20 世纪 80 年代以前,椎体转移癌的手术治疗仅限于出现严重的神经压迫时行椎板减压术,但由于没能恢复脊柱的稳定性,手术失败率很高。后来,随着脊柱内固定器械的广泛使用,减压内固定手术逐渐成为标准术式。近年来,整块全椎体切除手术、经皮射频或激光消融术、腔镜辅助微创手术等也在椎体转移癌治疗中得到应用[1,3-7]。但对椎体转移癌手术指征及具体手术方式的选择一直存在争议。有人提出一些预后评分系统用于指导治疗及具体手术方式的选择,常用的有 Tomita 及 Tokuhashi评分系统。本研究采用 Tomita 系统,该系统按原发病灶恶性程度、实质脏器是否转移、转移灶是否可以治愈、骨转移灶为单发还是多发进行评分[1,8]。5 分以下预计可较长期存活,应行局部肿瘤切除;6~7 分预计存活期有限( 半年至1 年),可行姑息性手术;8 分以上可能短期存活( 不足 3 个月 ),不宜手术治疗而应行对症支持治疗。本组病例 Tomita 评分≤6 分的 70 例( 占 92% ),施行手术治疗是合适的,另有 5 例评分 7 分、1 例 8 分,术后症状缓解虽然较为理想,但存活时间均不足半年、其中最短者 2 个月,对这样的患者是否手术、采用何种手术方式,应结合患者的症状及意愿慎重考虑。
椎体肿瘤切除,一般分后路刮除和前路椎体次全切,均为囊内切除,术后短期内肿瘤复发的风险仍较大,且瘤内操作可能导致大量出血。近 10 年来,全椎体整块切除( total en bloc spondylectomy, TES )技术不断完善,使得椎体肿瘤的边缘甚至广泛切除成为可能,但其操作复杂、风险高、时间长、创伤大,有些可能出现难以控制的大出血。目前就 TES 来说,只能部分达到边缘甚至囊内切除的效果。Boriani 等[9]对 134 例椎体肿瘤行 TES,达到广泛切除者 88 例( 65.7% )、边缘切除者 27 例( 20.1% )、囊内切除者 19 例( 14.2% )。而且由于陡峭而漫长的学习曲线,该手术的普遍开展存在困难。因此,除了个别预后良好的椎体孤立性转移,对多数经过放化疗的晚期肿瘤患者,是否适合施行该手术值得商榷。国内从 20 世纪 80 年代初开始将微波消融技术用于骨肿瘤的治疗,但主要用于四肢骨肿瘤的治疗,用于椎体肿瘤者仅见个别报道[10-12]。我科自 2006 年开始探索在减压内固定的基础上对病椎实施原位微波消融,初步肯定了该方法的安全性和有效性[13]。微波消融能否达到肿瘤彻底灭活,更多取决于术者的经验,在透彻了解影像学资料的基础上,术中通过调整微波刀头的置入深度、方向及参考点的测温来实现。
我们的治疗思路是:在充分脊髓暴露并有效地盐水灌洗降温的基础上,通过插入式微波刀头对椎体肿瘤进行热消融,达到肿瘤灭活的目的,可通过双侧置入微波刀头并调整其深度及方向,进行肿瘤全方位灭活,灭活完成后,由于保留了失活的骨壳,进行常规的后路椎弓根系统内固定即可重建脊柱稳定性。本组病例平均手术时间 2 h,平均术中出血不足 500 ml。该手术方式和传统的后路减压内固定相比,仅增加 30 min 左右微波消融时间,且在消融过程中基本不增加新的出血,其手术创伤及出血与后路减压内固定手术相当。由于不行肿瘤刮除或是在肿瘤消融后刮除,与直接肿瘤刮除或椎体次全切相比,出血量也会降低;和 TES 相比,手术时间和出血量更是大大降低。在刚刚开展这项工作时,我们曾担心微波消融可能导致较高的脊髓损伤风险。但目前的结果表明,在充分的椎板减压和脊髓暴露的基础上,辅以持续的盐水灌洗降温和椎管内温度监测,这一风险是完全可控的。为了进一步降低脊髓损伤风险,我们拟设计隔热垫,在消融时置入椎管后方。其并发症中,伤口延迟愈合和脑脊液漏相对发生率较高,前者可能和部分患者术前接受放疗相关,后者多数是因为肿瘤侵犯椎管并和硬膜粘连,在病灶清除时导致硬膜微小裂孔。关于肿瘤的控制率,本组病例随访期间复发率低,为 12%。
开放式微波消融结合减压内固定手术创伤相对较小、疼痛缓解理想、患者术后功能康复理想、局部控制率相对较高,是治疗椎体转移瘤一种可行的手段。我们今后的努力方向是实现消融技术的标准化和消融效果判定的客观性。目前,我们正在开展不同功率、不同作用时间下椎体内微波消融范围的研究。在得到可靠的数据后,我们将在肿瘤图像重建的基础上,利用计算机模拟系统设计微波刀头的空间排布及间距,然后利用数字化骨科及 3D 打印技术,制作个体化的 3D 导板来实现微波刀头的准确置入。
[1] Tomita K, Kawahara N, Murakami H, et al. Total en bloc spondylectomy for spinal tumors: improvement of the technique and its associated basicbackground. J Orthop Sci, 2006, 11(1):3-12.
[2] Jensen MP, Karoly P. Self-report scales and procedures for assessing pain in adults. In: Turk DC, Melzack R editor. Handbook of pain assessment. 2nd edition. New York: Guilford Press, 2001: 15-34.
[3] Liljenqvist U, Lerner T, Halm H, et al. En bloc spondylectomy in malignant tumors of the spine. Eur Spine J, 2008, 17(4): 600-609.
[4] Rao G, Suki D, Chakrabarti I, et al. Surgical management of primary and metastatic sarcoma of the mobile spine. J Neurosurg Spine, 2008, 9(2):120-128.
[5] Gevargez A, Groenemeyer DH. Image-guided radiofrequency ablation (RFA)of spinal tumors. Eur J Radiol, 2008, 65(2): 246-252.
[6] Ahn H, Mousavi P, Chin L, et al. The effect of pre-vertebroplasty tumor ablation using laser-induced thermotherapy on biomechanical stability andcement fll in the metastatic spine. Eur Spine J, 2007, 16(8):1171-1178.
[7] Rosenthal D. Endoscopic approaches to the thoracic spine. Eur Spine J, 2000, 9(1):S8-16.
[8] Tokuhashi Y, Matsuzaki H, Oda H, et al. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis. Spine, 2005, 30(19):2186-2191.
[9] Boriani S, Biagini R, De Iure F, et al. En bloc resections of bone tumors of the thoracolumbar spine. A preliminary report on 29 patients. Spine, 1996, 21(16):1927-1931.
[10] 范清宇, 马保, 周勇, 等. 恶性或侵袭性骨肿瘤患者的微波高温治疗. 中华外科杂志, 1997, 35(8):484-487.
[11] 范清宇, 马保安, 周勇, 等. 肢体恶性骨肿瘤的微波高温原位灭活保肢术. 中国矫形外科杂, 2009, 17(11):801-806.
[12] 沈万安, 范清宇, 张明华, 等. 微波诱导高温原位灭活技术治疗椎体肿瘤. 现代肿瘤医学, 2007, 15(3):401-404.
[13] 朱方正, 韦兴, 史亚民, 等. 微波诱导高温原位灭活治疗脊柱恶性肿瘤的临床初步观察. 中国骨肿瘤骨病, 2008, 7(2): 96-99.
为支持多中心协作研究项目,可以在论文首页下方脚注“各协作单位第一作者均为本文的第一作者”。
Open microwave ablation combined with decompression and internal fxation for vertebral metastases: a follow-up report
CHEN Bing-yao, WEI Xing, SHI Ya-min, LI Nan, MA Yun-qing, SONG Guang-ze, ZHANG Zeng-liang, WANG Shuo, HOU Shu-xun. Department of Orthopedics, the frst Affliated Hospital of the General Hospital of CPLA, Beijing, 100048, PRC
ObjectiveTo evaluate the clinical outcomes of open microwave ablation combined with decompression and internal fxation in the treatment of vertebral metastases.MethodsFrom March 2006 to December 2010, a total of 76 patients with vertebral metastases were adopted, including 48 males and 28 females. Their average age was 57.4 years old( range; 34-80 years ). One single vertebral body was involved in 51 cases, 2 vertebral bodies in 22 cases and 3 vertebral bodies in 3 cases. Lesions were found in the thoracic vertebra( n=44 ), the lumbar vertebra( n=16 ), the cervical vertebra( n=6 ), the sacral vertebra( n=2 ), the cervicothoracic segment( n=4 )and the thoracolumbar segment( n=4 ). Among the 55 patients with neurological deficits, 6 patients had complete spinal cord injuries( SCI ). According to the Tomita classifcation system, 88.2% of the patients belonged to type IV-VI. The Tomita prognostic scores were 3-6 points in most patients. Patients underwent the treatment of open microwave ablation combined with decompression and internal fixation. Following laminectomy, microwave antennas were inserted into the vertebra via the pedicles to induce ablation. During this process, the spinal canal was cooled with saline to protect the spinal cord. Short-segment pedicle fxation was used as an assistance.ResultsAll the patients were followed up for 2-57 months, and the median follow-up time was 24 months. The mean operation duration was 120 min, and the intraoperative blood loss was 457 ml on average. Pain was obviously relieved after the operation. The mean Visual Analogue Score( VAS )was 6.4 points before the operation, which was decreased to 2.2 points at 1 month after the operation. There were statistically signifcant differences between them( P<0.05 ). The total survivalrate was 71%, with 54 patients alive and 22 patients dead at 9.9 month after the operation on average( range; 2-33 months ). Among the 55 patients with neurological defcits before the operation, 49 patients gained walking ability and the 6 patients with complete SCI did not. Recurrence occurred to 9 cases, with 6 cases in the thoracic vertebra, 2 cases in the lumbar vertebra, 1 case in the cervical vertebra and 1 case in the sacral vertebra. The recurrence rate was 12%, and the mean recurrence time was 9.1 months( range; 2-18 months ). Neurological complications were found in 3 cases, and delayed healing of wounds in 6 cases. One patient with secondary infection recovered after debridement. Conservative treatment was performed on 9 patients with cerebrospinal fuid leakage, 3 patients with lower limb deep venous thrombosis and 3 patients with pulmonary infection, who all recovered.ConclusionsOpen microwave ablation combined with decompression and internal fxation is a potentially promising technique in the treatment of vertebral metastases, with the advantages of minimal trauma, well relieved pain, good postoperative functional recovery and higher local control rate.
Catheter ablation; Internal fxators; Decompression, surgical; Spinal neoplasms; Neoplasm metastasis
10.3969/j.issn.2095-252X.2014.05.006
R738.1, O411
100048 北京,解放军总医院第一附属医院骨科、全军骨科研究所
韦兴,Email: 304ortho@sohu.com
2014-02-21 )
( 本文编辑:代琴 )
关于作者姓名、单位在论文中的脚注方法
因毕业、工作调动或进修结束等情况单位变动时,论文署名单位应为原单位,介绍信也应由原单位加盖公章批准。刊出时可另行注明第一作者现在工作单位及相应的科室、邮编。
2. 集体署名作者:凡集体署名的论文,于文末写出“(××× ××× ×××整理)”的同时,一律在论文首页下方脚注通信作者有关信息。通信作者由投稿者自行决定。( 1 )署名单位只有一个时,脚注中只列出通信作者的姓名、邮政编码、Email 地址。署名单位超过一个时,脚注中还应加列通信作者的工作单位。( 2 )协作组署名时,需在文末参考文献前列出整理者姓名( 方法同前 )及协作组成员。在“协作组成员:”字后列出协作组各单位名称,单位名称后括号内列出参加者姓名。同时脚注:“通信作者:姓名,单位,邮政编码、Email 地址”。
1. 个人作者署名:在论文首页下方进行脚注。“作者单位:”后面列出邮政编码、城市和作者单位( 具体到科室 )。个人作者超过一位时,可请作者自行指定一位通信作者( corresponding author ),亦即对选题、科研设计起主要作用者,参与论文撰写并能解答编辑部、读者疑问,对论文负全部责任者;在按原格式列出各位作者单位后,另起一行在“通信作者:”字样后列出通信作者姓名、邮政编码、单位名称、Email 地址。

