基于嵌合抗原受体的肿瘤免疫治疗
伍玉婷,梁华晟
·技术与方法·
基于嵌合抗原受体的肿瘤免疫治疗
伍玉婷,梁华晟
肿瘤可通过下调激发机体免疫系统必需成分的表达,或通过分泌免疫抑制因子等机制逃避机体的免疫监视和攻击,从而得以在体内生存和恶性增殖。利用基因工程技术修饰T细胞,设计一种可特异性识别肿瘤相关抗原的嵌合抗原受体,使其同时兼具细胞免疫治疗和抗体免疫治疗的优点,是近年来迅速发展的肿瘤过继免疫治疗方法。
嵌合抗原受体;过继免疫治疗
过继免疫疗法是将体外活化和扩增的自体或异体免疫效应细胞输给免疫功能低下者,使其获得抗肿瘤免疫力的一种免疫疗法。然而在过去的20年当中,传统过继免疫疗法对卵巢癌、结肠癌、乳腺癌等大多数肿瘤的治疗均未取得令人满意的疗效。近年来,以嵌合抗原受体(chimeric antigen receptor,CARs)修饰T细胞为代表的肿瘤靶向免疫治疗具有高效的特异性,主要组织相容性复合体(major histocompatibility complex,MHC)非限制性、持久的体内免疫活性等特点,一旦与靶细胞结合,胞内信号转导区将信号传入T细胞,激活T细胞,分泌多种细胞因子[穿孔素、颗粒酶、干扰素(interferon,IFN)-γ、肿瘤坏死因子(tumor necrosis factor,TNF)-α等],通过细胞毒活性和局部炎症等旁效应发挥抗肿瘤作用,使得过继免疫疗法重新焕发出新的生命力。
1 CARs的发展
1987年,Kuwana[1]课题组首次将免疫球蛋白的V区与T细胞抗原受体(T cell receptor,TCR)的α和β链的恒定区融合,构建了可特异识别肿瘤细胞的CAR-T细胞原型。第一代CARs是由单链可变区结构域(single chain Fvdomain,scFv)和免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)连接而成的,由于其修饰的T细胞增殖能力和细胞因子分泌水平低下,无法提供持续的体内抗肿瘤效应而逐渐淘汰。近来引入CD28、4-1BB、OX40、DAP10等共刺激分子(costimulatory molecule,CM),设计出以scFv-CM-ITAM嵌合模式为特点的第二代(单共刺激分子)和第三代CARs(双共刺激分子),有效刺激了T细胞的持久增殖,提升了细胞杀瘤活性,延长了细胞存活时间,促进细胞因子的释放(图1),在淋巴瘤[2]、卵巢癌[3]、神经母细胞瘤[4]、慢性淋巴细胞性白血病[5]等疾病的临床应用研究中取得了不俗的成绩。

图1 三代嵌合抗原受体
2 CARs的肿瘤免疫治疗效应
CAR-T细胞通过scFv与靶细胞胞外抗原特异结合,将信号传入T细胞从而激活T细胞,从而通过分泌穿孔素、颗粒酶等发挥直接细胞毒作用,通过Fas/FasL途径诱导肿瘤细胞凋亡,通过白介素(interleukin,IL)-2、IFN-γ、粒细胞集落刺激因子、TNF-α等细胞因子产生的旁效应发挥抗肿瘤作用,通过炎性细胞因子引起肿瘤局部炎症反应,还可通过干扰肿瘤组织的血管营养系统、激发机体的免疫效应细胞等发挥抗肿瘤效应[6]。IL-2是最早用于过继免疫治疗的细胞因子,它具有激活和扩增T、B细胞,增强自然杀伤细胞杀伤活性,诱导杀瘤细胞产生的作用,还能促IFN、TNF等重要细胞因子的分泌。研究证明,外源性IL-2的加入对于T细胞的激活和增殖、免疫功能的发挥都具有重要作用,Kochenderfer等[7]在以抗CD19的CAR-T细胞治疗B细胞恶性肿瘤时辅用大剂量IL-2,使得B细胞淋巴瘤消退、患者B细胞前体消除。CARs介导的抗肿瘤免疫效应是多种多样的,构建更稳定表达、更能持续增殖、更高靶分子亲合力、更强细胞裂解活性的CAR-T细胞是今后的努力方向。
3 CARs在肿瘤免疫治疗中的临床研究
3.1 临床试验 尽管当前针对肿瘤等疾病开发的CAR-T种类多样(图2),然而这种免疫治疗法从实验室走向临床研究历经波折。1994年Roberts等[8]首次将CAR-T细胞应用于临床试验,以CAR-T细胞成功杀伤人类免疫缺陷病毒感染的CD4+T细胞。而CAR-T的临床应用却没有这么顺利,CARs的首次临床应用结果是由Lamers等[9]在2006年公布的,以靶向碳酸酐酶Ⅸ的CAR-T细胞治疗3例转移性肾细胞癌患者并未观察到预期的临床效应。直到2008年这种免疫疗法才获得了真正意义上令人兴奋的临床研究结果,在以非洲淋巴细胞病毒特异性T细胞治疗的11例儿童成神经细胞瘤中,有6例取得了肿瘤灶变小和坏死的成效[10]。2011年美国某研究小组以二代CD19-CAR-T细胞靶向治疗了3例慢性淋巴细胞白血病,尽管伴随有淋巴细胞减少症的发生,但是CAR-T细胞在患者血和骨髓中持续了6个月的高水平表达,其中有2例病情达到完全缓解的程度[5]。2013年Grupp等[11]发表了一篇针对急性淋巴性白血病的案例,以抗CD19+的CAR-T细胞治疗2例儿童;其中,1例在11个月中病情均表现为完全缓解;另1例患者则在缓解了2个月后复发,并且体内爆发了大量的不表达CD19的癌细胞,其中的原因值得人们深思。
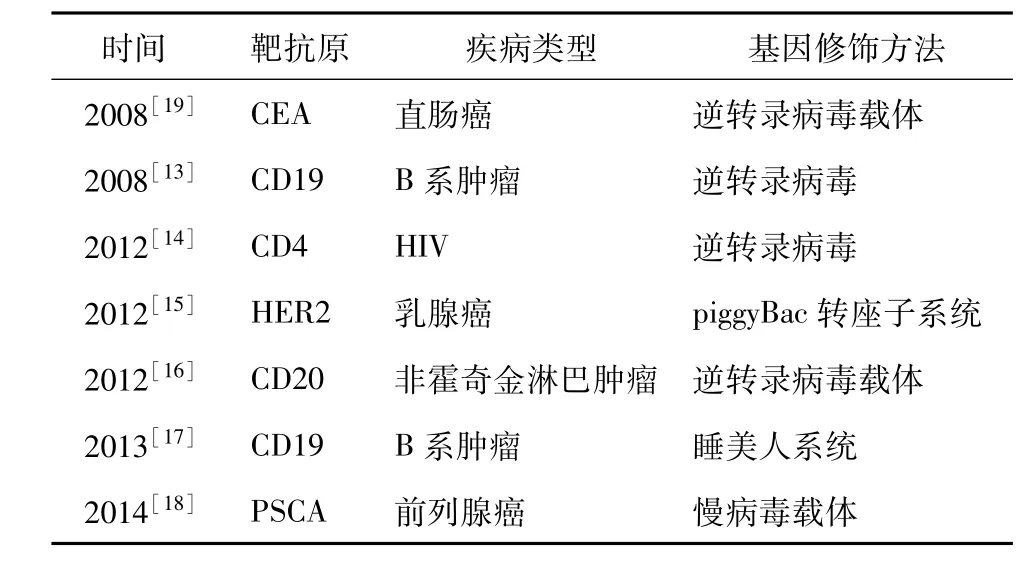
表1 嵌合抗原受体修饰T细胞的临床应用
3.2 面临的问题
3.3.1 “脱靶效应”(off-target effects) 越来越多的临床试验暴露出CAR-T细胞的安全问题。大多数靶抗原在正常组织中也会有少量的表达,CAR-T细胞与这类抗原起反应而引起组织损伤,即为“脱靶效应”。2006年Lamers等[19]应用靶向G25O抗原的CAR-T细胞治疗肾细胞癌,正常G25O+胆管细胞受到损伤,有3例发生了2~4级的肝脏毒性,经皮质类固醇药物治疗后肝脏毒性减轻,这是首次报道的嵌合抗原受体淋巴细胞疗法引起的脱靶效应。最近,研究人员应用第三代靶向HER2/neu的CART淋巴细胞治疗1例晚期直肠癌患者致患者死亡[20]。该患者在静脉输注1010表达HER2/neu的CAR-T细胞15 min后开始呼吸窘迫,40 min后肺部水肿,随时间进行性加重,在给予心脏复苏、气管插管及提升血压处理后治疗无效死亡。推测由于肺、肝脏等正常组织均表达HER2/neu抗原,高剂量的CAR-T细胞引起了脱靶效应,导致患者多器官衰竭而死。
3.3.2 细胞因子风暴 第二、三代CARs中引入了单或双共刺激分子,信号泄漏或T细胞激活阈值的降低可能造成炎症细胞因子如TNF-α、IL-1、IL-6、IL-12、IFN-α、IFN-γ等大量释放入血,进而引起以急性呼吸窘迫综合征和多器官功能衰竭为主的“细胞因子风暴”。例如在上述Morgan研究组的直肠癌患者死亡的案例中,肺脏水肿及随后引起的多器官衰竭即与大量细胞因子的释放有关,级联性的“细胞因子风暴”最终造成了患者的死亡[20]。
3.3 解决方法 2010年美国重组DNA咨询委员会针对CAR-T细胞临床试验中出现的安全问题提出了几点建议[21]:第一,引入自杀基因的人工调控开关,发生相关的毒性反应时通过诱导转染自杀基因的T细胞凋亡而减轻毒性反应;第二,严格按Ⅰ期临床试验进行治疗,从低剂量的T细胞数目开始输注,防止速发的细胞毒性;第三,构建双靶抗原CARs,提高肿瘤靶向性;第四,在应用第二、三代CAR-T细胞治疗时应不使用或谨慎使用IL-2,降低潜在细胞毒性;第五,通过低剂量多次输注CARs修饰中枢记忆T细胞和干细胞样记忆T细胞可建立免疫记忆的潜能、增加抗肿瘤特异性和减少对健康组织的损伤。
4 展望
1989年至今,嵌合抗原受体的肿瘤免疫治疗方法已取得了长足的进步,由第一代发展到双信号和三信号的第二、三代,具有更好的免疫活性、更高的增殖率和更长的存活时间。越来越多的研究人员正投入到对嵌合抗原受体肿瘤免疫治疗方法的完善和拓展当中,前期Ⅰ/Ⅱ期临床研究取得的成果显示着这项技术的巨大潜力。相信通过不断摸索优化更安全有效的临床治疗策略,克服其不良反应将会使得这一过继性免疫疗法焕发出更璀璨的光芒。
[1]Kuwana Y,Askauar Y,Utsonmiya N,et al.Expression of chimeric receptor composed of immunoglobulin-derived V regions and T-cell receptor-derived C regions[J].Biochem Biophys Res Common,1987,149(3):960-968.
[2]Kochenderfer JN,Rosenberg SA.Treating B-cell cancer with T cells expressing anti-CD19 chimeric antigen receptors[J].Nat Rev Clin Oncol,2013,10(5):267-276.
[3]Lanitis E,Poussin M,Hagemann IS,et al.Redirected antitumor activity of primary human lymphocytes transduced with a fully human anti-mesothelin chimeric receptor[J]. Mol Ther,2012,20(3):633-643.
[4]Cheadle EJ,Sheard V,Hombach AA,et al.Chimeric antigen receptors for T-cell based therapy[J].Methods Mol Biol,2012,907:645-666.
[5]Porter DL,Levine BL,Kalos M,et al.Chimeric antigen receptor modified T cells in chronic lymphoid leukemia[J]. N Engl JMed,2011,365(8):725-733.
[6]Logan TF,GoodingWE,Whiteside TL,et al.Biological response modulation by tumor necrosis factor alpha(TNF alpha)in a phase Ib trial in cancer patients[J].Immunother,1997,20(5):387-398.
[7]Kochenderfer JN,Wilson WH,Janik JE,et al.Eradication of Blineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19[J].Blood,2010,116(20):4099-4102.
[8]Roberts MR,Qin L,ZhangD,et al.Targeting of human immunodeficiency virus-infected cells by CD8+T lymphocytes armed with universal T-cell receptors[J].Blood,1994,84(9):2878-2889.
[9]Lamers CH,Sleijfer S,Vulto AG,et al.Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydraseⅨ:first clinical experience[J].Clin Oncol,2006,24(13):20-22.
[10]Pule MA,Savoldo B,Myers GD,et al.Virus-specific T cells engineered to coexpress tumor-specific receptors:persistence and antitumor activity in individuals with neuroblastoma[J].NatMed,2008,14(11):1264-1270.
[11]Grupp SA,Kalos M,Barrett D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J].N Engl JMed,2013,368(16):1509-1518.
[12]Em tage PC,Lo AS,Gomes EM,et al.Second-generation anti-carcinoembryonic antigen designer T cells resist activation-induced cell death,proliferate on tumor contact,secrete cytokines,and exhibit superior antitumor activity in vivo:a preclinical evaluation[J].Clin Cancer Res,2008,14(24):8112-8122.
[13]Kochenderfer JN,Dudley ME,Feldman SA,et al.B-cell depletion and remissions of malignancy along with cytokine associated toxicity in a clinical trialofanti-CD19 chimeric-antigen receptor-transduced T cells[J].Blood,2012,119(12):2709-2720.
[14]Scholler J,Brady TL,Binder-Scholl G,et al.Decade-long safety and function of retroviral-modified chimeric antigen receptor T cells[J].Sci Transl Med,2012,4(132):132ra53.
[15]Saha S,Nakazawa Y,Huye LE,et al.piggyBac transposon system modification of primary human T cells[J].J Vis Exp,2012(69):e4235.
[16]Till BG,Jensen MC,Wang J,etal.CD20-specific adoptive immunotherapy for lymphoma using a chimeric antigen receptor with both CD28 and4-1BBdomains:pilot clinical trial results[J].Blood,2012,119(17):3940-3950.
[17]Maiti SN,Huls H,Singh H,et al.Sleeping beauty system to redirect T-cell specificity for human applications[J].J Immunother,2013,36(2):112-123.
[18]Hillerdal V,Ramachandran M,Leja J,etal.Systemic treatment with CAR-engineered T cells against PSCA delays subcutaneous tumor growth and prolongs survival ofmice[J].BMC Cancer,2014,14:30.
[19]Lamers CH,Langeveld SC,Groot-van Ruijven CM,et al. Gene-modified T cells for adoptive immunotherapy of renal cell cancer maintain transgene-specific immune functions in vivo[J].Cancer Immunol Immunother,2007,56(12):1875-1883.
[20]Morgan RA,Yang JC,kitano M,etal.Case reportof a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2[J].Mol Ther,2010,18(4):843-851.
[21]Ertl HC,Zaia J,Rosenberg SA,etal.Considerations for the clinical application of chimeric antigen receptor T cells:observations from a recombinant DNA Advisory Committee Symposium held June 15,2010[J].Cancer Res,2011,71(9):3175-3181.
Chimeric antigen receptor for immunotherapy of cancer
WU Yuting,LIANG Huasheng
(Cellular and Molecular Clinical Medicine Research Center of Wu Jieping Medical Foundation,Beihai People′s Hospital,Beihai Guangxi 536000,China;)
Down-regulating the necessary component of immune system and suppressing production of immunosuppressive factors results in the tumor immune escape.Recently,the genetic modification of T cellswith chimeric antigen receptors(CARs)was designed to solve themechanism of escape immunosurveillance.The unique structure of CARs endows T cell tumor specific cytotoxicity and tumor antigen recognition ability.This adoptive antitumor immunotherapy develops rapidly and brings hope to the patients with tumors.
Chimeric antigen receptors(CARs);Adoptive immunotherapy
R730.51
A
2095-3097(2014)02-0108-04
10.3969/j.issn.2095-3097.2014.02.012
2014-02-17 本文编辑:冯 博)
第十四批(2011年度)广西“新世纪十百千人才工程”第二层次人选专项资金资助
536000广西北海,北海市人民医院吴阶平医学基金会细胞与分子临床医学研究中心(伍玉婷,梁华晟)

