口腔全菌生物膜对新型抗菌性复合树脂表面粗糙度的影响
梅 美,李晓蕾,张 宁
·技术与方法·
口腔全菌生物膜对新型抗菌性复合树脂表面粗糙度的影响
梅 美,李晓蕾,张 宁
目的体外培养口腔菌斑生物膜,研究口腔全菌生物膜对含有甲基丙烯酸十二烷基二甲铵(dimethylaminododecylmethacrylate,DMADDM)的抗菌复合树脂材料表面粗糙度的影响,从而评价材料的性能及其临床应用前景。方法合成DMADDM并将其添加入复合树脂中,将含有和不含有DMADDM的复合树脂作为实验组和对照组,使用人唾液培养所得到牙菌斑全菌生物膜模型来研究生物膜,检测菌落形成单位(colony forming unit,CFU)计数及生物膜活/死细菌染色,并检测口腔全菌生物膜培养7 d前后实验组和对照组材料表面粗糙度的差异。结果添加DMADDM的实验组复合树脂显著降低了CFU计数(P<0.01),与对照组比较,实验组的3个CFU计数均降低了3个数量级。菌斑生物膜培养7 d后,实验组复合树脂表面粗糙度没有明显变化(P>0.05),而对照组复合树脂表面粗糙度明显增加(P<0.01)。结论含有DMADDM的复合树脂材料具有很强的抗菌性,能够抵抗口腔环境对材料表面老化粗糙的影响,具有一定的临床应用前景。
复合树脂;菌斑生物膜;抗菌性能;表面粗糙度
复合树脂因具有优良的美学效果,以及简便的临床操作过程等优势,近年来被广泛应用于修复牙体缺损和改善牙齿外观[1]。但研究表明,较其他口腔修复材料,复合树脂更容易在表面堆积菌斑生物膜[2]。菌斑生物膜是引起继发龋和修复失败的主要原因[3],一方面会直接引起某些口腔软硬组织感染性疾病如继发龋、义齿性口炎;另一方面则能造成材料的老化粗糙,导致材料性能下降,从而更易吸引细菌黏附[4]。这样的恶性循环最终将会造成修复失败,甚至对全身产生不良影响。因此,研究抗菌复合树脂,抑制菌斑生物膜生长和继发龋发生至关重要。季铵盐类的单体,如甲基丙烯酸十二烷基二甲铵(dimethylaminododecyl methacrylate,DMADDM),可以共聚合到树脂基之中,使其产生抗菌活性,且不损害树脂的机械性能[5]。可聚合季铵盐是一种有效的抗菌单体,它的分子结构中同时具有能与树脂单体发生反应的可聚合基团和抗菌功能基团,单体通过聚合反应牢牢固定于树脂基质上,在固化后抗菌活性成分不释放,发挥持久、稳定的接触抗菌功能[6]。本研究在体外培养口腔菌斑生物膜,研究口腔全菌生物膜对含有DMADDM的抗菌复合树脂材料表面粗糙度的影响,从而评价材料的性能及其临床应用前景。
1 材料与方法
1.1 含有DMADDM的抗菌复合树脂的制备
DMADDM烷基链长为12个碳。使用改良门舒特金法(Menschutkin)制备DMADDM,由叔胺基与有机卤化物发生反应[5]。将2-溴乙基甲基丙烯酸酯(2-bromo ethylmethacrylate,BEMA)作为有机卤化物,1-二甲氨基十二烷(1-dimethylamino dedecane,DMAD)作为叔胺。将10mmol的DMAD(日本,Tokyo Chemical Industry公司),10 mmol的BEMA(美国,Monomer-Polymer and Dajac Labs),以及3 g乙醇加入20 mL的试剂瓶中。试剂瓶封口,并在70℃中搅拌24 h。反应完全后蒸发乙醇溶剂,最终得到清澈、无色的黏性液态DMADDM。
双酚A-甲基丙烯酸缩水甘油酯和双甲基丙烯酸二缩三乙二醇酯(美国,Esstech公司)按照1∶1混合,并混入0.5%的光引发剂樟脑醌,从而构成树脂基质[5]。DMADDM按1∶10混入树脂基质中。预实验显示,DMADDM大于10%将影响复合树脂的机械强度。树脂基质与经过硅烷化处理的无机填料(美国,Caulk Dentsply公司)按3∶7混合。将含DMADDM的复合树脂作为实验组,将不含DMADDM的复合树脂作为对照组。
每个试件均制作成直径10 mm、厚2 mm的圆柱形试件,制作时两面用赛璐珞条形成光滑压接面。每个试件每个表面光固化1min,然后将试件浸入蒸馏水,搅拌1 h,以除去任何未固化的单体。取出试件干燥并用环氧乙烷消毒(Anprolene AN 74i,美国,Andersen公司)。每个测试,每组6个试件。
1.2 人唾液的收集和菌斑生物膜的形成 人唾液[7]的捐赠者是拥有天然牙列,无活动性龋病或牙周病的健康成年人,并在过去的3个月内没有使用过抗生素。捐赠人24 h不刷牙,并在捐赠唾液前至少2 h禁饮食。收集捐赠者在咀嚼封口膜的过程中分泌的刺激性唾液,并置于冰上。唾液在无菌甘油中稀释至70%,并储存在-80℃下[8]。
唾液与McBain培养基溶液以1∶50混合作为人全菌生物膜的接种液。McBain培养基中含有黏蛋白2.5 g/L、细菌蛋白胨2.0 g/L、胰蛋白胨2.0 g/L、酵母提取物1.0 g/L、氯化钠0.35 g/L、氯化钾0.2 g/L、氯化钙0.2/L、盐酸半胱氨酸0.1 g/L、血红素0.001 g/L、维生素K10.000 2 g/L,材料均购自美国Sigma-Aldrich公司,pH值调整为7[9]。将接种液在37℃下,含5%CO2的培养箱中培养24 h。24孔培养板每个孔放入1个试件,各孔中加入1.5mL接种液,在37℃含5%CO2的培养箱中培养8 h。然后将试件转移至新的24孔板中,用新鲜McBain培养基继续培养。16 h后,将试件转移至新的24孔板中用新鲜McBain培养基继续培养24 h,最终得到培养2 d的菌斑生物膜。
1.3 生物膜活/死细菌染色方法 使用前面提到的培养2 d的菌斑生物膜进行检测。将圆柱形试件上的生物膜在磷酸盐缓冲盐水(phosphate buffered saline,PBS)中轻柔漂洗3次,用活/死细菌生存力试剂盒(美国,Molecular Probes公司)进行染色。SYTO-9使活细菌染色产生绿色荧光,细胞膜受损的细菌会被碘化丙啶染色产生红色荧光。使用萤光显微镜观察染色的生物膜(TE2000-S,美国,Nikon公司)。
1.4 CFU计数 将培养2 d的菌斑生物膜圆柱形试件转移到2 mL试管中,通过超声震动收获生物膜,再用涡旋混合震荡仪混匀(美国,Fisher公司)。使用3种琼脂平板培养测定CFU。首先,用胰蛋白大豆血琼脂培养板进行全菌测定[9]。再用含有15%的蔗糖的轻型唾液链球菌琼脂(mitis salivarius agar,MSA)培养板来进行总链球菌测定[10]。这是因为MSA含有结晶紫、亚碲酸钾和台盼蓝等选择性抑菌剂,能抑制大多数革兰阴性杆菌和除链球菌外的大多数革兰阳性菌,选择性地使链球菌生长。第三,用加0.2 U/mL的杆菌肽的MSA培养板来测定变形链球菌。
1.5 表面粗糙度的测定 采用粒度越来越细的金刚砂纸和自动抛光机(日本,Buehler公司)在注水的条件下将试件的表面逐级抛光,最细到粒度4 000目。试件在抛光后直接测试表面粗糙度,然后经过7 d的菌斑生物膜培养(前2 d培养方法如前所述,以后每天更换1次培养液,共培养7 d),将试件在PBS中漂洗,并通过超声震动彻底清除表面生物膜,然后进行表面粗糙度的测试。对每个试件的抛光面中心区进行粗糙度的测定,每个试件变换角度测试3次,取均值进行统计。粗糙度是衡量物体表面平滑程度的量化指标,以触针垂直位移的微米(μm)数表示。粗糙度的测定采用粗糙度测试仪Surfcom470A(日本,Tokyo Seimitu公司),在垂直倍率5 000、运行速度为0.1 mm/s、基准长度2.5 mm、切入值(cut-off值)为0.8 mm的条件下,测定中心线平均粗糙度(Ra)值。
1.6 统计学处理 使用SPSS 13.0软件,计量资料用均数±标准差(±s)表示,选用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 生物膜染色 生物膜活/死细菌的染色见图1。活细菌染成绿色,死细菌染成红色。接近或重叠的活/死细菌会显示出橙黄色。对照组(图1A)复合树脂表面覆盖有大量的活细菌。相比之下,实验组(图1B)复合树脂表面的菌斑生物膜主要染成红/橙色,结果显示含有DMADDM的复合树脂有强的抗菌活性。

图1 生物膜活/死细菌染色
2.2 CFU计数 全菌、总链球菌和变形链球菌见图2。与对照组相比,添加DMADDM的实验组复合树脂显著降低了CFU计数(P<0.01)。与对照组相比,实验组的3个CFU计数均降低了3个数量级。
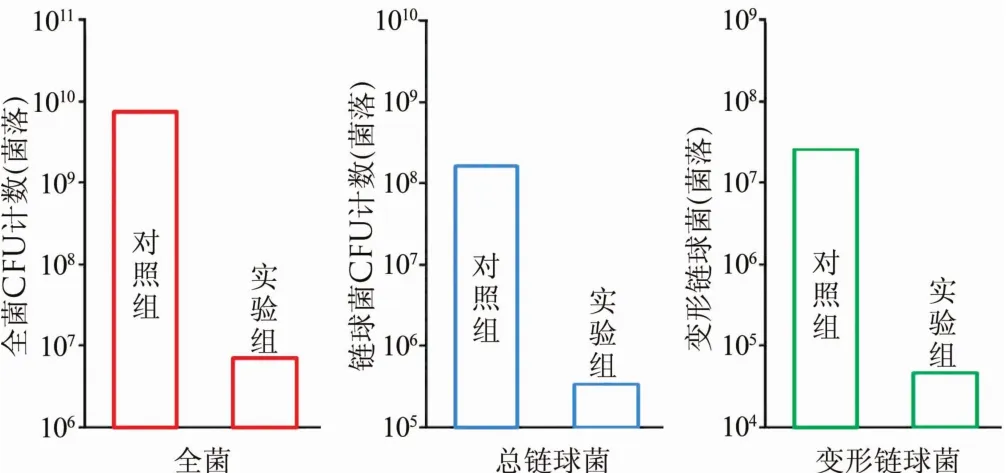
图2 CFU计数结果
2.3 复合树脂表面粗糙度 菌斑生物膜培养前后复合树脂表面的粗糙度见图3。结果显示,培养前实验组和对照组材料表面粗糙度差异没有统计学意义(P>0.05),菌斑生物膜培养7 d后实验组复合树脂表面粗糙度变化差异没有统计学意义(P>0.05),而对照组复合树脂表面粗糙度明显增加(P<0.01)。

图3 菌斑生物膜培养7 d前后复合树脂表面的粗糙度
3 讨论
光固化复合树脂是在20世纪60年代被引入牙科领域,该材料具有色泽美观、强度高、黏结固位效果好、良好的可塑性以及固化后可打磨、抛光等优点,通过配制黏度适当的混合浆体,经过特定的光照射后固化,即可用于牙齿的缺损修复,因此在牙科修复领域受到了广泛关注[1]。研究表明,复合树脂材料表面较其他修复材料更容易堆积菌斑和生物膜[2]。菌斑则是引发继发龋和修复失败的主要原因[3]。因此,如何赋予复合树脂及其黏接系统抗菌性能,通过其抗菌性能减小对口腔微生态环境的影响、改善修复体的长期临床效果、维护口腔微生态环境的健康成为国内外的研究热点。各国研究人员在研制具有抑菌作用的树脂和复合树脂材料方面进行了大量的工作。Imazato等[11]合成了抗菌单体甲基丙烯酰氧十二烷基溴吡啶,并表明含有甲基丙烯酰氧十二烷基溴吡啶的复合树脂可以显著抑制细菌生长。在其他研究人员的工作中,新型抗菌树脂中有加入甲基丙烯酰氧乙基-正十六烷基-二甲基氯化铵和西吡氯铵作为其抗菌成分[12-13]。本研究将新型季铵盐抗菌单体DMADDM添加到复合树脂中。以往研究表明,烷基链长度为12的DMADDM具有更强的抗菌性能[5,14]。DMADDM通过和细胞膜结合,季铵盐可导致细菌破裂,进而引起细胞质外泄[12]。当带负电荷的细菌细胞接触带正电荷的季胺离子时,电荷平衡受到干扰,细菌可以在其自身的渗透压作用下破裂[12]。长的阳离子聚合物可以像针刺破气球一样,穿透细菌细胞破坏细胞膜[15]。本研究结果显示,含有DMADDM的复合树脂具有很强的抗菌性,全菌、总链球菌和变形链球菌的CFU计数与对照组相比均降低了3个数量级,该结果与以往研究一致[5,14]。
在口腔环境中,复合树脂更容易在表面堆积菌斑生物膜。菌斑生物膜造成材料表面的老化粗糙,导致材料性能下降,而粗糙的表面更易吸引细菌黏附[4]。这样的恶性循环最终将会造成修复失败,甚至对全身产生不良影响。Beyth等[4]对不同品牌的光固化复合树脂应用变形链球菌培养30 d,评价变形链球菌对材料表面粗糙度的影响,结果表明材料表面的粗糙度随着培养时间的增加而不断增加。其他学者也进行了类似的研究,结果均表明,菌斑生物膜会对复合树脂表面粗糙度产生显著的影响[16]。本研究在体外培养口腔菌斑生物膜,研究口腔全菌生物膜对含有DMADDM的抗菌复合树脂材料表面粗糙度的影响,结果显示经过7 d生物膜的培养后,对照组复合树脂表面粗糙度显著增加,与以往各研究结果一致。实验组由于添加了具有强抗菌性的DMADDM季铵盐单体,显著降低了菌斑生物膜的活性,大大降低了细菌的附着,从而减少了菌斑生物膜对复合树脂表面粗糙度的影响,经过7 d生物膜的培养后复合树脂表面粗糙度没有明显变化。
目前,用于检测材料的可溶性抗菌性能的方法包括应用琼脂平板弥散法观察抑菌环、材料浸提液对细菌悬液生长的影响及材料对浮游状态细菌生长的影响等[7],对具有接触性抗菌性能的含季铵盐抗菌单体的牙科复合树脂及黏接系统并不适用。另外,采用浮游状态细菌进行抗菌研究,同口腔实际环境中的菌斑生物膜相差甚远,尤其在细菌形成菌斑生物膜后,基因表达和生物学行为发生显著改变,普通的抗菌药物很难发挥作用[7]。口腔生物膜模型可以分为单一菌种、特定的混合菌和全菌模型[7]。全菌生物膜是从口腔环境中复制出的,很大程度上保持了口腔内菌斑生物膜的复杂性和异质性[7]。牙菌斑生物膜是一种复杂的生态系统,约含有1 000种不同的细菌种类[16]。链球菌在龋病发生、发展过程中起了重要的作用。口腔链球菌包含多种菌群,如变形链球菌群、唾液链球菌群、轻型链球菌群等。研究表明,变形链球菌是龋齿的主要致病菌[9]。因此,体外培养口腔菌斑生物膜,研究抗菌材料表面对菌斑生物膜的影响,对评价材料的性能及其临床应用前景非常重要。
[1]Ferracane JL.Resin composite--state of the art[J].Dent Mater,2011,27(1):29-38.
[2]Beyth N,Domb AJ,Weiss EI.An in vitro quantitative antibacterial analysis of amalgam and composite resins[J].J Dent,2007,35(3):201-206.
[3]Drummond JL.Degradation,fatigue,and failure of resin dental compositematerials[J].JDent Res,2008,87(8):710-719.
[4]Beyth N,Bahir R,Matalon S,et al.Streptococcus mutans biofilm changes surface-topography of resin composites[J].Dent Mater,2008,24(6):732-736.
[5]Zhou C,Weir MD,Zhang K,et al.Synthesis of new antibacterial quaternary ammonium monomer for incorporation into CaP nanocomposite[J].Dent Mater,2013,29(8):859-870.
[6]Imazato S.Bio-active restorativematerials with antibacterial effects:new dimension of innovation in restorative dentistry[J].Dent Mater J,2009,28(1):11-19.
[7]McBain AJ.In vitro biofilm models:an overview[J].Adv Appl Microbiol,2009,69:99-132.
[8]Cheng L,Exterkate RA,Zhou X,et al.Effect of Galla chinensis on growth and metabolism ofmicrocosm biofilms[J].Caries Res,2011,45(2):87-92.
[9]McBain AJ,Sissons C,Ledder RG,et al.Development and characterization of a simple perfused oralmicrocosm[J].J Appl Microbiol,2005,98(3):624-634.
[10]Lima JP,Sampaio de Melo MA,Borges FM,et al.Evaluation of the antimicrobial effect of photodynamic antimicrobial therapy in an in situmodel of dentine caries[J].Eur J Oral Sci,2009,117(5):568-574.
[11]Imazato S,Kinomoto Y,Tarumi H,et al.Antibacterial activity and bonding characteristics of an adhesive resin containing antibacterial monomer MDPB[J].Dent Mater,2003,19(4):313-319.
[12]Namba N,Yoshida Y,Nagaoka N,etal.Antibacterial effect of bactericide immobilized in resinmatrix[J].DentMater,2009,25(4):424-430.
[13]Li F,Chen J,Chai Z,et al.Effects of a dental adhesive incorporating antibacterial monomer on the growth,adherence and membrane integrity of Streptococcus mutans[J].JDent,2009,37(4):289-296.
[14]Zhang K,Cheng L,Wu EJ,et al.Effect of water-aging on dentin bond strength and anti-biofilm activity of bonding agent containing antibacterial monomer dimethylaminododecylmethacrylate[J].JDent,2013,41(6):504-513.
[15]Murata H,Koepsel RR,Matyjaszewski K,et al.Permanent,non-leaching antibacterial surfaces-2:how high density cationic surfaces kill bacterial cells[J].Biomaterials,2007,28(32):4870-4879.
[16]Busscher HJ,Rinastiti M,Siswomihardjo W,et al.Biofilm formation on dental restorative and implantmaterials[J].J Dent Res,2010,89(7):657-665.
The effect of microcosm biofilm degradation on the surface roughness of novel antibacterial resin com posite
MEIMei1,LIXiaolei1,ZHANG Ning2
(1.Beijing Shi Jing Shan Hospital,Teaching Hospital of Capital Medical University in Shijingshan,Beijing 100040,China;2.Beijing Stomatological Hospital Affiliated to Capital Medical University,Beijing 100050,China)
ObjectiveAdental plaquemicrocosm biofilm modelwith human saliva as inoculum was used to investigate the influence of 7-day biofilm degradation on the surface of resin composite containing dimethylaminododecylmethacrylate(DMADDM).MethodsDMADDM was incorporated into resin composite and the dental plaque microcosm biofilm model was used to evaluate biofilm colony-forming unit(CFU)counts,live/dead staining assay and surface roughness test.ResultsIncorporating DMADDM significantly reduced the CFU(P<0.01).All three CFU counts in experimental group were 3 orders ofmagnitude lower than those in control group.7-day biofilm degradation had much less influence on the surface roughness of resin composite containing DMADDM.ConclusionResin composite containing DMADDM has strong antibacterial potency and could resist the oral environment degradation.The novel compositemay have wide applicability in clinic.
Resin composite;Microcosm biofilm;Antibacterial property;Surface roughness
R780.2
A
2095-3097(2014)03-0166-04
10.3969/j.issn.2095-3097.2014.03.011
2014-04-24 本文编辑:徐海琴)
100040北京,首都医科大学石景山教学医院北京市石景山医院(梅 美,李晓蕾);100050北京,首都医科大学附属北京口腔医院(张 宁)
张 宁,E-mail:dentistzhang112@163.com

