红曲霉固态发酵产洛伐他汀的响应面优化
郑虹
(福建师范大学福清分校海洋与生化工程学院,福建福清350300)
红曲霉固态发酵产洛伐他汀的响应面优化
郑虹
(福建师范大学福清分校海洋与生化工程学院,福建福清350300)
采用Box-Benhnken试验设计和响应面分析,对红曲霉固态发酵产洛伐他汀的工艺条件进行优化,得到最佳的发酵工艺条件为培养时间、初始含水量和大米装量分别为17 d、25.4%、53.3 g/250 mL,在此条件下,洛伐他汀的产量可达15.35 mg/g,与预测值(14.73 mg/g)较为接近。结果表明响应面法优化红曲霉固态发酵产洛伐他汀的条件合理可行。
红曲霉;洛伐他汀;固态发酵;响应面分析
红曲霉(Monascus ruber)属于真菌门,子囊菌亚门,不整囊菌纲,散囊菌目,红曲科,红曲霉属。红曲霉能产食用色素,在我国具有上千年的食用历史,在食品着色、食品防腐及医疗上具有广泛的应用前景[1-6]。近年来国内外在红曲霉的研究过程中主要是集中在菌种选育、培养基优化、发酵工艺和提取测定方法等方面[7-13]。红曲霉能够产生多种活性代谢物质,主要有红曲色素、麦角固醇、γ-氨基丁酸、洛伐他汀类化合物及其他活性产物等[14]。
红曲霉所产生的洛伐他汀不仅能够抑制胆固醇的合成还能增加胆固醇的分解代谢[15]。此外,洛伐他汀在多项药理实验研究结果还表明,其对肾脏具有保护作用;能预防和治疗胆结石、抗肿瘤、刺激骨骼形成;对动脉硬化、糖尿病都有很好的治疗作用[16]。洛伐他汀引起了广大国内外专家学者的研究兴趣,并分别对其功能性、安全性以及作用机理、分子结构、代新途径等宏观与微观水平上进行了深入研究,并取得了引人注目的成果[17-18]。但我国对洛伐他汀类药物开发较晚,在产率和提取率上与发达国家有较大差距。本研究利用响应面法对红曲霉产洛伐他汀发酵培养条件进行优化,对提高发酵水平,降低成本具有重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
红曲霉(Monascus ruber):由本实验室筛选并保藏。
1.1.2 培养基
(1)斜面培养基:马铃薯200 g,琼脂15~20 g,葡萄糖20 g,水1 000 mL,pH自然。
(2)种子培养基:葡萄糖50 g,蛋白胨10 g,NaNO35 g,MgSO41 g,KH2PO41 g,水1 000 mL,pH自然。121℃灭菌20 min。
(3)发酵培养基:丁优米50 g,初始含水量50%。121℃灭菌30 min。
1.1.3 主要试剂
丁优米:超市;洛伐他汀标准品:美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-1750紫外可见分光光度计:日本岛津公司;GSP-9050MBE隔水式恒温培养箱:上海博讯实业有限公司;LDZX-40BI立式自动电热压力蒸汽灭菌器:上海申安医疗器械厂;H1850台式高速冷冻离心机:湘仪离心机仪器有限公司;THZ台式恒温振荡器:太仓市华美生化仪器厂。
1.3 试验方法
1.3.1 红曲霉活化及种子液制备
4℃冰箱保存的红曲霉接种于新鲜的斜面培养基上,30℃恒温培养5 d;挑取1~2环孢子接种于种子培养基,30℃、120 r/min振荡培养5 d。
1.3.2 单因素试验
大米装量对红曲霉洛伐他汀产量的影响:250 mL三角瓶中分别装20 g、30 g、40 g、50 g、60 g、70 g、80 g的大米,按5%的接种量接入种子液,30℃静置培养18 d,测定发酵培养物中洛伐他汀的含量。
培养时间对红曲霉洛伐他汀产量的影响:按5%的接种量接入种子液,以大米的装量为30 g,30℃静置培养8 d后,每隔2 d取样,测定发酵培养物中洛伐他汀的含量。
初始含水量对红曲霉洛伐他汀产量的影响:在发酵培养基中添加不同的蒸馏水,使培养基的初始含水量达到10%、20%、30%、40%、50%、60%、70%,按5%的接种量接入种子液,以大米的装量为30 g,30℃静置培养18 d,测定发酵培养物中洛伐他汀的含量。
以上每个试验重复3次,数据处理采用DPS和Excel软件处理。
1.3.3 响应面试验设计
采用Design Expert 8.05软件设计试验[19-20]。采用Box-Benhnken的中心组合试验设计,在单因素试验基础上,选取培养时间、初始含水量、大米装量3个因子,设计3因素3水平的响应面分析试验,因素及水平见表1。

表1 试验因素水平及编码Table 1 Factors and coded levels for BBD experiments
1.3.4 样品中洛伐他汀的含量测定
采用双波长紫外分光光度计法[21]测定样品中洛伐他汀的含量。
标准曲线的绘制:称取洛伐他汀标准品64 mg,用体积分数为75%乙醇配制成64 mg/mL的母液,分别吸取一定量母液,用体积分数为75%乙醇配制稀释液质量浓度为3.2 mg/mL、6.4 mg/mL、9.6 mg/mL、12.8 mg/mL、16.0 mg/mL、19.2 mg/mL、22.4mg/mL、25.6 mg/mL、28.8mg/mL、32.0 mg/mL。用双波长的方法测定各稀释液的吸光度值A264nm和A254nm,并求其二者差值△A(A264nm-A254nm)。
样品中洛伐他汀的测定:称取0.2 g发酵培养物,用20 mL体积分数为75%的乙醇于超声波提取2 h,5 000 r/min、4℃离心10 min除去不溶杂质,收集取上清液,上清液进行吸附层析除去色素和杂质,流出液定容至100 mL,测定溶液的A264nm和A254nm,求其二者差值△A(A264nm-A254nm),通过标准曲线求得样品中洛伐他汀的含量。
2 结果与分析
2.1 标准曲线回归方程的建立
以洛伐他汀质量浓度(x)为横坐标,△A为纵坐标(y)绘制标准曲线,结果见图1。
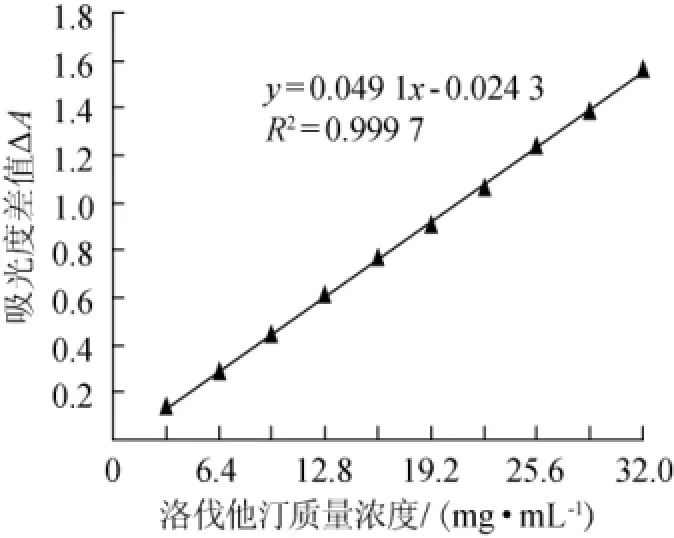
图1 洛伐他汀标准曲线Fig.1 Standard curve of lovastatin
由图1可知,标准曲线回归方程为y=0.049 1 x-0.024 3,相关系数R2为0.999 7,表明二者线性关系良好。
2.2 单因素对红曲霉洛伐他汀产量的影响
2.2.1 大米装量对红曲霉洛伐他汀产量的影响
250 mL三角瓶中分别装20 g、30 g、40 g、50 g、60 g、70 g、80 g的大米,将活化后种子液按5%接种量接种于发酵培养基,30℃静置培养18 d,测定发酵培养物中洛伐他汀的含量,结果见图2。
物料的装量是固态发酵的关键因素之一,装量太多,通气性不好,不利于发酵过程的散热;同样装量太少,造成资源浪费。由图2可知,洛伐他汀产量随着大米量的增加而增加,当大米装量为30 g时,洛伐他汀产量达到最大值为7.81 mg/g,之后随着大米装量的增加,洛伐他汀的产量反而逐渐减少。微生物在生长过程中会产生大量的热量,对于固态发酵,物料是静置的,培养基的传热性能较差,只有当试验容器内装有合适量的大米时,才有利于红曲霉洛伐他汀的合成。因此试验中以大米的装量为30 g/250 mL时最佳。
2.2.2 培养时间对红曲霉洛伐他汀产量的影响
以大米的装量为30 g/250 mL,30℃静置发酵培养至8 d后,每隔2 d测定发酵培养物中洛伐他汀的含量,结果见图3。
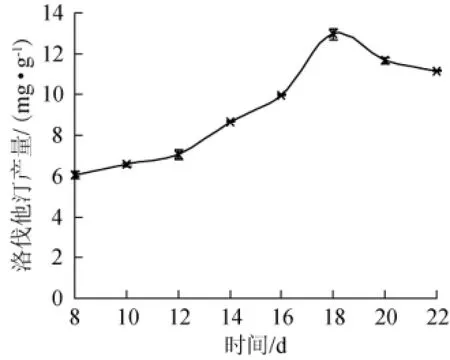
图3 培养时间对洛伐他汀产量的影响Fig.3 Effect of culture time on lovastatin yield
红曲霉积累产物的过程是一个动态的过程。由图3可知,红曲霉产洛伐他汀的量刚开始随培养时间的延长而增加,当培养至18 d时,洛伐他汀含量达到最大值为12.96 mg/g,之后随着时间的延长,洛伐他汀含量反而减少,因此发酵时间就以18 d为最适。
2.2.3 初始含水量对红曲霉洛伐他汀产量的影响
将种子液按5%接种量接种于不同初始含水量的发酵培养基,以大米的装量为30 g/250 mL,30℃静置培养时间为18 d,测定发酵培养物中洛伐他汀的含量,结果见图4。
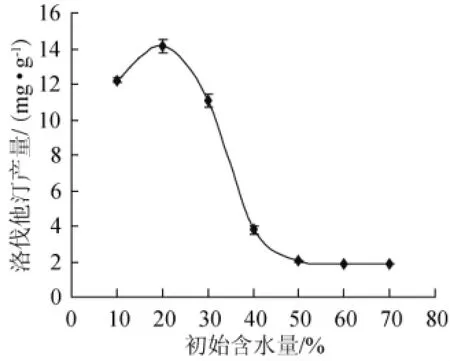
图4 初始含水量对洛伐他汀产量的影响Fig.4 Effect of initial water content on lovastatin yield
初始含水量是影响菌株固态发酵的主要因素之一,因此研究了初始含水量对红曲霉洛伐他汀产量的影响。由图4可知,红曲霉产洛伐他汀含量先是随培养基中初始含水量的增加而增加,直到初始含水量为20%时,洛伐他汀含量达到最大值,即14.15 mg/g,之后洛伐他汀含量随着初始含水量的增加反而减少。可能是由于培养基主要成分是大米,初始含水量越高,大米的黏度越大,大米黏度太大不利于红曲霉菌丝的生长,进而影响到洛伐他汀的积累,最佳的初始含水量使大米达到一个松而不黏的状态。结果表明,当初始含水量为20%时,大米松而不黏,因而有利于红曲霉洛伐他汀的积累。
2.3 响应面分析法优化发酵工艺
2.3.1 二次回归拟合及方差分析
根据单因素试验结果,选择培养时间(X1)、初始含水量(X2)、大米装量(X3)3个因素为变量,洛伐他汀产量(Y)为响应值,设计3因素3水平的响应面分析试验,试验方案及结果见表2。

表2 Box-Benhnken试验设计与结果Table2 Design and results of Box-Behnken design
利用软件对表2数据进行二次多项回归拟合,获得二次多项回归方程:
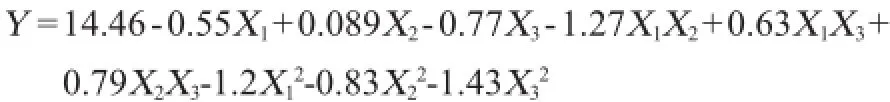
对上述回归模型进行方差分析,结果见表3。
由表3可知,回归模型的P=0.008 7,失拟P=0.477 5,回归极显著,失拟不显著,说明所创建的模式合适。该模型的校正系数R2Adj=0.772 7,说明该方程与实际情况拟合较好,预测值和实际值的相关性较高,可用该模型对红曲霉固态发酵产洛伐他汀的最优发酵条件进行理论预测。
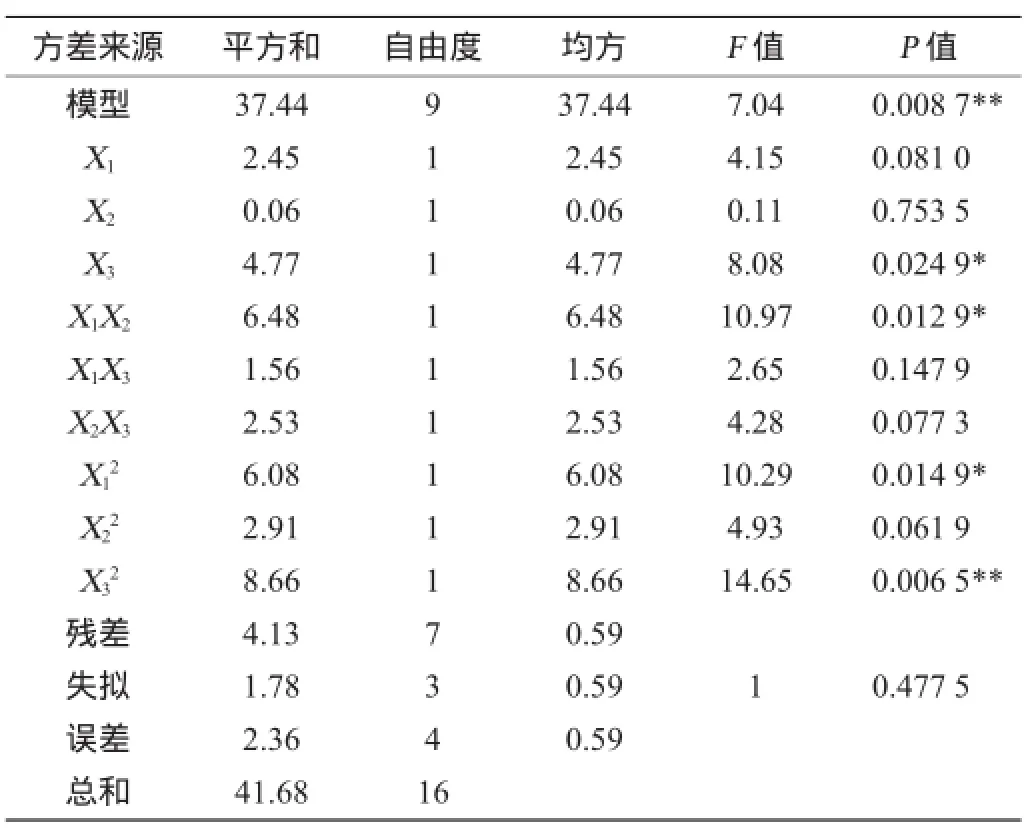
表3 回归模型的方差分析Table3 Variance analysis of response surface quadratic model
由回归方程各项方差分析表明,大米装量对洛伐他汀产量影响显著,而培养时间与初始含水量之间的交互作用对洛伐他汀产量的影响不显著,培养时间与大米装量、初始含水量与大米装量之间交互作用不显著。同时由软件分析得出模型的极值点,当培养时间为17 d,初始含水量为25.4%,大米装量为53.3 g/250 mL时,洛伐他汀产量的理论预测最大值为14.73 mg/g。
2.3.2 响应面及其等高线图
利用软件Design Expert 8.05绘制出响应面及等高线图。结果见图5。
图5反映了培养时间、初始含水量、大米装量3个因素的两两交互作用对洛伐他汀产量的影响。由图5可知,培养时间与初始含水量、培养时间与大米装量、初始含水量与大米装量的等高线呈椭圆形,两两因素间交互作用显著。
2.4 回归模型的验证试验

图5 各因素交互作用对洛伐他汀产量影响的响应面及等高线Fig.5 Response surface plots and contour line of effect of interaction between each factors on lovastatin yield
为了检验模型的可行性,在预测最佳条件下进行发酵试验。红曲霉在优化发酵工艺条件下,洛伐他汀产量可达到15.35 mg/g,比优化前(5.52 mg/g)提高了1.8倍,与理论预测值(14.73 mg/g)较为接近,表明预测值与实际值有较好的拟合性,可见该模型可用于预测红曲霉固态发酵产洛伐他汀的实际发酵情况。
3 结论
在单因素试验基础上,利用响应面法对红曲霉固态发酵产洛伐他汀的发酵条件进行优化,运用软件Design Expert 8.05建立了洛伐他汀产量与培养时间、初始含水量、大米装量3个因素的二次多项式回归模型,经验证试验证明该模型的理论预测值与实际值有较好的拟合性,说明该模型可用于红曲霉发酵产洛伐他汀的试验预测。并得出最优发酵条件,即培养时间为17 d,初始含水量为25.4%,大米装量为53.3 g/250 mL,在此条件下,洛伐他汀的产量达到15.35 mg/g,比优化前提高了1.8倍。
[1]刘方箐,刘辉,宁娜.红曲色素替代亚硝酸盐对肉类护色的研究进展[J].肉类研究,2011(1):33-36.
[2]CHEN C L,PAN T M.Red mold dioscorea:A potentially safe traditional function food for the treatment of hyperlipidemia[J].Food Chem,2012, 134(2):1074-1080.
[3]张佳佳,高洁,林吉恒,等.红曲防腐效应及其应用开发[J].中国食品添加剂,2012(4):241-244.
[4]王亚威,武晓红,王鸿.红曲霉抑菌作用和抑菌成分的研究[J].中国调味品,2012,37(2):32-35.
[5]成晓霞,陈泽雄.红曲抗肿瘤活性研究进展[J].中国现代中药,2011,13(3):43-45.
[6]张茜,王昌禄,篙露,等.红曲霉对胆固醇降解特性的研究[J].中国酿造,2011,30(6):31-34.
[7]孙嘉龙,邹晓,刘爱英,等.高产Monacolin K红曲菌株的复合诱变选育[J].菌物学报,2007,26(4):507-516.
[8]洪智勇,毛宁.激光对红曲霉的诱变作用[J].激光杂志,2002,23(5):53-55.
[9]SERAMAN S,RAJENDRAN A,THANGAVELU V.Statistical optimization of anticholesterolemic drug lovastatin production by the red mold Monascus purpureus[J].Food Bioprod Process,2010,88(2):266-276.
[10]黄群,麻成金,余佶,等.产Monacolin K红曲霉筛选及响应面法优化发酵条件[J].食品科学,2011,32(21):177-182.
[11]宋红平,李梅,冯琳,等.液体发酵法产洛伐他汀的研究进展[J].食品与发酵工业,2011,37(8):136-141.
[12]江利香,葛锋,刘畅.红曲Monacolin K的高产策略[J].中草药,2011,42(7):1446-1452.
[13]付海平,林亲录,何煜波.红曲霉中Monacolin K的研究进展[J].中国食品添加剂,2003,6(1):50-54.
[14]李雪梅,沈兴海,段震文,等.红曲霉代谢产物的研究进展[J].中草药,2011,42(5):1018-1025.
[15]丘振宇,王亚琴,许喜林.红曲霉中Monacolin K的应用研究[J].中国酿造,2007,26(1):8-10.
[16]GOWER T L,GRAHAM B S.Antivirval activity of lovastatin against respiratory syncytial virus in vivo and in vitro[J].Antimicrob Agents Ch,2001,45(4):1231-1237.
[17]余志立,袁建勇.新型降胆固醇的物质Monacolin K的质谱研究[J].质谱学报,2000,21(1):68-71.
[18]Shui H A,Hsia C W,Chen H M,et al.Proteomics and bioinformatics analysis of lovastation-induced differentiation in ARO cells[J].J Proteom,2012,75(4):1170-1180.
[19]甘锋,唐建忠,王轩,等.响应面法优化红曲霉固态发酵产Monacolin K工艺条件的研究[J].中国食品添加剂,2011,108(1):131-136.
[20]季宏飞,许杨,李燕萍.采用响应面法优化红曲霉固态发酵产红曲色素培养条件的研究[J].食品科技,2008(8):9-14.
[21]文镜,顾晓玲,常平,等.双波长紫外分光光度计测定红曲中洛伐他汀(Lovastatin)的含量[J].中国食品添加剂,2000(4):11-17.
Optimization of solid-state fermentation conditions of Monascus for lovastatin production by response surface methodology
ZHENG Hong
(School of Ocean Science and Biochemistry Engineering,Fuqing Branch of Fujian Normal University,Fuqing 350300,China)
In order to optimize the solid-state fermentation of Monascus for lovastatin production response surface methodology(RSM)and Box-Behnken design analysis was employed.The results showed that the optimized conditions were fermentation time 17 d,initial water content 25.4%, and rice content 53.3 g/250 ml.Under this condition,the highest lovastatin production was 15.35 mg/g,close to the predicted value 14.73 mg/g.This study proved that RSM could be efficiently applied in optimizing the solid-state fermentation conditions of Monascus for lovastatin production.
Monascus;lovastatin;solid-state;response surface methodology
TQ920.1
A
0254-5071(2014)10-0076-05
10.11882/j.issn.0254-5071.2014.10.018
2014-08-21
福建师范大学福清分校省级重点学科建设基金项目(20120326)
郑虹(1981-),女,实验师,硕士,研究方向为微生物发酵。

