松木层孔菌多糖PP60-S1分离、结构表征及抗氧化活性研究
杨 开,金月忠,邢 辰,胡江宁,王如伟,孙培龙,*
(1.浙江工业大学食品科学与工程系,浙江杭州 310014;2.浙江中药与天然药物研究院,浙江杭州 310052)
松木层孔菌多糖PP60-S1分离、结构表征及抗氧化活性研究
杨 开1,2,金月忠1,邢 辰1,胡江宁2,王如伟2,孙培龙1,*
(1.浙江工业大学食品科学与工程系,浙江杭州 310014;2.浙江中药与天然药物研究院,浙江杭州 310052)
松木层孔菌子实体水提物经乙醇分级醇沉和DEAE-Sepharose Fast Flow离子柱层析及Sephacryl S-300凝胶柱层析纯化,获得均一多糖PP60-S1,其分子量为3.56×104u,是由葡萄糖、甘露糖和半乳糖组成的杂多糖,单糖摩尔比为9.24∶1.00∶0.76,甲基化分析PP60-S1主要由1-Glc、1,3-Glc、1,6-Glc、1,3-Gal、1,6-Gal、1,3,6-Man 6种糖苷键连接方式,主链主要由1,6-Glc构成。PP60-S1的体外抗氧化活性研究表明其具有一定的DPPH自由基和ABTS+自由基清除活性以及FRAP总抗氧化能力。
松木层孔菌,多糖,分离纯化,结构表征,抗氧化
松木层孔菌(Phellinus pini),又名松针层孔菌和松白腐菌,是针层孔菌属真菌,属于大型真菌,子实体木质,呈褐色。其主要活性成分有多糖、酚类、萜类物质等[1-2]。多糖作为松木层孔菌的主要生物活性成分之一,在抗氧化、免疫调节、抗病毒、抗肿瘤等方面均表现出了较好的效果[3-4]。在松木层孔菌发酵物多糖研究方面,裴丽娟等[5]从发酵菌丝体中分离得到了一种由甘露糖、半乳糖和葡萄糖构成的碱提水溶性多糖(PEP),此多糖对小鼠离体淋巴细胞具有较显著的促增殖作用。袁蕾等[6]从发酵液中分离得到了一种胞外多糖(PPE),是以甘露糖(93.29%)为主要组成的杂多糖组分。在子实体多糖研究方面,刘安军等[7]提取分离得到的水溶性β-杂多糖组分PS1,能够显著提高小鼠机体的免疫能力。Lee等[8]从松木层孔菌子实体中分离得到了两种高分子量的多糖(EP-AV1和EP-AV2),均以β-1,3葡聚糖构成为主,并具有一定的抗病毒活性(包括HSV-1和CVB3)。近几十年的研究表明,一种来源的菌物多糖往往由几个不同结构的多糖组成,而且多糖的结构(如分子量、连接方式、糖苷键类型、分支度和聚合度等)是其发挥各种生理活性的物质基础。然而与同属的其他真菌相比,如裂蹄 针 层 孔 菌(Phellinus linteus)、针 层 孔 菌(Phellinus igniarius)和鲍氏针层孔菌(Phellinus baumii),目前有关松木层孔菌多糖结构特性的研究还很少。因此,本文进行了松木层孔菌子实体多糖的提取和分离纯化,并对一个纯化多糖组分开展了结构表征和体外抗氧化活性研究,有利于进一步了解该珍稀菌物多糖的结构和生物活性,也为其医药保健产品的研发利用提供参考。
1 材料与方法
1.1 材料与仪器
松木层孔菌子实体(Phellinus pini) 购于浙江五养堂药业有限公司,由浙江省农科院园艺研究所食药用菌研究室蔡为明研究员鉴定;DEAE-Sepharose Fast Flow 、Sephadex G-25 Fine 和 Sephacryl S300 High-Resolution 均购自美国GE公司;葡聚糖标准品(analytical standard for GPC,CAS:9004-54-0)、单糖标准品:L-岩藻糖(≥99%,CAS:2438-80-4)、D-木糖(≥99%,CAS:58-86-6)、D-甘露糖(≥99%,CAS:3458-28-4)、L-鼠李糖 (≥99%,CAS:10030-85-0)、D-半乳糖(≥99%,CAS:59-23-4)、D-葡萄糖(≥99.5%,CAS:50-99-7)、碘甲烷、2,2-Diphenyl-picrylhydrazyl(DPPH)、2,2-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS)、2 ,4 ,6-Tris(2-pyridyl)-s-triazine(TPTZ) 均 购 自 美 国 Sigma公司;三氟乙酸、硼氢化钠 购于德国Merck公司;其余试剂 均为国产分析纯。
RE-2000A旋转蒸发器 上海亚荣生化仪器厂;CR21GⅡ型高速冷冻离心机 日本日立仪器有限公司;UV-2450紫外可见分光光度仪 日本岛津公司;Alpha 2-4 LD Plus真空冷冻干燥机 德国Christ公司;Waters 1525高效液相色谱仪、Waters 2414示差检测器 美国Waters公司;TSKgel G4000PWXL高效液相色谱柱 日本Tosoh公司;XK双层层析柱(26mm× 100cm) 美国GE公司;Nicolet 6700傅里叶变换红外光谱仪、Finnigan Trace Ultra-DSQⅡ气-质联用色谱仪 美国Thermo公司;Agilent 7890A气相色谱 美国Agilent公司。
1.2 实验方法
1.2.1 松木层孔菌子实体多糖的提取 松木层孔菌子实体切成小块后用粉碎机粉碎,过60目筛,60℃烘干至恒重,称取干燥粉末500g,用10倍体积95%乙醇浸提过夜脱脂,布氏漏斗过滤,重复3次。残渣置阴凉通风处风干,加20倍蒸馏水,沸水提取2h,10000r/min离心10min,渣液分离,滤渣复提2次,合并3次提取液,50℃以下减压旋转蒸发浓缩,浓缩液搅拌过程中缓慢加入95%乙醇至终乙醇体积浓度为30%,静置过夜,10000r/min,离心10min;上清液继续加入95%乙醇至终乙醇体积浓度为60%,10000r/min,离心10min,收集沉淀,醇沉物再经无水乙醇、丙酮洗涤,72h冷冻干燥后得松木层孔菌子实体粗多糖,命名为PP60。
1.2.2 松木层孔菌子实体多糖的分离与纯化 将粗多糖PP60溶于蒸馏水中,配成1.0mg/mL溶液,10000r/min离 心10min,取 上 清 液 经 DEAE-Sepharose Fast Flow离子柱(XK26mm×100cm)层析,每次上样10mL,流速3.0mL/min,依次用蒸馏水,0~0.4mol/L NaCl溶液线性梯度洗脱,自动部分收集,每管10mL,糖含量经苯酚-硫酸法跟踪检测,根据显色反应收集多糖组分。离子柱洗脱下来的多糖组分PP60-S配成一定浓度的糖 溶 液 后 经Sephadex G-25 Fine凝 胶 柱(XK26mm × 100cm)脱盐,收集全部脱盐后的PP60-S多糖溶液 ,再 用 Sephacryl S-300 High-Resolution 凝 胶 柱(XK26mm×100cm)进一步纯化,蒸馏水洗脱,自动部分收集,得到PP60-S1组分,收集,浓缩,冻干,储存于干燥器中备用。
1.2.3 多糖PP60-S1的均一性和平均分子量测定 采用高效液相色谱法(HPLC)对松木层孔菌纯化多糖PP60-S1进行均一性及分子量的测定。色谱柱:TSKgel G4000PWXL(7.8 ×300mm);流 动 相 :0.1mol/L NaNO3溶液,流速:0.8mL/min;进样量:10μL;柱温:(30±1)℃;检测器:Waters 2414示差检测器。取多糖PP60-S1 2.0mg溶于2.0mL 0.1mol/L NaNO3溶液,微孔滤膜过滤,取滤液10μL进样,测得保留时间,根据标准曲线计算分子质量。
1.2.4 多糖PP60-S1的理化特性分析
1.2.4.1 多糖PP60-S1的紫外-可见光光谱全扫描检测 将PP60-S1配成1.0mg/mL水溶液,采用紫外-可见分光光度计在200~400nm进行全波长扫描检测。
1.2.4.2 多糖PP60-S1的傅里叶变换红外光谱分析 取2.0mg干燥的PP60-S1样品,采用KBr压片,在4000~400cm-1内进行红外光谱扫描。
1.2.5 多糖PP60-S1的单糖组成分析 称取PP60-S1样品2.0mg,放入薄壁长试管中,加入2.0mol/L的三氟乙酸(TFA)4.0mL,在110℃水解2h。水解后,试管中溶液低于40℃减压蒸干,然后加入甲醇蒸干,重复操作4~5次,以完全除去TFA。将完全水解的样品重新溶于3.0mL蒸馏水中,加入20~30mg硼氢化钠(NaBH4),密塞,室温下还原3h,然后用冰醋酸中和过量的NaBH4,加入少量甲醇,减压浓缩蒸干,重复4~5次,真空干燥过夜。次日,加入4.0mL醋酐,100℃反应1h,然后加入3.0mL甲苯,减压蒸干。将乙酰化后的产物用氯仿溶解后转移至分液漏斗,加入等量的蒸馏水充分混匀,静置分层后,除去上层水溶液,重复3~4次。氯仿层以适量无水硫酸钠干燥、过滤,定容至10mL,待GC分析。
色谱条件:Agilent 7890N仪器配备HP-5毛细管柱(30m ×0.32mm ×0.25μm),氢 火 焰 离 子 化 检 测 器(FID),高纯度氮气最为载气。程序升温:初始柱温为120℃,以10℃/min升温至240℃,恒温6.5min,进样量2.0μL,进样口温度为250℃,分流比1∶50,检测器温度为250℃,氢气流速为35mL/min,空气流速350mL/min,尾吹气流速30mL/min,柱内流速为1.0mL/min。
1.2.6 多糖PP60-S1的糖苷键连接方式分析 充分干 燥 的 样 品 2.0mg,加 入 0.5mL DMSO,水 浴 超 声2min,然后加入0.025g/mL NaOH-DMSO悬液0.6mL和0.6mL碘甲烷,密封、涡旋混合器上混合7min后加入4.0mL蒸馏水终止反应,用等量的氯仿进行萃取,弃去上层水相,下层有机相用蒸馏水萃取5次,有机相40℃下减压蒸干,用IR检查至3400cm-1处无-OH吸收峰,即得完全甲基化多糖。将甲基化多糖溶于甲酸溶液中,100℃下解聚3h。再用TFA在100℃下封管水解6h后用NaBH4进行还原,再将上述处理过的样品用醋酐进行乙酰化反应。乙酰化后的产物用等体积氯仿和蒸馏水进行萃取,待GC-MS分析。
色谱条件:Finnigan Trace Ultra-DSQⅡ气-质联用色谱仪配备DB-5毛细管柱(30m×0.25mm×0.25μm)。程序升温:初始柱温为120℃,以10℃/min升温至240℃,保持6.5min,接口温度为250℃,离子源温度为250℃,进样量2.0μL,以氦气做载气,流速为1.0mL/min。
1.2.7 多糖PP60-S1的体外抗氧化活性测定
1.2.7.1 清除DPPH自由基活性测定 测定方法参考Milardovic等[9]的报道并略有改动。用80%甲醇溶液配制成0.2mmol/L的DPPH试剂,取1.0mL稀释的提取液与3.0mL DPPH试剂混合,暗处反应1h,然后在515nm下测定吸光值。以80%甲醇溶液作为空白对照。其结果表达为清除率达到50%时所对应的多糖浓度(即EC50)。

式中:A0:空白对照的吸光值;A1:样品的吸光值。
1.2.7.2 清除ABTS+·活性测定 测定方法参考Miller等[10]的报道并略有改动。取140mmol/L的过硫酸钾溶液加入到7.0mmol/L的ABTS溶液中混合,暗处反应12~16h。测定前用无水乙醇将ABTS+·溶液稀释至吸光值为0.70±0.02(734nm)。取0.2mL稀释过的提取液与 3 .8mL 的 ABTS+·溶 液 混 合 摇 匀 ,在 室 温 下 反 应10min后,在734nm下测定吸光值。以80%甲醇溶液作为空白对照。其结果表达为清除率达到50%时所对应的多糖浓度(即EC50)。清除率公式同1.2.7.1。
1.2.7.3 FRAP总抗氧化活性测定 测定方法参照Benzie等[11]的 报 道 并 略 有 改 动 。FRAP 试 剂 的 准 备 :0.1mol/L的醋酸缓冲试剂(pH3.6),19mmol/L的TPTZ,20mmol/L氯化铁按体积10∶1∶1的体积比混合。3.9mL FRAP试剂工作液加入0.1mL稀释过的提取液,混合均匀,置37℃恒温水浴10min,然后在593nm下测其吸光值。以FeSO4为标准溶液(标准曲线:y=0.5450x-0.0031,R2=0.9992),根据反应后的吸光值,在标准曲线上求得相应的FeSO4的浓度,定义为FRAP值,结果以每毫克多糖相当FeSO4还原力的相当量表示(mmol FeSO4/mg多糖),FRAP值越大,抗氧化活性越强。
1.2.8 数据处理 所有实验数据重复测定3次,所得结果 以 平均 值 ±标 准 差(±s)来 表示,采用Origin 8.5软件进行绘图与数据的分析。
2 结果与分析
2.1 松木层孔菌多糖PP60-S1的分离纯化
经乙醇脱脂的松木层孔菌子实体粉末,热水浸提,乙醇沉淀后得到粗多糖PP60,其得率为6.29%(w/w),经苯酚-硫酸法测定,总糖含量为66.32%±3.61%。PP60 经DEAE-Sepharose Fast Flow离 子 柱 层 析 后 得到3个组分:PP60-W(蒸馏水洗脱)、PP60-S(0.1mol/L NaCl溶 液 洗 脱)和PP60-S-1(0.2mol/L NaCl溶 液 洗脱)。洗脱曲线如图1所示。收集含量较多组分PP60-S,经Sephadex G-25 Fine凝胶柱脱盐后,再经Sephacryl S-300 High-Resolution(图2)进一步纯化后得到纯化组分PP60-S1,收集、浓缩、冷冻干燥后得到白色固体粉末。

图1 PP60 DEAE-Sepharose Fast Flow离子柱层析洗脱曲线Fig.1 Elution curves of PP60 by DEAE-Sepharose Fast Flow column chromatography

图2 PP60-S脱盐后Sephacryl S300洗脱曲线Fig.2 Elution curves of desalted PP60-S by Sephacryl S300 column chromatography
2.2 多糖PP60-S1的纯度及平均分子质量测定结果
标准曲线用标准葡聚糖(分子量分别为1.0、5.0、12、50、80、150、270、670ku) 的保留时间进行绘制。以分子量的对数为纵坐标(y),保留时间为横坐标(x,min),绘制得标准曲线:y=-0.4925x+10.071,R2= 0.9953。
PP60-S1经HPLC检测为单一对称峰(图3),说明PP60-S1为均一多糖,根据保留时间及标准葡聚糖分子量曲线,计算其平均分子质量为3.56×104u。经苯酚-硫酸法测定,PP60-S1总糖含量为99.07%± 0.28%。

图3 PP60-S1 HPLC曲线Fig.3 HPLC determination of PP60-S1
2.3 紫外-可见光光谱全扫描检测结果
松木层孔菌多糖PP60-S1的紫外-可见光谱全扫描结果见图4所示。其显示在210nm波长左右处有强的多糖吸收峰,而在260nm和280nm波长处未发现核酸和蛋白质等杂质峰,表明PP60-S1不含核酸和蛋白质。

图4 PP60-S1紫外全扫描光谱图Fig.4 UV scanning curve of PP60-S1
2.4 傅里叶变换红外光谱分析
PP60-S1在4000~400cm-1区具有多糖官能团特征吸收峰(图5)。由图5可见,3412.8cm-1的宽而强的吸收峰是糖分子中-OH基团的伸缩振动吸收峰;2928.0cm-1的吸收峰是C-H的伸缩振动峰;1658.0cm-1附近的吸收峰是多糖的水合振动峰;1378.8cm-1左右的吸收峰是C-H的弯曲振动吸收峰;1076.5cm-1的吸收峰为C=O伸缩振动特征峰,包括吡喃糖环的C-O-C伸缩振动和吡喃环中与羟基连接的C-O伸缩振动,说明其中的单糖以吡喃糖苷的形式存在[12-13];1730cm-1及1258cm-1附近没有特征吸收峰,表明该糖不含糖醛酸[14]。

图5 PP60-S1的红外光谱图Fig.5 FT-IR spectrum of PP60-S1
2.5 多糖PP60-S1的单糖组成分析
混合单糖标准品和PP60-S1乙酰化衍生物气相色谱图见图6。根据图6(b)得出,多糖PP60-S1组成单糖有三种,与标准单糖保留时间对比图6(a),根据保留时间顺序为甘露糖、葡萄糖和半乳糖,葡萄糖含量明显大于甘露糖和半乳糖。样品中三种糖的摩尔比为甘露糖∶葡萄糖∶半乳糖=1.00∶9.24∶0.76。这一结果与文献报道的松木层孔菌发酵菌丝体胞外多糖(主要由甘露糖组成)相比存在明显的差异[6]。
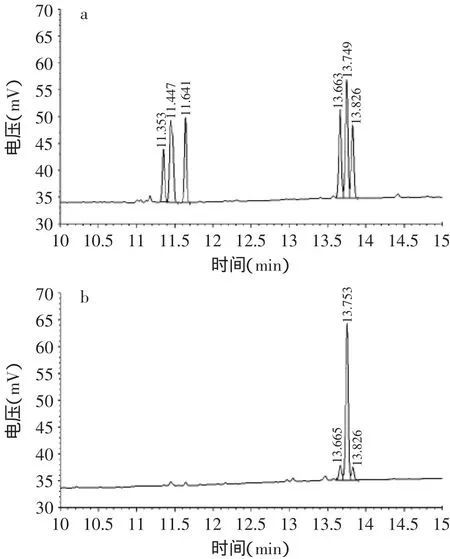
图6 乙酰化衍生物气相色谱图Fig.6 Gas chromatogram of acetyl derivatives
2.6 多糖PP60-S1的糖苷键连接方式分析
PP60-S1经甲基化、酸水解、还原及乙酰化,生成甲基化糖醇乙酸酯衍生物,对其进行GC-MS分析。根据相应保留时间的碎片离子峰和相关文献[15-19]对比得出PP60-S1的甲基化多糖及单糖连接位点归纳如表1所示。甲基化糖醇衍生物中占绝大部分的为2,3,4-Me3-Glcp,说明多糖PP60-S1分子的主链可能主要是通过1,6葡萄糖糖苷键连接组成,而且结构中还存在末端Glc。计算得到的甲基化单糖摩尔比与GC分析得出的单糖摩尔比基本符合,主要由葡萄糖组成,证明推断合理。从1-Glc和1,3,6-Man的摩尔比(1∶1)看,两者可能是相互连接的。
2.7 多糖PP60-S1的体外抗氧化活性测定结果
多糖PP60-S1的体外抗氧化活性结果见表2。结果发现在实验的浓度范围内,松木层孔菌多糖PP60-S1对DPPH和ABTS+·自 由 基 的 清 除 率 均 随 浓 度 增加而增加,呈量效关系,对DPPH自由基的半清除浓度(EC50)为 4.18mg/mL;对 ABTS+·自 由 基 的 半 清 除 浓度(EC50)为7.62mg/mL;反映总抗氧化能力的FRAP值为0.18mmol FeSO4/mg多糖。通过体外抗氧化活性的研究,发现松木层孔菌子实体纯化多糖PP60-S1具有一定的清除DPPH和ABTS+自由基活性和FRAP总抗氧化能力,但不及文献报道的松木层孔菌子实体粗多 糖 体 外 抗 氧 化 活 性[20],其 原 因 可 能 与 提 取 的 粗 多糖(未经纯化)连有蛋白质、核酸、酚类化合物等其他 活 性 成 分[21-22]有 关 ,其 具 体 原 因 需 要 进 一 步 研 究证实。

表1 松木层孔菌多糖PP60-S1的甲基化分析结果Table 1 Methylation analysis of Phellinus pini polysaccharide PP60-S1

表2 松木层孔菌多糖PP60-S1体外抗氧化活性结果Table 2 In vitro antioxidant activities of Phellinus pini polysaccharide PP60-S1
3 结论与讨论
真菌多糖主要存在于真菌子实体、菌丝体和发酵培养液中,并具有多种生物活性,如抗肿瘤、抗衰老、免疫调节、降血压、降血脂、降血糖等。作为一种天然的生物大分子,真菌多糖因其优良的生物活性和无毒性的特点,成为了生物学和医学领域的研究热点。本实验通过对松木层孔菌子实体粗多糖的提取和分离纯化,获得了一种均一性较好的水溶性多糖PP60-S1,此多糖主要由葡萄糖、甘露糖和半乳糖组成,其摩尔比为9.24∶1.00∶0.76。与文献已报道的松木层孔菌发酵菌丝体碱提多糖[5]和胞外多糖[6](主要由甘露糖组成)相比存在明显的差异,与刘安军[7]和Lee等[8]提取到的子实体多糖单糖组成较相符。经甲基化和GC-MS初步分析,PP60-S1主要由1,6-Glc构成,还存在少量其他的糖苷键,与Lee等得到的多糖组分EP-AV1和EP-AV2(以β-1,3葡聚糖为主)有一定的差别。另外,通过3种体外实验模型研究了松木层孔菌子实体多糖PP60-S1的体外抗氧化活性。结果表明,多糖PP60-S1对DPPH自由基和ABTS+自由基均表现出一定的清除活性以及FRAP总抗氧化能力。目前有研究表明,对具有抗氧化活性的多糖进行硫酸化、硒化及酯化等结构修饰和改造后,所得的修饰多糖抗氧化活性将会有较大的改善[23-24],因此通过对松木层孔菌多糖结构进行改造和修饰,有望得到一种更加安全高效和经济实用的天然抗氧化剂产品,对于松木层孔菌资源的开发利用具有一定的意义。
[1]Jang H J,Yang K S.Inhibition of nitric oxide production in RAW 264.7 macrophages by diterpenoids from Phellinus pini[J]. Archives of Pharmacal Research,2011,34(6):913-917.
[2]William A A,David J M,Priyotosh C.Phenolic and other metabolites of Phellinus pi ni,a fungus pathogenic to pine[J]. Phytochemistry,1996,42(5):1321-1342.
[3]王稳航,李玉刘,安军.松木层孔菌多糖的提取及抗氧化性研究[J]. 食品研究与开发,2006,27(11):53-55.
[4]王稳航,李玉,刘安军.松木层孔菌多糖对正常小鼠体内抗氧化功能的影响[J].现代生物医学进展,2008,8(8):1439-1441.
[5]裴丽娟,袁蕾,马姣妮,等.松木层孔菌多糖PEP的结构及活性研究[J]. 分子科学学报,2010,26(2):103-107.
[6]袁蕾,刘瑜,田法益,等. 松木层孔菌(Phellinus pini)胞外多糖结构解析[J]. 中国药学杂志,2013,48(8):597-600.
[7]刘安军,任寅,王稳航,等. 水 溶性Phellinus pini多糖PS1的分离提取及免疫活性研究[J]. 现代生物医学进展,2006,6(11):14-17.
[8]Lee S M,Kim S M,Lee Y H,et al.Macromolecules isolated from Phellinus pini fruiting body:Chemical characterization and antiviral activity[J].Macromolecular Research ,2010 ,18(6):602-609.
[9]Milardovic S,Ivekovic D,Grabaric B S.A novel amperometric method for antioxidant activity determination using DPPH free radical[J].Bioelectrochemistry,2006,68(2):175-180.
[10]Miller N J,Rice E C,Davies M J,et al.A novel method for measuring antioxidant status in premature neonates[J].Clinical Science,1993,84(4):407-412.
[11]Benzie I F F,Strain J J.The ferric reducing ability of plasma(FRAP) as a measure of“antioxidant power”:the FRAP assay [J].Analytical Biochemistry,1996,239(1):70-76.
[12]Luo J G,Liu J,Ke C L,et al.Optimization of medium composition forthe production ofexopolysaccharidesfrom Phellinus baumii Pilát in submerged culture and the immunostimulating activity of exopolysaccharides[J].Carbohydrate Polymers,2009,78:409-415.
[13]Bao X F,Duan J Y,Fang X,et al.Chemical modifications of the(1→3)-alpha-D-glucan from spores of Ganoderma lucidum and investigation oftheirphysciochemicalpropertiesand immunological activity[J].Carbohydrate Research,2001,336:127-140.
[14]Yang B,Jiang Y M,Zhao M M,et al.Structural characterisation of polysaccharides purified from longan(Dimocarpus longan Lour.) fruit pericarp[J].Food Chemistry,2009,115:609-614.
[15]Zhang A Q,Xiao N N,Deng Y L,et al.Purification and structural investigation of a water-soluble polysaccharide from Flammulina velutipes[J].Carbohydrate Polymers,2012,87:2279-2283.
[16]Kondakova A N,Fudala R,Senchenkova S N,et al.Structure of a lactic acid ether-containing and glycerol phosphate-containing O-polysaccharide from Proteus mirabilis O40[J].Carbohydrate Research,2005,340:1612-1617.
[17]Fan J M,Zhang J S,Tang Q J,et al.Structural elucidation of a neutral fucogalactan from the mycelium of Coprinus comatus [J].Carbohydrate Research,2006,341:1130-1134.
[18]Bao X F, Liu C P, Fang J N, et al.Structural and immunological studies of a major polysaccharide from spores of Ganoderma lucidum(Fr.) Karst[J].Carbohydrate Research ,2001,332:67-74.
[19]Kocharova N A,Ovchinnikova O G,Toukach F V,et al.The O-polysaccharide from the lipopolysaccharide of Providencia stuartii O44 contains L-quinovose,a 6-deoxy sugar rarely occurring in bacterial polysaccharides[J].Carbohydrate Research,2005,340:1419-1423.
[20]杨开,薛介丰,金月忠,等.松木层孔菌多糖的微波提取和体外活性研究[J].食药用菌,2013,21(2):102-107.
[21]Chen H X,Zhang M,Qu Z S,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Camellia Sinensis)[J].Food Chemistry,2008,106:559-563.
[22]Huang S Q,Ding S D,Fan L P.Antioxidant activities of five polysaccharides from Inonotus obliquus[J].International Journal of Biological Macromolecules,2012,50:183-1187.
[23]Ma L S,Chen H X,Zhang Y,et al.Chemical modification and antioxidant activities of polysaccharide from mushroom Inonotus obliquus[J].Carbohydrate Polymers,2012,89(2):371-378.
[24]Zhang Y L,Zhang J B,Mo X Y,et al.Modification,characterization and structure-anticoagulant activity relationships of persimmon polysaccharides[J].Carbohydrate Polymers,2010,82(2):515-520.
Study on isolation,structural characterization and antioxidant activity evaluation of polysaccharide PP60-S1 from Phellinus pini
YANG Kai1,2,JIN Yue-zhong1,XING Chen1,HU Jiang-ning2,WANG Ru-wei2,SUN Pei-long1,*
(1.Department of Food Science and Technology,Zhejiang University of Technology,Hangzhou 310014,China;2.Zhejiang Chinese Traditional Medicine and Natural Drug Research Institute,Hangzhou 310052,China)
The homogeneous polysaccharide PP60-S1 was obtained by water extraction ,ethanol precipitation and purified by DEAE-Sepharose F.F.and Sephacryl S-300 from the fruiting bodies of Phellinus pini.The polysaccharide PP60-S1 was composed of glucose,mannose and galactose with a molar ratio of 9.24∶1.00∶0.76,with an average molecular weight of 3.56 ×104u.The results of methylation analysis indicated that six kinds of glycosidic linkages were detected in the structure of PP60-S1:1-Glc、1,3-Glc、1,6-Glc、1,3-Gal、1,6-Gal、1,3,6-Man,respectively.The main chain contained mainly 1,6-Glc.Otherwise,the polysaccharide PP60-S1 exhibited a certain degree of antioxidant activity ,evaluated by in vitro assay of DPPH·, ABTS+· and ferricreducing antioxidant power(FRAP).
Phellinus pini;polysaccharide;purification;structural characterization;antioxidant activity
TS201.2
A
1002-0306(2014)20-0076-06
10.13386/j.issn1002-0306.2014.20.008
2014-02-24
杨开(1978-),男,博士,副研究员,研究方向:生物活性物质提取分离与结构表征。
* 通讯作者:孙培龙(1964-),男,博士,教授,博士生导师,研究方向:食品化学与资源利用。
浙江省自然科学基金资助项目(LY13C200011);国家科技支撑计划资助项目(2013BAD16B07)。

