绿豆清蛋白功能特性及热特性研究
李永武,刁静静,赵泽龙,张丽萍
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
绿豆清蛋白功能特性及热特性研究
李永武,刁静静,赵泽龙,张丽萍*
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
对水浸提法制备的绿豆清蛋白进行不同温度、不同pH、不同浓度对其功能特性的影响测试,并测试清蛋白的热变性温度。结果表明,在室温时,在等电点附近(pH4.6)绿豆清蛋白的溶解性、持水性最差,在偏离等电点时其溶解性、持水性显著提升;在中性条件下,在40℃时,溶解性、持水性最好;清蛋白吸油性随着温度升高而减弱;乳化性及乳化稳定性、起泡性及起泡稳定性随清蛋白浓度增加而增强,但增幅趋缓。热变性测试结果显示,绿豆清蛋白的初始变性温度100.1℃及焓变值ΔH(3.382J/g),说明清蛋白热稳定性较好。
绿豆清蛋白,功能特性,热特性
绿豆蛋白是绿豆淀粉生产中的主要副产物,传统的绿豆淀粉生产工艺后的制备的绿豆蛋白只能作为动物饲料。本文结合淀粉生产工艺,先将绿豆中溶于水的蛋白浸提制备出来,剩余产物再进行正常的酸浆法制备绿豆淀粉,以实现绿豆的高效利用。豆类中溶于水的蛋白是清蛋白,王鸿飞等[1]对绿豆进行了蛋白质的氨基酸组成成分分析,并根据联合国粮食及农业组织(FAO)和世界卫生组织(WHO)提出的氨基酸组成模式进行人体必需氨基酸化学评分,结果显示绿豆各蛋白质组分中,清蛋白评分最高,氨基酸组成全面,具有优良的蛋白质效率比(PER)、体外消化率(IVPD),是一种优质蛋白质。邓乾春等[2]发现,白果清蛋白提取物能增强受γ射线辐射损伤小鼠的抗氧化能力、造血功能及体内免疫功能,从而起到保护辐射损伤小鼠的作用。贾俊强等[3]研究发现,麦胚清蛋白营养价值高,可作为食品加工中的营养补充剂,且具有较好的溶解性、气泡性和乳化性等功能特性,可替代鸡蛋和牛乳蛋白等动物蛋白,用于提高蛋糕、面包、饼干和冰淇淋等食品的品质。
目前查得的资料显示,国内外对绿豆中清蛋白的功能特性及其热变性等研究还很少,尤其是针对我国绿豆粉(粉丝)加工中如何同时制备有效的蛋白质研究甚少。本实验系统研究(温度、pH、蛋白质浓度)对绿豆清蛋白功能特性(溶解性、持水性、持油性、起泡性、起泡稳定性、乳化性、乳化稳定性)的影响,并测试其热力学性质[4],以期为绿豆清蛋白在绿豆加工应用中提供理论依据。
1 材料与方法
1.1 材料与仪器
绿豆(绿丰五号) 市售;金龙鱼大豆油 益海嘉里食品有限公司;氢氧化钠、盐酸、纯净水、考马斯亮蓝、甲醇等 均为分析纯,大庆市恒博经贸有限公司。SKDA-800型自动凯氏定氮仪 上海沛欧分析仪器有限公司;DELTA320型精密pH计 梅特勒-托利多仪器公司;TD5A型高速离心机 上海安亭科学仪器厂;FW80型高速粉碎机 苏州江东精密仪器有限公司;TD5A-WS台式低速离心机 湖南湘仪实验室仪器开发有限公司;DH-5863型高温灰化炉 东莞市弘硕工业仪器有限公司;Sfy-6型水分测试仪 冠亚电子科技有限公司;Netzsch STA 449c型综合热分析仪 德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 绿豆清蛋白提取的工艺路线[5]
1.2.2 操作要点
1.2.2.1 绿豆粉碎 取清洁的绿豆原料,放入粉碎机中,粉碎后过60目筛子,收集浸提。
1.2.2.2 浸提 取绿豆干粉于烧杯中,按1∶21g/mL料液比加入纯净水,31℃下均匀搅拌。
1.2.2.3 低温离心 浸提搅拌3.5h后,将浸提液放入4℃冷藏箱静置15min,3200r/min离心分离30min,过滤取上清液。
1.2.2.4 上 清 液 酸 沉 取 离 心 上 清 液 ,缓 慢 滴 加0.1mol/L的HCl溶液,使用pH计将上清液调节至4.6,匀 速 搅 拌 ,保 持 pH恒 定10min,3200r/min 离 心 分 离15min,将所得的离心底物收集,进行透析脱盐。
1.2.2.5 喷 雾 制 粉 取 透 析 浓 缩 清 蛋 白 液 ,使 用B191型喷雾干燥器进行喷雾制粉,选取蠕动泵流量500mL/h,进口温度170℃,出口温度90℃制粉。得到乳白色细腻清蛋白粉,收集绿豆清蛋白粉,干燥保存。
1.2.3 绿豆清蛋白粉主要营养物质测定 水分含量的测定:GB 5009.3-2010;灰分含量的测定:GB 5009.4-2010;蛋白含量的测定:GB 5009.5-2010。每个样品测定三次。
1.2.4 绿豆清蛋白溶解性的测定 采用水溶性氮指数(NSI)可以准确知道溶解于水蛋白质含量,可用于衡 量 清 蛋 白 粉 溶 解 性[6]。 准 确 称 取0.5g蛋 白 样 品 于100mL离心管中,加入不同pH的盐酸,配制成50mL蛋白溶解液,在离心管中充分混匀,静置30min,使之溶解充分,3200r/min离心20min,收集上清液。采用微量凯氏定氮法测定上清液中的氮含量,根据公式(1)计算氮溶解指数(清蛋白溶解性)。分别测定室温条件下pH分别为3、4、4.2、4.4、4.6、4.8、5、6、7时和中性条件下温度为20、30、40、50、60℃时绿豆清蛋白的氮溶解指数,每个样品测定三次取平均值。
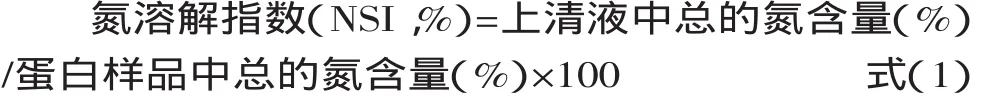
1.2.5 绿豆清蛋白持水性测定 蛋白质持水性指的是蛋白质制品的亲水性,是衡量蛋白产品吸附水的能力的重要指标[7]。在食品加工过程中,可以留住水分,保证食品的性状。本实验采用杨希娟[8]的方法,做适当改动,分别考察温度和pH对其持水性的影响。
第一组实验考察室温下不同pH对清蛋白持水性的影响:分别准确称取1g样品于9支编号离心管中,分别依次缓慢加入pH为3、4、4.2、4.4、4.6、4.8、5、6的盐酸,最后一组添加同质量的蒸馏水,用玻璃棒缓慢搅拌至样品呈糊状,用玻璃棒拭净管壁,1~8号管用2mL同浓度试剂将玻璃棒蛋白糊冲至离心管,9号管用2mL蒸馏水将玻璃棒蛋白糊冲至离心管,混合物静置30min,3200r/min离心5min,倾出离心管中多余试剂,称取蛋白糊质量,根据公式(2)计算清蛋白持水性。每组样品测定三次。
第二组实验考察中性条件下不同温度对清蛋白持水性的影响:分别准确称取1g样品于5支编号离心管中,分别依次缓慢加入为20、30、40、50、60℃的蒸馏水,用玻璃棒缓慢搅拌至样品呈糊状,用玻璃棒拭净管壁,用2mL同温度蒸馏水将玻璃棒蛋白糊冲至离心管,混合物在同实验温度条件下静置30min,于3200r/min离心5min,倾出离心管中多余水分,称取蛋白糊质量,根据公式(2)计算清蛋白持水性。每组样品测定三次。

1.2.6 绿豆清蛋白持油性的测定 蛋白质吸油性指的是蛋白质制品与油的亲和性,是衡量蛋白产品保持油脂能力的重要指标。本实验考察温度对清蛋白持油性的影响。
参照吴晓红等[9]的测定方法,具体操作如下:准确称取1g样品于离心管中,缓慢加入5mL大豆油,玻璃棒缓慢搅拌至样品呈糊状,用玻璃棒拭净管壁,分别将样品治愈20、30、40、50、60℃下在静置30min,于3200r/min离心5min,倾出管中析出的大豆油,称取糊状物质量,根据公式(3)计算清蛋白持油性。每个样品测定三次。

1.2.7 绿豆清蛋白起泡性及起泡稳定性的测定 蛋白质起泡性和起泡稳定性是衡量蛋白产品表面活性的重要指标。本实验考察温度对起泡性和起泡稳定性的影响[10]。
参照李静娟[11]的检测方法,做适当改动,分别考察不同浓度的绿豆清蛋白质溶液对起泡性和起泡稳定性的影响。具体操作如下:准确称取不同质量样品于100mL蒸馏水中,配制成浓度为1%、3%、5%、7%、9%的中性蛋白质溶液,在室温下放置30min,在高速组织捣碎机中以10000r/min均质3min,准确记录均质停止时的泡沫体积,根据公式(4),计算清蛋白的起泡性。每个样品测定三次。

在室温条件下,记录均质结束30min后泡沫体积,根据公式(5)计算清蛋白的起泡稳定性。

1.2.8 绿豆清蛋白乳化性及乳化稳定性的测定 蛋白质能降低水油混合物中水相和油相的表面张力,吸附分散在油相和水相的界面上,使之成为稳定的乳胶体。本实验考察蛋白质浓度对乳化性及乳化稳定性影响[12]。
参照刘东儿[13]的方法,并做适当改动。具体操作如下:分别准确配制浓度为1%、3%、5%、7%、9%的中性蛋白质溶液5mL,一次加入5mL大豆油,混匀1min,取1mL乳化液,放入1mL离心管,3200r/min离心5min,读取乳化层高度,根据公式(6)计算乳化性(EC),每个样品测定三次。

将测试完乳化性的样品在室温竖直放置30min,以3200r/min离心5min,读取乳化层高度,根据公式(7)计算乳化稳定性(ES),每个样品测定三次。

1.3 绿豆清蛋白热力学特性分析
取绿豆清蛋白粉2mg分散至铝盒,压盘,以空白铝盒为参照。温度扫描范围为:40~160℃,升高温度为10℃/min,保护气氮气流速:50mL/min。采用the universal analyzer 2000软件分析清蛋白的相关热变性数据[14]。
1.4 统计分析
实验中所有数据都是三次测定的平均值,使用SPSS 19.0软件进行样品平均值差异性显著分析[15]。
2 结果与分析
2.1 绿豆清蛋白主要成分分析
绿豆清蛋白的主要化学成分测定结果见表1。

表1 绿豆清蛋白主要化学成分Table 1 The main chemical components of mung bean protein
从表1可以看出,实验室制得的绿豆清蛋白粉,蛋白质含量为88.96%,符合分离蛋白的标准,可以进行功能特性的检测。
2.2 绿豆清蛋白溶解性测定
蛋白质粉作为食品加工原料,蛋白质的溶解性是评价蛋白质质量的首要指标,它决定了蛋白质溶解于水相后的状态,与起泡性、乳化性、风味等多种蛋白质功能特性有重要关系。
2.2.1 pH对绿豆清蛋白溶解性的影响 图1是室温下不同pH条件对绿豆清蛋白溶解性的影响。
分析图1可知,在pH3~7的范围内,绿豆清蛋白的溶解性呈现先下降后上升的趋势。当pH为4.6时,清蛋白的溶解性最差为7.68%,说明此时清蛋白的总电荷为零,绿豆清蛋白分子之间的静电排斥力较小,不容易被水分子分散,为绿豆清蛋白的等电点;单因素方差分析表明,pH继续升高,溶解性显著提升,说明偏离等电点后,蛋白质分子所携带的负电荷逐渐增多,分子间静电排斥作用增强,水分子对清蛋白的分散作用提升明显,表现为清蛋白的溶解性增加。
2.2.2 温度对绿豆清蛋白溶解性的影响 图2为pH7时不同温度对绿豆清蛋白溶解性的影响。

图1 pH对绿豆清蛋白溶解性的影响Fig.1 Effect of pH on the solubility of Mung bean protein

图2 温度对绿豆清蛋白溶解性的影响Fig.2 Effect of temperature on the solubility of mung bean protein
分析图2可知,在温度为20~40℃时,绿豆清蛋白的溶解性随着温度的升高而增大,在40℃时,溶解性最佳达到79.24%,继续升高温度,绿豆清蛋白的溶解性呈现下降趋势;说明温度较低时,绿豆清蛋白与水的分子间相互作用较弱,蛋白质溶解性较差;温度升高时,分子间运动加剧,蛋白质分子和水分子的相互作用加强,有利于蛋白质分子在水中的分散,绿豆清蛋白溶解性也随着增加;温度再继续升高,蛋白质分子中的一些弱键发生断裂,蛋白质发生变性,溶解性出现下降。
2.3 绿豆清蛋白持水性测定
2.3.1 pH对绿豆清蛋白持水性的影响 图3是室温下不同pH对绿豆清蛋白持水性的影响。因清蛋白在中性条件下浸提,本次测试只考察到酸性和中性条件下清蛋白持水性。
由图3可知,室温下,绿豆清蛋白的持水性随着pH的升高呈现先下降后上升的趋势。当pH在等电点(pH4.6)附近时,清蛋白质分子本身呈现电中性,蛋白质分子间相互缔合收缩,持水性最低为2.78g/g,显著性检验分析可知,在当pH偏离等电点时,清蛋白的持水性显著提升,在中性条件下,达到最佳为5.02g/g。
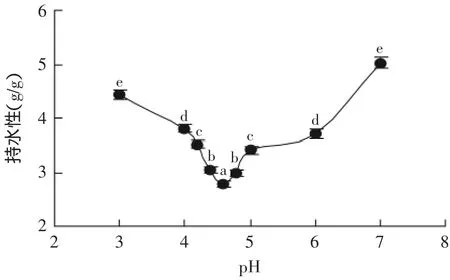
图3 pH对绿豆清蛋白持水性的影响Fig.3 Effect of pH on the water holding capacity of mung bean protein
2.3.2 温度对绿豆清蛋白持水性的影响 图4是考察中性条件下不同温度对绿豆清蛋白持水性的影响。

图4 温度对绿豆清蛋白持水性的影响Fig.4 Effect of temperature on the water holding capacity of mung bean protein
由图4可知,中性条件下,绿豆清蛋白的持水性随着温度的升高呈现先上升后下降的趋势。当温度为20~40℃区间时,绿豆清蛋白的持水性随着温度的升高而增大,在40℃时,持水性最佳达到5.36g/g;继续升高温度,蛋白质分子结合水分子的能力减弱,表现为持水性下降。
2.4 绿豆清蛋白持油性测定
图5是不同温度对绿豆清蛋白持油性的影响。

图5 温度对绿豆清蛋白持油性的影响Fig.5 Effect of temperature on the oil-absorbing capacity of mung bean protein
由图5可知,绿豆清蛋白的持油随着温度的升高呈下降趋势,温度为20~40℃区间时,清蛋白的持油性的改变不大;继续升高温度,大豆油本身流动性增加,蛋白质分子与大豆油的吸附性减弱,持油性继续下降。
2.5 绿豆清蛋白起泡性及起泡稳定性测定
图6是不同清蛋白浓度对绿豆清蛋白起泡性和起泡稳定性的影响。
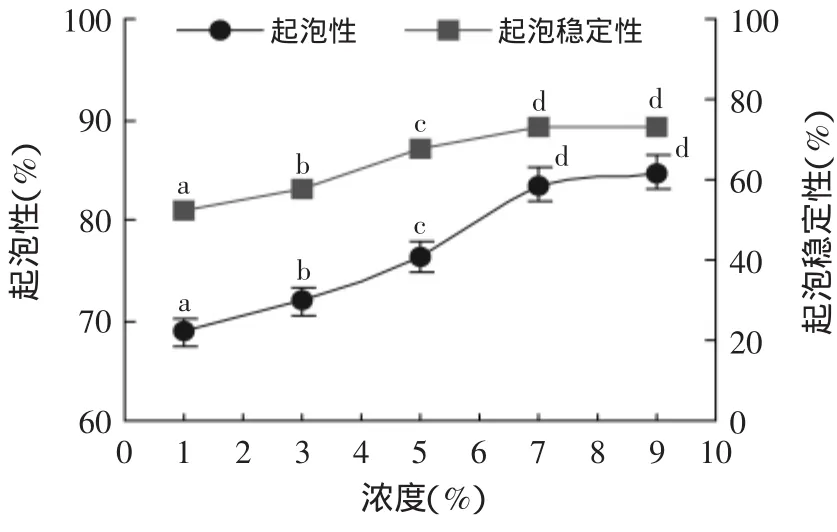
图6 清蛋白浓度对绿豆清蛋白起泡性及起泡稳定性的影响Fig.6 Effect of protein concentration on the foaming capacity and foam atability of mung bean protein
分析图6可知,绿豆清蛋白的起泡性和起泡稳定性率随着蛋白质浓度的增加都有不同程度的增加,说明随着蛋白浓度的增加,参与搅打成膜的蛋白质分子增多,蛋白质分子间的作用增强,更易互相结合形成稳定的泡沫,且能维持较长时间;单因素方差分析说明,在蛋白质浓度为7%以后,清蛋白起泡性和起泡稳定性的增幅随着蛋白质浓度增加趋缓,在浓度为9%时,起泡性最佳为84.67%,起泡稳定性为73.32%。
2.6 绿豆清蛋白乳化性及乳化稳定性测定
图7是不同清蛋白浓度对绿豆清蛋白乳化性和乳化稳定性的影响。
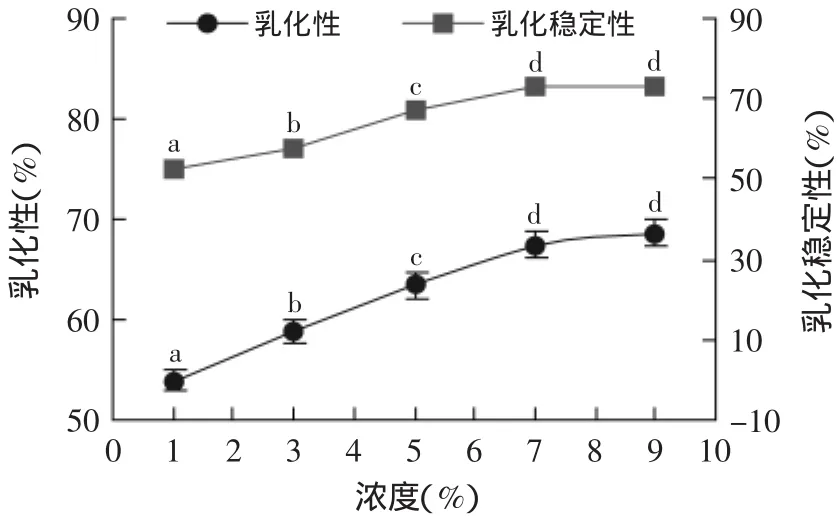
图7 蛋白质浓度对绿豆清蛋白乳化性及乳化稳定性的影响Fig.7 Effect of protein concentration on the foaming capacity and foam stability of mung bean protein
分析图7可知,绿豆清蛋白乳化性和乳化稳定性随着清蛋白质浓度增加有不同程度的提升。单因素方差分析表明,随着蛋白质增加,相关乳化性和乳化稳定性的增幅逐渐趋缓,这是因为提升蛋白质浓度,增加了水油界面结合蛋白质分子数,参与乳化的蛋白质分子增多有利于界面稳定。蛋白质浓度超过7%后,相关性质提升不显著,可能是浓度过大,蛋白质分子与水分子作用不充分。
2.7 绿豆清蛋白DSC热差示扫描分析
图8为绿豆清蛋白的热差示扫描(DSC)图谱。目前尚未有研究报道绿豆清蛋白热变性的研究,如图8所示,绿豆清蛋白的起始变性温度为100.1℃,清蛋白的吸热峰为116.5℃,焓变值ΔH(3.382J/g),由图表明绿豆清蛋白具有较高的热稳定性[16]。
3 结论
实验室自制的绿豆清蛋白粉的蛋白质含量为88.96%,pH对绿豆清蛋白的溶解性和持水性的影响显著,在室温下,溶解性(7.68%)、持水性(2.78g/g)在等电点(pH4.6)时最差,在中性时其溶解性(57.09%)、持水性(5.02g/g)最佳;在中性条件下,40℃时,溶解性(79.24%)、持水性(5.36g/g)最好;清蛋白吸油性随着温度升高而减弱;乳化性及乳化稳定性、起泡性及起泡稳定性着清蛋白浓度增加而增强,但增幅趋缓。蛋白质热变性测试表明,绿豆清蛋白的起始变性温度为100.1℃,吸热峰为116.5℃,峰型较宽,说明其变性过程较长,热变协同性较差,绿豆清蛋白是是具有优良的功能特性的植物蛋白。
[1]王鸿飞,樊明涛.绿豆种子蛋白质和氨基酸组成特性的研究[J]. 江苏理工大学:自然科学版,2000,21(3):39-41.
[2]邓乾春,陈春艳,段会轲,等.白果清蛋白提取物对γ射线辐射损伤小鼠的保护作用研究[J]. 辐射研究与辐射工艺学报,2005,23(6):359-365.
[3]贾俊强,马海乐,赵伟睿,等.超声波处理对麦胚清蛋白结构和功能性质的影响[J]. 过程工程学报,2009,9(1):107-112.
[4]刘岩,赵冠里,苏新国.花生球蛋白和伴球蛋白的功能特性及构象研究[J]. 现在食品科技,2013,29(9):2095-2101.
[5]刘文菊,沈群,刘杰. 酸浆法 生产淀粉机 理研究初探[J]. 食品科学,2006,27(1):79-82.
[6]刘高梅,任海伟.不同功率超声波对芸豆蛋白理化和功能性质的影响[J]. 中国粮油学报,2012,27(12):17-21.
[7]陶健,毛立新,杨小姣,等.荞麦蛋白的功能特性研究[J].中国粮油学报,2005,20(5):46-50.
[8]杨希娟,党斌,吴昆仑,等. 青稞蛋白的超声波辅助提取工艺及其功能特性研究[J]. 中国食品学报,2013,13(6):48-56.
[9]吴晓红,刘经纬,郑月明,等.红松种子水溶性蛋白吸水性、吸 油 性 及 溶 解 性 的 研 究 [J]. 食 品 工 业 科 技 ,2010(9):140-143.
[10]梁丽琴,袁道强. 绿豆分离 蛋白功能特 性研究[J]. 郑州轻工业学院学报:自然科学版,2005,20(1):50-55.
[11]李静娟,易建华,朱振宝,等.桃仁蛋白与大豆分离蛋白功能特性比较[J]. 食品与发酵工业,2010,36(12):100-104.
[12]郑志雄,杨晓泉.大豆乳清蛋白的热变性和热聚集的研究[J]. 食品工业科技,2009,30(4):100-103.
[13]刘东儿,吕天喜.绿豆分离蛋白的制备及其功能特性的研究[J]. 粮食与食品工业,2007,14(2):27-30.
[14]Meng G T,Ma C Y.Thermal properties of Phaseolus angularis(red bean)globulin[J].Food Chemistry,2001,23:453-460.
[15]王钦德,杨坚. 食品实 验设计与统 计分析[M]. 北京 :中 国农业大学出版社,2008:102-147.
[16]Yin S W,Tang C H,Cao J S,et al.Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (Cannabis sativa L.) protein isolate[J].Food Chemistry,2008,106:1004-1013.
Study on the functional and thermal properties of mung bean albumin
LI Yong-wu,DIAO Jing-jing,ZHAO Ze-long,ZHANG Li-ping*
(College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319,China)
The functional and thermal properties of mung bean albumin isolated by water extraction was tested in this paper.The effects of pH,temperature,protein concentration and on functional properties (solubility,water-holding capacity,oil-absorbing capacity ,emulsifying capacity and emulsion stability ,foaming capacity and foam stability) of mung bean albumin were investigated.The results showed that the solubility ,waterholding capacity of mung bean albumin were the lowest around isoelectric point(pH4.6).The solubility,waterholding capacity could be improved with excepting pH4.6.The solubility ,water-holding capacity of mung bean albumin were the best at 40℃ .The oil-absorbing capacity was lower with increasing temperature.With the increasing of mung albumin concentration,its emulsifying and emulsion stability,foaming and foaming stability resistance increased but slowly.The test of thermal denaturation results showed that mung bean albumin denaturation temperature was 100.1℃ and the value of the enthalpy change was ΔH(3.382J/g) and the albumin had good thermal stability.
mung bean albumin;conformational properties;thermal properties
TS214.9
A
1002-0306(2014)20-0128-05
10.13386/j.issn1002-0306.2014.20.019
2014-02-28
李永武(1989-),男,硕士研究生,研究方向:食品科学。
* 通讯作者:张丽萍(1957-),女,博士,教授,研究方向:杂粮深加工。基金项目:国家杂粮工程技术研究中心研究课题。

