苦杏仁多酚氧化酶的理化特性
张清安,范学辉,2,3,武海波,田呈瑞
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710062;2.陕西师范大学生命科学学院,陕西 西安 710062;3.陕西师范大学体育学院,陕西 西安 710062)
苦杏仁多酚氧化酶的理化特性
张清安1,范学辉1,2,3,武海波1,田呈瑞1
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710062;2.陕西师范大学生命科学学院,陕西 西安 710062;3.陕西师范大学体育学院,陕西 西安 710062)
研究苦杏仁多酚氧化酶粗提物的理化特性。结果表明:苦杏仁多酚氧化酶活性的最佳测定波长为410 nm,底物邻苯二酚最佳浓度为1.0 mol/L,Km和Vmax分别为20.53 mol/L和1.27 U/min,最适缓冲液pH值为7.40,最适反应温度和时间分别为40 ℃和3 min。热稳定性实验表明:苦杏仁多酚氧化酶在30~50 ℃范围内,热处理时间对其活性影响较小;在60~100 ℃范围内,随着温度增加酶活力也随之快速下降,使苦杏仁多酚氧化酶(polyphenol oxidase,PPO)活性丧失50%所需时间从60 ℃的15 min缩短到100 ℃的3 min左右。
苦杏仁;多酚氧化酶;理化特性
杏(Prunus armeniaca)原产于我国,属蔷薇科(Rosaceae)李亚科杏属植物,主要分布在我国的东北、华北、西北,为“三北”地区主要经济林树种之一。其果实色泽鲜艳、果肉多汁、营养丰富,深受人们喜爱。杏仁为杏果的干燥种子,呈扁心形、表面红棕色至深黄色。
按苦杏仁苷含量不同可以将杏仁分为甜杏仁和苦杏仁两种,后者含量是前者的10倍左右。甜杏仁经常用于直接食用或作为食品加工原辅料,而苦杏仁因含有丰富的苦杏仁苷(2%~7%)、油脂(45%)、蛋白质(25%)、碳水化合物(3%)、多种维生素和微量元素(如钾、钙、铁等)等营养成分,具有极高的食用和药用价值,是开发功能食品的良好原料,分别被国家卫生部、美国食品药品监督管理局和世界卫生组织列为首批药食两用物质和认定为健康食品[1]。
目前,我国杏仁产量的80%左右以原料形式卖出,只有少数粗加工品,缺乏对杏仁进行综合精深加工及利用的研究[2-6]。其商业化产品大致可以分为3 类:第1类是以“露露”为代表的杏仁蛋白饮料;第2类是为数不多的杏仁罐头类产品;第3类是以“光中杏”为代表的去皮、脱苦干杏仁。对于以上产品的加工,脱除杏仁种皮是必经工序。但由于杏仁中含有酚酸类物质和多酚氧化酶(polyphenol oxidase,PPO),会使杏仁在去皮后迅速氧化褐变,从而影响杏仁的营养和经济价值,因此褐变控制已成为制约杏仁深加工产业的瓶颈和急需突破的关键技术。
目前,国内外尚无有关苦杏仁去皮过程中褐变及控制方面的研究报道[7-9]。本课题组对杏仁加工褐变产物及机理的初步研究发现,苦杏仁去皮过程中的褐变主要是酶促褐变。本研究以杏仁多酚氧化酶为对象对其部分理化特性进行探讨,以期为解决杏仁去皮加工过程中的褐变控制提供理论依据。
1 材料与方法
1.1 材料与试剂
苦杏仁购自西安市西北药材市场。
硫酸铵、氢氧化钠、邻苯二酚、邻苯三酚 天津市科密欧化学试剂有限公司;绿原酸、阿魏酸、咖啡酸中国食品药品检定研究院;磷酸氢二钾、乙酸钠 天津市天力化学试剂有限公司;磷酸二氢钾 天津市登丰化学品有限公司;冰乙酸 天津市富宇精细化工有限公司;无水乙醇、丙酮 西安化学试剂厂;聚乙烯吡咯烷酮K30(PVP K30) 德国Basf公司;以上试剂均为分析纯。
1.2 仪器与设备
PL203型电子天平 梅特勒-托利多仪器(上海)有限公司;HH-SA电热恒温水浴锅 北京科伟永兴仪器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;Alphal-4真空冷冻干燥机 德国Christ公司;TGL-16G冷冻离心机 上海安亭科学仪器厂产品;FW400A万能粉碎机 北京科伟永兴仪器有限公司;PHS-3C pH计 上海(雷磁)仪电科学仪器股份有限公司。
1.3 方法
1.3.1 苦杏仁PPO的提取
将经(-28±0.5)℃冷冻处理过的苦杏仁与PVPK30(酚类物质去除剂[6])按质量比100:1一起粉碎后,快速取出放入预冷丙酮中;在低温下处理1 h后用布氏漏斗抽滤,直至成为白色粉末。称取100 g上述白色苦杏仁粉末与500 mL 0.05 mol/L磷酸盐缓冲液(pH 7.00)混匀,提取一定时间后以3 000 r/min离心15 min[10-11];取上清液用40%硫酸铵于4 ℃条件下盐析, 低温下11 000 r/min离心10 min,收集沉淀并于真空下冷冻干燥,即得苦杏仁多PPO粗提物,低温保存待用,使用前配制成一定浓度的溶液。
1.3.2 苦杏仁PPO活性的测定
1.3.2.1 PPO反应体系最佳吸收波长的选择
将2.0 mL 0.05 mol/L磷酸盐缓冲液(pH 7.00)和0.5 mL 1.0 mol/L邻苯二酚溶液加入比色皿中,混匀后再加入0.1 mL粗酶液迅速振荡,分别在350、370、390、410、430、450、470、490 nm波长处记录其6 min内吸光度的变化,每15 s记录1次,计算酶活力并依据其大小选择最佳测定波长。以吸光度增加的最初直线部分计算酶活力,一个酶活力单位U定义为在测定条件下1 min引起0.001个吸光度的改变[12-13]。
1.3.2.2 PPO酶活性测定时间的选择
将0.1 mL粗酶液加入到0.5 mL 1.0 mol/L邻苯二酚与2.0 mL 0.05 mol/L磷酸盐缓冲液(pH 7.00)中,迅速摇匀后在410 nm波长处记录6 min内吸光度的变化,每15 s记录一次,确定测定酶活力的最佳时间。
1.3.2.3 PPO专一性底物的选择
分别以浓度为1.0 mol/L的邻苯二酚、邻苯三酚、阿魏酸、绿原酸和咖啡酸为底物,按照1.3.2.1节和1.3.2.2节所确定的方法测定酶活性,从而确定合适的底物。
1.3.2.4 PPO底物浓度的选择及其米氏常数和最大反应速率的确定
以1.3.2.3节所确定的邻苯二酚为底物,配制0.05、0.10、0.20、0.40、0.60、0.80、1.00、1.20 mol/L系列溶液,按1.3.2.1、1.3.2.2节方法测定A410nm并计算酶活力,确定合适的底物浓度及反应进程曲线;并运用Lineweaver-Burk双倒数作图法计算出酶促反应的米氏常数Km和最大反应速率
1.3.3 pH值对苦杏仁PPO活性的影响
配制pH值为3.60、4.50、5.80、6.50、7.00、7.40、8.00、8.40、9.00的系列缓冲溶液,按1.3.2.1、1.3.2.2节方法测定A410nm并计算酶活力,观察pH值对PPO活性的影响。
1.3.4 温度和时间对苦杏仁PPO活性的影响
将粗酶液分别在20、30、40、50、60、70、80、90、100 ℃条件下保温15 min[14];然后按照1.3.2.1、1.3.2.2节方法测定酶活力,研究苦杏仁PPO的最适活性温度。
将酶液分别在30、40、50、60、70、80、90、100 ℃下保温5、10、15、20、25、30、35、40 min,然后按照1.3.2.1、1.3.2.2节方法测定酶活力,研究保温时间和温度对苦杏仁PPO活性的影响。
1.4 数据处理
实验数据均是3次测定结果的平均值,并采用SPSS软件处理。
2 结果与分析
2.1 苦杏仁PPO反应体系最佳吸收波长的选择
由图1可知,苦杏仁PPO与邻苯二酚反应产物在410 nm波长处活性最大,有明显吸收峰且符合苯醌的特征,这与大多数果蔬中PPO活性测定时所用吸收波长基本一致[11,13]。虽然与Arslan等[10]研究报道的420 nm有所不同,这可能与所用的杏原料差异有关,因此本实验中采用410 nm作为反应体系的测定波长。

图1 苦杏仁PPO活性测定最佳吸收波长的选择Fig.1 The optimal absorption wavelength for the determination of apricot kernel PPO activity
2.2 苦杏仁PPO活性测定时间的选择
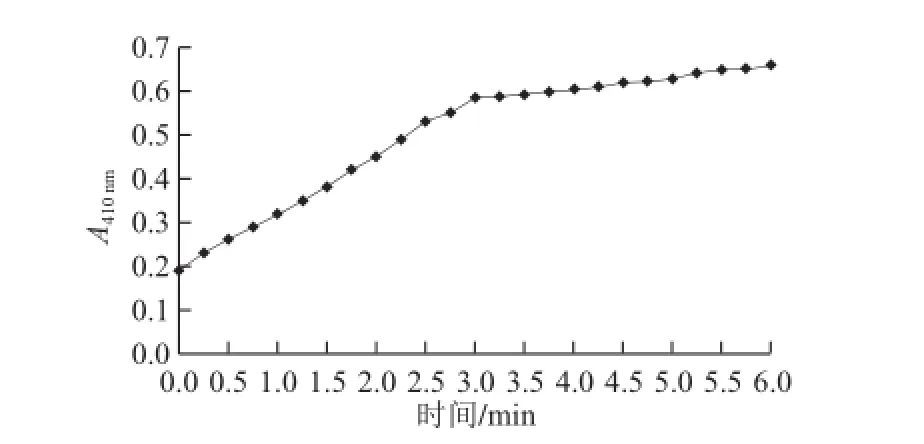
图2 苦杏仁PPO反应体系中A410 nm与时间的关系Fig.2 Relationship between A410 nmof the PPO reaction system and reaction time
由图2可知,苦杏仁PPO与底物反应体系的A410nm在6 min反应时间内呈逐渐增大趋势,而且在前3 min内A410nm的变化呈线性增加,相关系数R2为0.998 5。
2.3 苦杏仁PPO专一性底物的选择

表1 不同底物的苦杏仁PPO酶活力Table 1 Effect of substrate type on PPO activity
酶对底物的催化能力由其结合能力决定,反映了酶促褐变发生的难易程度。由表1可知,不同底物对苦杏仁PPO活性有较大影响,在相同条件下,以邻苯二酚和绿原酸为底物酶活力单位较大,分别达到85、68 U;而以邻苯三酚、阿魏酸和咖啡酸作为底物时,苦杏仁PPO活性相对较小,因此本实验选用酶活力单位最大的邻苯二酚为测定苦杏仁PPO活力的反应底物。
2.4 苦杏仁PPO底物浓度的选择及其米氏常数和最大反应速率的确定
由图3可知,在实验条件下底物浓度对酶活力测定有显著影响,随着底物浓度的升高,酶液反应较充分;当底物浓度大于1.0 mol/L时酶活力增长变缓,趋于平稳,可 能是反应产物的积累影响了酶活性。当底物浓度在0.4~1.0 mol/L之间变化时,酶活力与底物浓度呈正相关,表现为一级反应。因此,后期实验均采用1.0 mol/L的底物浓度,以确保酶液反应完全。
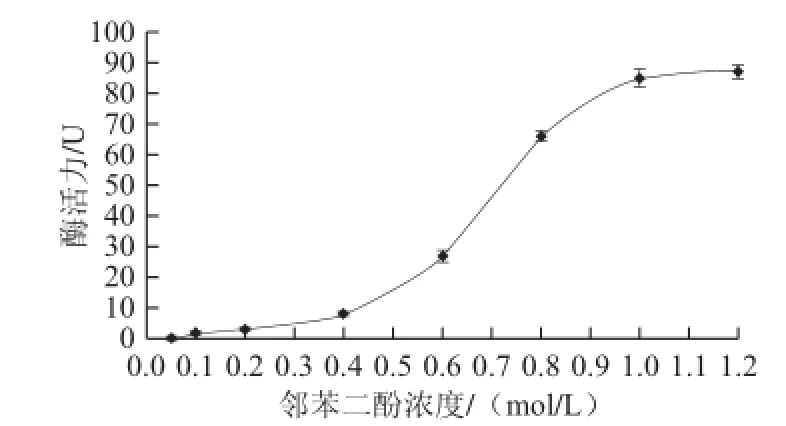
图3 底物浓度对苦杏仁PPO活性的影响Fig.3 Effect of substrate concentration on PPO activity of apricot kernel

图4 邻苯二酚为PPO底物的双倒数曲线Fig.4 Lineweaver-Burk curve of PPO using catechol as the substrate
由图4可知,以邻苯二酚做为苦杏仁PPO底物时,其反应规律高度符合米氏方程,根据图中直线斜率和纵轴截距,求得底物的Km和Vmax分别为20.53 mol/L和1.27 U/min。
2.5 pH值对苦杏仁PPO活性的影响

图5 pH值对苦杏仁PPO活性的影响Fig.5 Effect of pH on PPO activity of apricot kernel
由图5可知,苦杏仁PPO活力对pH值变化较为敏感,在测定的pH值范围内,苦杏仁PPO的活性整体上呈先增后渐趋势,pH 7.40左右时酶活力最大,这与大多数果蔬PPO在pH 7.00左右活性最大基本一致[15-19]。不过,Arslan[10]、Dijkstra[20]等曾报道杏果PPO最适pH值分别为8.50和6.50,可能与实验测定条件有关,也可能是杏果与杏仁中PPO组成及特性本身不同所致[21-25]。
2.6 温度和时间对苦杏仁PPO活性的影响

图6 不同处理温度对苦杏仁PPO活性的影响Fig.6 Effect of temperature on PPO activity of apricot kernel
由图6可知,在保温时间均为15 min条件下,PPO酶活力随着处理温度的升高呈现先升后降的趋势,在40 ℃左右时酶活力最大;随后快速下降,当温度达到70 ℃以上酶活力仅为最大酶活力的10%左右。温度对苦杏仁PPO活力的影响表现在两方面:在20~40 ℃之间随着温度的升高,参与反应的PPO分子动能增大,催化反应速度加快;当温度高于40 ℃时,分子运动随着温度的升高急剧加速,PPO活性中心改变导致酶活力降低。因此可以初步判定苦杏仁PPO的最适温度为40 ℃,变性温度在70 ℃以上。

图7 苦杏仁PPO的热稳定性Fig.7 Thermostability of PPO from apricot kernel
由图7可知,在30~50 ℃之间不同处理时间对苦杏仁PPO活性影响不大,适度处理可以使相对酶活力有所提高,尤其40 ℃时效果更明显;而在70~100 ℃之间处理15 min即可使酶活性有较大程度抑制,仅为原来的20%左右;使酶活性丧失50%所需时间从60 ℃的15 min到100 ℃的3 min左右。因此,在杏仁脱皮、去苦等加工过程中可根据该特性,对杏仁的酶促褐变加以控制。
3 结 论
实验结果表明,苦杏仁PPO活性测定最佳波长为410 nm,底物邻苯二酚最适浓度为1.0 mol/L,Km和Vmax分别为20.53 mol/L和1.27 U/min,最适缓冲液pH值为7.40,最适反应温度和时间分别为40 ℃和3 min。热稳定性实验表明,使苦杏仁PPO活性丧失50%所需时间从60 ℃的15 min到100 ℃的3 min左右。
[1] 张加延. 李杏资源研究与利用进展(五)[M]. 北京: 中国林业出版社, 2008: 18-31.
[2] 王波. 苦杏仁综合利用关键技术研究[D]. 重庆: 西南大学, 2012: 6.
[3] 张清安, 范学辉, 岳宣峰, 等. 不同贮藏温度对杏仁油品质影响研究[J].食品科学, 2008, 29(1): 347-349.
[4] 王将, 郑亚军, 冯翠萍. 杏仁皮中黄酮类化合物抗氧化性的研究[J].中国粮油学报, 2010, 25(1): 78-81.
[5] PRATS-MOYA S, GRANE-TERUEL N, BERENGUER-NAVARRO V, et al. Inductively coupled plasma application for the classification of 19 almond cultivars using inorganic element composition[J]. Journal of Agricultural and Food Chemistry, 1997, 45(6): 2093-2097.
[6] 李军. 苦杏仁脱苦工艺的研究[D]. 北京: 北京林业大学, 2012: 6.
[7] 冯郁蔺, 陈伟, 张清安. 杏仁蛋白质的提取及功能特性研究进展[J].农产品加工: 学刊, 2011(9): 61-63.
[8] 张京芳, 陈锦屏, 田呈瑞. 不同处理对控制杏酶褐变的研究[J]. 西北农业大学学报, 1997, 25(20): 94-98.
[9] 罗依扎·瓦哈甫, 刘军, 邢军. 开口杏核脱色工艺研究[J]. 食品工业科技, 2008(12): 177-181.
[10] ARSLAN O, TEMUR A, TOZLU I. Polyphenol oxidase from malatya apricot (Prunus armeniaca L.)[J]. Journal of Agricultural and Food Chemistry, 1998, 46(6): 1239-1241.
[11] 张百刚. 红枣多酚氧化酶 (PPO) 特性及抑制其酶促褐变的研究[D].西安: 陕西师范大学, 2006.
[12] 慈志娟. 杏果实酶促褐变与制汁适应性评价体系的研究[D]. 泰安:山东农业大学, 2007.
[13] 王璋. 食品酶学[M]. 北京: 中国轻工业出版社, 1990.
[14] YEMENICOGLU A, CEMEROGLU B. Consistency of polyphenol oxidase (PPO) thermostability in ripening apricots (Prunus armeniaca L.): evidenec for the presence of thermostable ppo forming and destabilizing mechanisms in apricots[J]. Journal of Agricultural and Food Chemistry, 2003, 51(8): 2371-2379.
[15] 曾朝珍, 张永茂, 康三江, 等. 果蔬褐变抑制机理研究进展[J]. 北方园艺, 2013(5): 186-190.
[16] 宋晓雪, 胡文忠, 毕阳, 等. 鲜切果蔬酶促褐变关键酶的研究进展[J].食品工业科技, 2013(15): 390-393.
[17] 罗海波, 何雄, 包永华, 等. 鲜切果蔬品质劣变影响因素及其可能机理[J]. 食品科学, 2012, 33(15): 324-330.
[18] 白永亮, 余铭, 袁根良, 等. 大蕉后熟期的褐变相关性及褐变底物鉴定[J]. 食品科学, 2012, 33(4): 271-275.
[19] 李瑜, 杨国浩, 詹丽娟, 等. 双孢菇中多酚氧化酶活性的影响因素[J].食品科学, 2011, 32(18): 319-322.
[20] DIJKSTRA L, WALKER J R L. Enzymatic browning in apricots (Prunus armeniaca)[J]. Journal of the Science of Food and Agriculture, 1991, 54(2): 229-234.
[21] BAyMNDIRL A, ALPAS H, BOZOGLU F, et al. Efficiency of high pressure treatment on inactivation of pathogenic microorganisms and enzymes in apple, orange, apricot and sour cherry juices[J]. Food Control, 2006, 17(1): 52-58.
[22] MADRAU M A, PISCOPO A, SANGUINETTI A M, et al. Effect of drying temperature on polyphenolic content and antioxidant activity of apricots[J]. European Food Research and Technology, 2009, 228(3): 441-448.
[23] 李桂琴, 刘坤, 高志华, 等. 鸭梨果肉多酚氧化酶的活性研究与纯化[J].河北农业大学学报, 2010, 33(5): 45-49.
[24] BUCKOW R, WEISS U, KNORR D. Inactivation kinetics of apple polyphenol oxidase in different pressure-temperature domains[J]. Innovative Food Science & Emerging Technologies, 2009, 10(4): 111-118.
[25] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 22(2): 215-222.
Physico-chemical Properties of Polyphenol Oxidase from Apricot Kernel
ZHANG Qing-an1, FAN Xue-hui1,2,3, WU Hai-bo1, TIAN Cheng-rui1
(1. College of Food Engineering and Nutritional Science,Shaanxi Normal University, Xi’an 710062, China ; 2. College of Life Sciences, Shaanxi Normal University, Xi’an 710062, China; 3. College of Sports, Shaanxi Normal University, Xi’an 710062, China)
The major physico-chemical properties of polyphenol oxidase (PPO) from apricot kernel were studied in this paper. The results showed that the optimum parameters for determining the PPO activity of apricot kernel were established by using catechol as the substrate at a concentration of 1.0 mol/L, reaction at 40 ℃ for 3 min in pH 3 buffer solution and detection at a wavelength of 410 nm. The corresponding Kmand Vmaxwere 20.53 and 1.27 U/min, respectively. The thermostability of PPO activity from apricot kernel suggested that treatment time had a slight influence on the PPO activity in the temperature range of 30 - 50 ℃, while the PPO activity decreased sharply with an increase in treatment time at a given temperature of 60 - 100 ℃. The half-life time of PPO activity was 15 and 3 min at the temperature of 60 and 100 ℃, respectively.
apricot kernel; polyphenol oxidase (PPO); physico-chemical property
TS201.1
A
1002-6630(2014)15-0132-04
10.7506/spkx1002-6630-201415027
2013-08-23
国家自然科学基金青年科学基金项目(31101324);陕西省自然科学基金项目(2011JQ2003);中央高校基本科研业务费专项资金项目(GK201302039;GK201404006)
张清安(1976—),男,副教授,博士后,主要从事功能食品开发和食品加工过程控制研究。E-mail:qinganzhang@snnu.edu.cn

