酶法富集小黄鱼内脏鱼油中EPA和DHA甘油酯
刘国艳,张田田,王金星,孙贝贝,边 昊,徐 鑫*
(扬州大学食品科学与工程学院,江苏 扬州 225127)
酶法富集小黄鱼内脏鱼油中EPA和DHA甘油酯
刘国艳,张田田,王金星,孙贝贝,边 昊,徐 鑫*
(扬州大学食品科学与工程学院,江苏 扬州 225127)
目的:以小黄鱼内脏精炼鱼油为原料,通过脂肪酶选择性水解法富集二十碳五烯酸(eicosapentaenoic acid,EPA)甘油酯和二十二 碳六烯酸(docosahexaenoic acid,DHA) 甘油酯。方法:采用气相色 谱峰面积外标法定量测定EPA和DHA甘油酯总含量。通过单因素 和响应面试验,考察反应时间、pH值、反应温度、加酶量等因素对富集效果的 影响。结果:确定最佳工艺条件为反应时间4 h、pH 8.0、反应温度30 ℃、加酶量1.0 %,在 此条件下,EPA和DHA甘油酯总含量为21.65%,且4 个因素对EPA和DHA甘油酯富集的影响依次增强。结论:富集后鱼油理化指标和感官评价均优于精炼鱼油,EPA和DHA甘油酯总含量是富集前的1.74 倍,获得了天然的EPA和DHA甘油酯。
脂肪酶;小黄鱼内脏;精炼鱼油;EPA甘油酯;DHA甘油酯
小黄鱼作为我国四大海洋经济鱼类之一,目前其加工下脚料主要用于饲料[1](鱼粉、液体鱼蛋白饲料、宠物食品)、调味品[2](鱼露、海鲜调味料)等方面,而对下脚料的深加工,如提取鱼油、制备多糖和多肽等方面研究报道较少[3]。多不饱和脂肪酸对人体正常的生长和营养是必需的,而某些饱和脂肪酸及其他杂质在体内长期积累是有害的[4],小黄鱼内脏中富含多不饱和脂肪酸,其中二十碳五烯酸(eicosapentaenoic acid,EPA)甘油酯和二十二碳六烯酸(docosahexaenoic acid,DHA)甘油酯在人体中具有重要的生物学意义,如抑制肿瘤生长、预防心血管疾病、促进智力发育[5-7]等,且对细胞代谢、信号传导和基因表达调控起着重要作用[8]。然而,从天然海产鱼制得的多不饱和脂肪酸中,EPA和DHA的含量因鱼的种类而不同,通常在5%~15%[9]。现有报道中,提高鱼油中EPA和DHA甘油酯含量的方法主要有:低温结晶法、尿素包合法、分子蒸馏法、超临界CO2萃取法、色谱法、脂肪酶法等[10],其中低温结晶法、尿素包合法、分子蒸馏法、超临界CO2萃取法及色谱法,主要是针对EPA和DHA乙酯型鱼油进行富集,但EPA和DHA乙酯型鱼油不易于被人体消化吸收,而且可能存在安全隐患;脂肪酶法主要是针对EPA和DHA甘油酯型进行富集,EPA和DHA甘油酯型即为鱼油中天然存在形式,其性质稳定,不易氧化,口感好,易被人体消化吸收。研究[11]表明脂肪酶具有对甘油酯中不同脂肪酸的专一性,通常认为鱼油三甘酯中2-位上连接着EPA、DHA等高度不饱和脂肪酸。脂肪酶选择性水解法是利用某些脂肪酶相对特异性地水解甘油与饱和脂肪酸联接的酯键,而对不饱和脂肪酸几乎无作用的原理,去除游离的饱和脂肪酸,提高鱼油中多不饱和脂肪酸的含量。小黄鱼内脏下脚料是一种废弃资源,其中含有丰富的多不饱和脂肪酸,直接排放会造成环境污染和资源浪费。我国海洋资源丰富,但EPA和DHA富集分离技术比日本和西方发达国家相比还相差甚远[12]。本研究采用脂肪酶Lipozyme TL 100 L水解小黄鱼内脏精炼鱼油,富集EPA和DHA甘油酯,通过单因素和响应面试验确定最佳酶解条件,提高EPA和DHA甘油酯含量,为加工鱼油提供一种新的原料。
1 材料与方法
1.1 材料与试剂
小黄鱼内脏精练鱼油 实验室自制(EPA和DHA甘油酯总含量以EPA和DHA总含量计,为12.35%);Lipozyme TL 100L脂肪酶 丹麦诺维信公司;37种脂肪酸甲酯标准品 美国Sigma公司;三氟化硼(色谱纯) 阿拉丁试剂公司;正己烷、甲醇(均为色谱纯)江苏汉邦科技有限公司;其他试剂(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
DK-28型电热恒温水浴锅 上海精宏实验设备有限公司;XW-80A漩涡混合仪 上海青浦沪西仪器厂;L-550台式低速大容量离心机 长沙湘仪离心机仪器有限公司;GC-2014气相色谱仪(氢火焰离子化检测器)日本岛津公司;Optima 7300DV电感耦合等离子体光谱仪(配有氢化物发生系统) 美国PerkinElmer公司。
1.3 方法
1.3.1 脂肪酶对EPA和DHA甘油酯的富集
[13]方法略作修改。称取10 g精炼鱼油置于150 mL锥形瓶中,加入4 mL磷酸盐缓冲溶液,混匀后加入一定量的脂肪酶(以鱼油质量计),充氮密封,置于电热恒温水浴锅中反应一段时间。反应结束后,将反应体系溶液转移到分液漏斗中,加入适量正己烷振荡,待静置分层后,收集上层溶液;然后用去离子水反复洗涤上层溶液至中性,收集上层正己烷萃取液,经旋转蒸发除去溶剂,即得EPA和DHA甘油酯。
1.3.2 酶解工艺条件的单因素试验设计
以EPA和DHA甘油酯含量为考察指标,分别设计缓冲液pH 4.0、5.5、7.0、8.5、10.0,反应温度20、30、40、50、60℃,反应时间2、4、6、8、10 h,脂肪酶用量(质量分数)0.2%、0.6%、1.0%、1.4%、1.8%,探究其对鱼油EPA和DHA甘油酯富集效果的影响。固定pH 7.0、反应温度40 ℃、反应时间4 h、加酶量1.0%,每次改变其中一个因素,分析各因素对鱼油中EPA和DHA甘油酯富集效果的影响。
1.3.3 酶解工艺条件的响应面试验设计
在单因素试验基础上,选择影响较大的3个因素利用Design-Expert 8.0软件进行响应面优化设计。设计三因素三水平的Box-Behnken试验,因素水平和编码见表1。

表1 响应面试验因素与水平Table 1 Factors and levels used in RSM design
1.3.4 EPA和DHA含量的测定
1.3.4.1 EPA和DHA标准溶液的配制
取脂肪酸标准品(EPA和DHA含量分别为2%)100 mg,用正己烷溶解定容至10 mL,配制成质量浓度均为0.2 mg/mL的EPA和DHA标准母液。将母液分别稀释成0.04、0.08、0.12、0.16、0.20 mg/mL的标准品溶液,备用。1.3.4.2 鱼油甲酯化
称取50 mg鱼油样品加入1.5 mL 0.5 mol/L的氢氧化钠-甲醇溶液,充入氮气,密封,混匀,65 ℃水浴20 min,冷却至室温;加入2 mL 14%三氟化硼甲醇溶液,充入氮气、密封、混匀,65 ℃水浴5 min,冷却至室温;加入1 mL正己烷,充入氮气,密封,混匀30 s;加入5 mL饱和氯化钠溶液,充入氮气,密封,混匀1 min。静置分层后,吸取上层正己烷溶液过0.22 μm滤膜,上机待测。
1.3.4.3 气相色谱条件
色谱柱:FFAP石英毛细管柱(30 m×0.32 mm,1.0 μm);氢火焰离子化检测器;进样口温度:250℃,检测器温度:250℃;流速:1.0 mL/min,载气:氮气,压力:500 kPa,氢气压力:50 kPa,尾吹气压力:200 kPa,空气压力:50 kPa;程序升温:50 ℃保留4 min,4 ℃/min升温至140 ℃,5 ℃/min升温至220 ℃,保持40 min;进样量1 μL。
1.3.4.4 定量分析
采用外标 法,建立标准曲线,峰面积定量计算结果。
1.3.5 富集鱼油理化指标测定
酸值:GB/T 5530—2005《动植物油脂酸值和酸度测定》[14];碘值:GB/T 5532—2008《动植物油脂碘值的测定》[15];过氧化值:GB/T 5538—2005《动植物油脂过氧化值测定》[16];重金属离子Hg、As、Pb含量:采用电感耦合等离子体质谱法[17];感官评价:SC/T 3502—2000《水产行业标准鱼油》[18]。
2 结果与分析
2.1 标准曲线的绘制
37 种脂肪酸甲酯标准品和样品气相色谱图如图1所示。采用峰面积外标法对EPA和DHA含量进行定量。

图1 脂肪酸甲酯标准品(a)和样品(b)气相色谱图Fig.1 GC patterns of fatty acid methyl ester standard (a) and sample (b)
分别以EPA、DHA质量浓度(mg/mL)为横坐标X,目标峰的峰面积为纵坐标Y,以X对Y进行线性回归,得回归方程:YEPA=53 611.75XEPA+1 494.40,R2=0.990 3;YDHA=16 887.50XDHA+897.54,R2=0.991 3。
2.2 酶解工艺对EPA和DHA甘油酯富集效果的影响
2.2.1 pH值对EPA和DHA甘油酯富集效果的影响
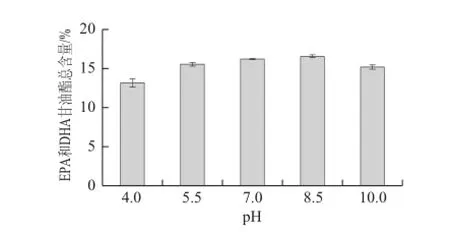
图2 pH值对EPA和DHA甘油酯富集效果的影响Fig.2 Effect of pH on the enrichment of EPA and DHA glycerides
由图2可见,溶液从酸性到弱碱性,EPA和DHA甘油酯总含量不断增大,在强碱性时开始降低。结合所用脂肪酶的自身最适pH值范围,选取缓冲液pH 7.0~9.0作为酶解反应的pH值范围。
2.2.2 反应温度对EPA和DHA甘油酯富集效果的影响

图3 反应温度对EPA和DHA甘油酯富集效果的影响Fig.3 Effect of reaction temperature on the enrichment of EPA and DHA glycerides
由图3可见,反应温度从20 ℃升至30 ℃时,EPA和DHA甘油酯总含量略有增加;30~40 ℃范围内,含量略有降低;温度超过40 ℃后,含量下降较快,这与本实验选用的脂肪酶在中低温条件下活力较高相符合。综合考虑,选取反应温度的最佳范围为20~40 ℃。
2.2.3 反应时间对EPA和DHA甘油酯富集效果的影响

图4 反应时间对EPA和DHA甘油酯富集效果的影响Fig.4 Effect of reaction time on the enrichment of EPA and DHA glycerides
如图4所示,反应4 h时,EPA和DHA甘油酯总含量达到最大值,随着反应时间延长,EPA和DHA甘油酯总含量呈下降趋势。这可能是因为水中残存的部分氧与多不饱和脂肪酸在高温下长期接触,使得EPA和DHA甘油酯发生自动氧化或光敏氧化而损失。为此,选取4 h作为最佳反应时间。
2.2.4 加酶量对EPA和DHA甘油酯富集效果的影响
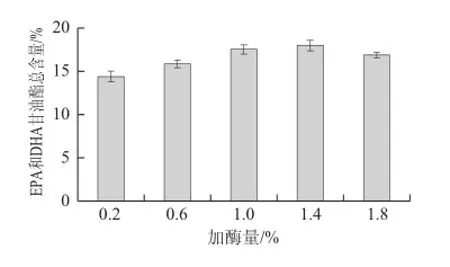
图5 加酶量对EPA和DHA甘油酯富集效果的影响Fig.5 Effect of enzyme amount on the enrichment of EPA and DHA glycerides
从图5可以看出,EPA和DHA甘油酯总含量随着脂肪酶添加量的增加而增加。加酶量在0.6%~1.4%的范围内EPA和DHA甘油酯总含量上升趋势渐缓,故选取加酶量最佳范围为0.6%~1.4%。
2.3 响应面优化EPA和DHA甘油酯富集工艺
2.3.1 响应面试验

表2 响应面试验设计及结果Table 2 Response surface design and results

表3 方差分析表Table 3 Analysis of variance of quadratic polynomial model
单因素试验中反应温度、加酶量、pH值、反应时间的极差分别为4.960、3.605、3.395、3.035,故选取pH值、反应温度、加酶量作为响应面试验设计的三因素。响应面试验设计及结果见表2。对表2数据进行方差分析,结果见表3,模型的F值为3.71,P值小于0.05,表明模型显著;失拟项值也都大于0.05,表明该模型失拟不显著,具有较好的拟合度。
根据回归系数可得二次多项回归模型方程:
Y=19.35+0.42A-0.91B-0.42C+1.52AB-0.19AC-1.49BC-2.33A2-2.44B2-2.74C2,其中R2=0.826 7,回归系数显著性结果表明A2、B2项和C2项P<0.05,均为显著项。
2.3.2 响应面分析

图6 缓冲液pHH值(A)、反应温度(B)和加酶量(C)对鱼油EPA和DHA甘油酯富集效果的响应面图Fig.6 Response surface plots for the effects of pH (A) and reaction temperature (B) and enzyme amount (C) on the enrichment of EPA and DHA glycerides
利用Design-Expert 8.0软件绘制出该模型的三维响应面图,如图6所示。pH值(A)、反应温度(B)和加酶量(C)对EPA和DHA甘油酯总含量的影响呈抛物线状,即在一定范围内,随着因素水平的增大,各指标响应值先增大后减小,通过试验求出这3 个因素的最适参数,从而确定影响鱼油EPA和DHA甘油酯富集能力的因素从大到小依次pH值、反应温度、加酶量。以EPA和DHA甘油酯总含量为最终评价指标,最优条件范围:pH 7.5~8.7、反应温度22~34℃、加酶量0.75%~1.15%。软件预测Y为19.44%,此时最优条件为pH 8.0、反应温度28.37 ℃(实际操作中不易实现,故选取30℃)、加酶量1.0%、反应时间4 h。为了验证该模型的可靠性,以最佳实验条件进行了3次平行实验,EPA和DHA甘油酯总含量平均值为21.65%,模型预测值与理论值相对偏差为10.21%。
郑毅等[19]采用固定化米曲霉脂肪酶选择性富集鱼油ω-3多不饱和脂肪酸甘油酯,得到EPA和DHA总含量由7.3%提高到21.5%,本实验所用脂肪酶Lipozyme TL 100 L同样是米曲霉脂肪酶,得到的提取率比其高0.15%;刘书成等[13]研究蛇鲻精炼鱼油经脂肪酶OF选择性水解后,EPA和DHA总含量由14.38%提高到34.1%,其原料精炼鱼油中EPA和DHA的初始含量比本实验原料中EPA和DHA高,并且蛇鲻为热带和亚热带海区中下层鱼类,本实验所用小黄鱼为近海低值鱼类,所含的EPA和DHA的含量比其低。
2.4 富集鱼油理化指标测定
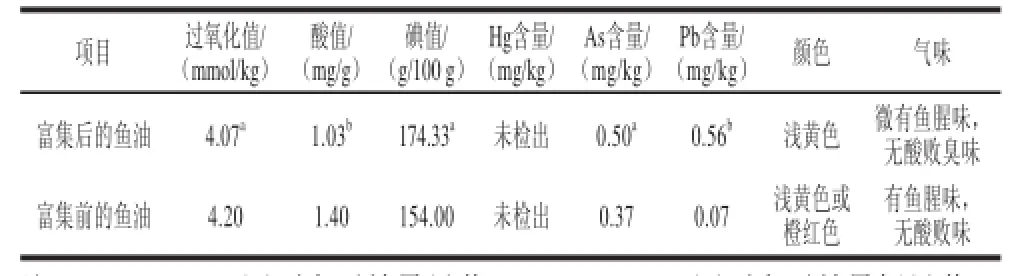
表4 富集鱼油理化指标和感官指标Table 4 Physicochemical and sensory properties of enriched fish oil
由表4可知,富集后的鱼油过氧化值和酸值分别减少了0.13 mmol/kg、0.37 mg/g,碘值增加了20.33 g/100g,As和Pb含量分别增加了0.13、0.49mg/kg,Hg未检出。富集后的鱼油过氧化值、碘值、As含量与富集前的鱼油均存在显著性差异,酸值、Pb含量有着极显著性差异。富集后的鱼油颜色、气味优于富集前的鱼油。
3 结 论
本研究以精炼鱼油为原料,通过单因素及响应面试验得到脂肪酶水解富集EPA和DHA甘油酯的最佳工艺条件为:pH 8.0、反应温度30 ℃、加酶量1.0%、反应时间4 h。在此条件下,EPA和DHA甘油酯总含量为21.65%,高于精炼鱼油(12.35%),且富集后的鱼油过氧化值、酸值、碘值、气味及色泽均优于精炼鱼油。此研究工艺尚处于实验室阶段,放大实验有待深入研究。该工艺及产品有利于低值鱼类副产品的开发和利用。
参考文献:
[1] KUMAR A R, SWAPNA H C, BHASKAR N, et al. Effect of fermentation ensilaging on recovery of oil from fresh water fish viscera[J]. Enzyme and Microbial Technology, 2010, 46(1): 9-13.
[2] DISSARAPHONG S, BENJAKUL S, VISESSANGUAN W, et al. The influence of storage conditions of tuna viscera before fermentation on the chemical, physical and microbiological changes in fish sauce during fermentation[J]. Bioresource Technology, 2006, 97(16): 2032-2040.
[3] KUMAR A R, BHASKAR N, BASKARAN V. Bioefficacy of EPADHA from lipids recovered from fish processing wastes through biotechnological approaches[J]. Food Chemistry, 2013, 136(1): 80-86.
[4] 马永钧, 杨博. 海洋鱼油深加工技术研究进展[J]. 中国油脂, 2011, 36(4): 1-6.
[5] FABER J, BERKHOUT M, FIEDLER U, et al. Rapid EPA and DHA incorporation and reduced PGE2 levels after one week intervention with a medical food in cancer patients receiving radiotherapy, a randomized trial[J]. Clinical Nutrition, 2013, 32(3): 338-345.
[6] CHAPKIN R S, HONG M Y, FAN Y Y, et al. Dietary i-3 PUFA alter colonocyte mitochondrial membrane compsition and function[J]. Lipids, 2002, 37(2): 193-199.
[7] HEMANT P, SUNIL K P, LEIGH C W, et al. Effects of ALA, EPA and DHA in high-carbohydrate, high-fat diet-induced metabolic syndrome in rats[J]. The Journal of Nutritional Biochemistry, 2013, 24(6): 1041-1052.
[8] KAHVECI D, XU Xuebing. Repeated hydrolysis process is effective for enrichment of omega polyunsaturated fatty acids in salmon oil by Candida rugosa lipase[J]. Food Chemistry, 2011, 129(4): 1552-1558.
[9] 曾远平, 刘耘, 杨继国. 鱼油中EPA和DHA的富集方法及研究进展[J].现代食品科技, 2005, 22(1): 160-163.
[10] HAO Liuping, CAO Xuejun, HUR B K. Separation of single component of EPA and DHA from fish oil using silver ion modified molecular sieve 13X under supercritical condition[J]. Journal of Industrial and Engineering Chemistry, 2008, 14(5): 639-643.
[11] 吴可克. 酶促鱼油选择性水解制备EPA、DHA甘油酯的研究[J]. 中国油脂, 2002, 27(3): 91-93.
[12] 何键东, 王朋, 胡烨, 等. 鱼油制备及EPA和DHA富集纯化技术研究进展[J]. 农业机械, 2011(20): 56-58.
[13] 刘书成, 章超桦, 谢燕, 等. 脂肪酶水解低值鱼油富集EPA和DHA甘油酯的研究[J]. 中国粮油学报, 2009, 24(3): 79-83.
[14] 国家粮食局西安油脂食品及饲料质量监督检验测试中心, 北京市粮油食品检验所. GB/T 5530—2005 动植物油脂酸值和酸度测定[S]. 北京: 中国标准出版社, 2005.
[15] 武汉工业学院. GB/T 5532—2008 动植物油脂碘值的测定[S]. 北京:中国标准出版社, 2005.
[16] 国家粮食局西安油脂食品及饲料质量监督检验测试中心. GB/T 5538—2005 动植物油脂过氧化值测定[S]. 北京: 中国标准出版社, 2005.
[17] HERWIG N, STEPHAN K, PANNE U, et al. Multi-element screening in milk and feed by SF-ICP-MS[J]. Food Chemistry, 2011, 124(3): 1223-1230.
[18] 国家水产品质量监督检验中心, 福建高龙事业公司. SC/T 3502—2000 鱼油[S]. 北京: 中国标准出版社, 2005.
[19] 郑毅, 郑楠, 吴松刚. 固定化脂肪酶选择性富集鱼油ω-3多不饱和脂肪酸甘油酯[J]. 化工学报, 2006, 57(2): 353-358.
Lipase-Catalyzed Enrichment of EPA and DHA Glycerides from Visceral Oil of Small Yellow Croaker
LIU Guo-ya n, ZHANG Tian-tian, WANG Jin-xing, SUN Bei-bei, BIAN Hao, XU Xin*
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
Objective: The refined fish oil extracted from gut organs of small yellow croakers was hydrolyzed by lipase to enrich eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) glycerides. Methods: Gas chromatography (GC) combined with peak area external standard method was used to determine the contents of EPA and DHA glycerides. Onefactor-at-a-time method followed by response surface analysis was used to analyze the effects of pH, temperature, enzyme amount and hydrolysis time on enrichment efficiency. Results: The optimal conditions for enriching EPA and DHA glycerides were found to be hydrolysis at 30 ℃ for 4 h with an enzyme dosage of 1.0% under neutral pH condition. Under these conditions, the total amount of EPA and DHA glycerides was 21.65%, which was influenced in increasing order by hydrolysis time, pH, temperature and enzyme dosage. Conclusion: The physical and chemical indexes and sensory evaluation of EPA and DPA-enriched fish oil were better than those of fish oil before enrichment with a 1.74-fold increase in the total of EPA and DHA glycerides. As a result, the natural EPA and DHA glycerides were obtained.
lipase; small yellow croaker viscera; refined fish oil; EPA glyceride; DHA glyceride
TS222.1
A
1002-6630(2014)24-0091-05
10.7506/spkx1002-6630-201424017
2014-07-06
刘国艳(1979—),女,讲师,博士研究生,研究方向为油脂营养与安全。E-mail:liugy@yzu.edu.cn
*通信作者:徐鑫(1977—),男,副教授,博士,研究方向为功能食品。E-mail:xuxin@yzu.edu.cn

