同时感染雏鹅的两种血清型沙门菌分离鉴定及遗传进化分析
俞 燕,张 斌,龚建森,于恩琪,庄林林,张 笛,刘学贤,徐 步
(1.江苏省家禽科学研究所,江苏 扬州225125;2.扬州市畜牧兽医站,江苏 扬州225009;3.扬州大学兽医学院,江苏扬州225009)
沙门菌广泛存在于人和其他动物肠道内,是重要的人畜共患病病原之一。自然界中,家禽是沙门菌的重要宿主,沙门菌感染家禽后,可引起发病或死亡,给养殖业造成巨大经济损失。更为重要的是,污染沙门菌的禽肉、禽蛋等禽产品还会造成食品安全问题,影响公共卫生和社会安全[1]。因此,家禽养殖业必须重视对沙门菌病的预防与控制。目前,沙门菌血清型数量超过2 600种,其中B群沙门菌最为复杂(超过100种),且在临床样品中具有较高的分离率[2]。
本研究从发病雏鹅体内同时分离鉴定出2株同属B群的沙门菌,分别为鼠伤寒沙门菌和印第安纳沙门菌,通过药敏试验和16S rDNA遗传进化分析,对分离菌的生物学特性进行初步研究,补充相关流行病学资料并为预防和控制鹅沙门菌病提供试验依据。
1 材料与方法
1.1 病料来源 2013年4月江苏某肉鹅场饲养的雏鹅在22日龄开始陆续出现发病和死亡。病鹅主要表现为体形瘦小、精神委顿、食欲减少或废绝、排水样稀粪。剖检病变主要表现为心包炎、浆膜炎、肝脏有白色结节、脾脏肿大、胆囊充盈等。无菌采集病死雏鹅脏器进行病原分离与鉴定。
1.2 主要试剂 麦康凯琼脂、XLD琼脂、MH琼脂,购自青岛海博生物技术有限公司;胰蛋白胨、酵母抽提物,购自OXOID公司;肠杆菌科细菌生化管鉴定系统、药敏纸片,购自杭州天和微生物试剂有限公司;沙门菌属诊断血清,购自宁波天润生物药业有限公司;PCR相关试剂和16S rDNA细菌鉴定PCR试剂盒,购自宝生物工程(大连)有限公司;SanPrep柱式DNA胶回收试剂盒,购自上海生工生物工程技术服务有限公司;其他试剂均为国产分析纯。
1.3 细菌分离纯化 剖检病死雏鹅,无菌操作取心、肝、脾、胆囊、胰腺等病料分别接种于血琼脂平板,于37℃培养箱中静置培养24 h,挑取可疑菌落于麦康凯琼脂、XLD琼脂平板进一步纯化培养。
1.4 革兰染色镜检 挑取纯化培养后的单个菌落涂片,进行革兰染色,光学显微镜下观察细菌形态及染色特性。
1.5 生化试验 将纯化后的分离菌接种肠杆菌科细菌生化反应管,37℃培养24 h后观察结果,与参考文献[3]对照进行生化指标测定。
1.6 引物设计与PCR检测 参考相关文献[4]根据沙门菌肠毒素stn基因设计引物,目的片段大小为260 bp,送上海生工生物工程技术服务有限公司合成。
上游引物P1:5′-CTTTGGTCGTAAAATAAGGC G-3′;
下游引物P2:5′-TGCCCAAAGCAGAGAGATT C-3′。
以纯化菌落为模板,PCR反应体系为25μL,反应条件:94℃5 min;94℃1 min、55℃1 min、72℃1min,35个循环;72℃10min。扩增产物经琼脂糖凝胶电泳检测。
1.7 血清学鉴定 将分离菌纯培养物按照国家标准(GB 4789.4-2010)[5],利用沙门菌属诊断血清进一步鉴定血清型。
1.8 药敏试验 采用纸片琼脂扩散法,从各类抗菌药物中选取18种常用抗菌药物,对分离菌纯培养物进行药敏试验,操作方法和判定标准参照其产品说明书。
1.9 16S rDNA遗传进化分析 无菌挑取菌落至100 μL高压DDW中,100℃煮沸10min,12 000 r/min离心2min,取5μL上清液作为模板,用16S rDNA细菌鉴定PCR试剂盒进行PCR反应。PCR反应体系(50 μL):模板DNA 5μL,PCR预混液25μL,上、下游引物各0.5μL,16 s-free水19μL。PCR反应条件:94℃5min;94℃1min、53℃1min、72℃1.5min,35个循环;72℃10min。PCR扩增产物经1%琼脂糖凝胶电泳检测,切胶回收后送上海生工生物工程技术服务有限公司测序,将测序结果与GenBank登录的22株不同血清型沙门菌序列用DNAStar进行比对,并用Clustalx1.83和MEGA 5.0软件采用最大简约法(Maximum parsimony)绘制系统进化树进行分析。
2 结果
2.1 分离培养与染色镜检 病料接种麦康凯琼脂平板后,长出无色、半透明、表面光滑的圆形小菌落;接种XLD琼脂平板后,发现2种疑似沙门菌菌落,一种表面光滑、透明、菌落偏大(编号1318),另一种为光滑、中心发黑的中等菌落(编号1319)。这2种菌落经革蓝染色后,在油镜下观察均为革兰阴性小杆菌。
2.2 分离菌生化鉴定 通过生化试验发现这2个菌株均可发酵葡萄糖、麦芽糖和甘露醇,产酸产气,不发酵乳糖和蔗糖,M.R.试验硫化氢试验阳性,初步判定为沙门菌。
2.3 分离菌的PCR检测 用沙门菌stn基因特异性引物对2株分离菌进行PCR扩增,结果见图1。2个菌株扩增的DNA片段约为260 bp,和预期片段大小一致,表明分离菌均为沙门菌。
2.4 血清学鉴定 血清学试验结果表明,2个分离菌株均能与沙门菌A~F多价血清、O4和O12因子血清发生凝集;对其H抗原的检测表明,1318菌株含有Hi和H2抗原,而1319菌株含有Hz和H7抗原。检索卡夫曼-怀特沙门菌抗原表,鉴定1318菌株和1319菌株分别为B群的鼠伤寒沙门菌和印第安纳沙门菌。
2.5 药敏试验 分离菌对18种常用抗菌药物的敏

图1分离菌stn基因PCR产物电泳结果
感试验结果见表1。2个分离株均为多重耐药菌株,其中鼠伤寒沙门菌耐3种药物(耐药率16.7%),而印第安纳沙门菌耐12种药物(耐药率66.7%)。2个分离株均对链霉素、呋喃唑酮、头孢曲松钠、多粘菌素B具有敏感性,临床可用上述药物进行相关防控。
2.6分离菌遗传进化分析 对2个分离菌株16SrDNA前500 bp左右的保守区域进行扩增,其产物进行琼脂糖电泳鉴定,结果扩增条带符合预期大小(见图2)。将测序结果上传至GenBank(登录号:KF916571、KF916570),与22株不同血清型沙门菌16S rDNA序列构建进化树进行分析(图3)。从进化树可以看出,各血清型沙门菌整体上分为两大分支。本研究分离到的鼠伤寒沙门菌和印第安纳沙门菌具有较高的同源性(99.1%);分离株与大多数(18种)血清型具有相近的亲缘性;而与鸡白痢、鸡伤寒、爪哇安纳、海德尔堡等4个血清型的亲缘性相对较远。

表1 分离菌药敏试验结果
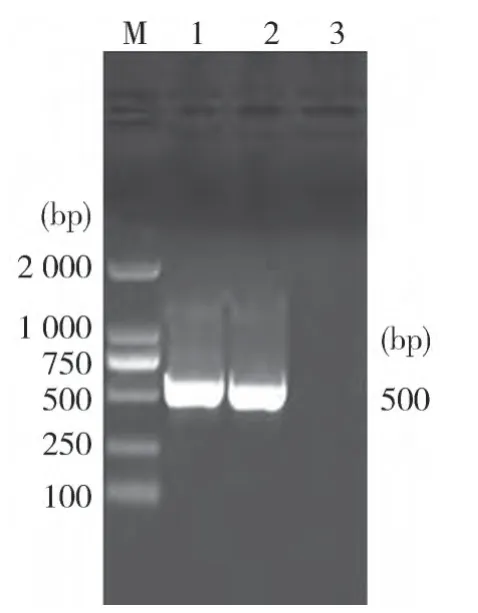
图2 分离菌16S rDNA PCR产物电泳结果

图3 沙门菌代表血清型系统进化树
3 讨论
沙门菌病是严重危害养殖业的一种重要的细菌性疾病,其抗原复杂,血清型众多。Gong等[6]对我国2006-2012年分离的323株禽源沙门菌流行病学调查发现,这些菌株分属6群20个血清型,以鸡白痢、鼠伤寒和肠炎沙门菌为主要流行血清型。其中,鹅源沙门菌分离率最高的依次为鼠伤寒(11/66)、肠炎(10/66)、印第安纳(10/66)和波茨坦(10/66)血清型。本研究从病死雏鹅体内同时分离到2株沙门菌,经实验室鉴定为鼠伤寒沙门菌和印第安纳沙门菌,表明这2种血清型在国内具有较高的流行性。研究揭示,我国鹅群沙门菌感染较为复杂,单一甚至多血清型沙门菌同时感染十分普遍,应该引起兽医工作者的重视,采取相应措施进行有效防控。
药敏试验结果表明,2个分离株均为多重耐药菌株,虽然同属B群沙门菌且分离自同一宿主,但其耐药性却有较大差异。其中鼠伤寒沙门菌耐药率相对低(16.7%),而印第安纳沙门菌耐药率则较高(66.7%)。鼠伤寒沙门菌仅对复方新诺明、阿奇霉素和利福平耐药,对临床常用的喹诺酮类、氨基糖苷类药物均很敏感,这与近年来报道[7-8]的禽源鼠伤寒沙门菌耐药性差别较大。国内对印第安纳沙门菌的研究相对较少,陆彦等[9-10]对鸡源印第安纳沙门菌的耐药性研究发现,所分离的菌株对喹诺酮类和氯霉素类药物普遍耐药。本研究分离的鹅源印第安纳沙门菌不仅对喹诺酮类、氯霉素类药物耐药,对四环素类、磺胺类及部分氨基糖胺类药物均表现为耐药。分析表明,鹅群散养环境的复杂性以及饲养过程中药物使用不当可能导致了沙门菌耐药性提升。对耐药基因的检测有助于分析这2菌株的耐药性差异。同时,根据试验结果,可使用硝基呋喃类、头孢类或多肽类药物进行治疗与防控。
本研究对2个分离菌株的16S rDNA进行序列测定和系统进化分析,结果表明,2个不同血清型的沙门菌具有较高的同源性。与GenBank中的22个不同血清型沙门菌的序列比对结果显示,本研究分离的2个菌株与鸡沙门菌感染密切相关的鸡白痢、鸡伤寒、爪哇安纳、海德尔堡等血清型亲缘性相对较远,而与其他泛嗜性血清型具有较高的亲缘关系,确定了其遗传进化地位,为进一步开展病原分子生物学研究奠定了基础。
[1]徐桂云,樊世杰.家禽沙门氏菌感染现状及不同国家的防治策略[J].中国家禽,2012,34(9):7-12.
[2]张霖.鼠伤寒沙门氏菌对鸡致病性及其对药物敏感性的试验[D].泰安:山东农业大学,2011.
[3] 姚火春.兽医微生物实验指导[M].2版.北京:中国农业出版社,2001.
[4]于恩琪,马剑云,杨振,等.鹅源鼠伤寒沙门氏菌的分离鉴定及遗传进化分析[J].中国家禽,2013,35(14):22-25.
[5]中华人民共和国卫生部.GB 4789.4-2010.《食品微生物学检验沙门氏菌检验》[S].北京:中国标准出版社,2010.
[6]Gong Jian-sen,Zhang Jin-qiu,Xu Ming,et al.Prevalence and fimbrial genotype distribution of poultry Salmonella spp.isolates in China(2006-2012)[J].Applied and Environmental Microbiology,2014,80(2):687-693.
[7]刘阳,吴白,张竹君,等.一株鹅源性鼠伤寒沙门菌的分离与鉴定[J].上海畜牧兽医通讯,2013,2:34-35.
[8]卢受昇,孔令辰,罗晶璐,等.一例鸭鼠伤寒沙门菌的分离鉴定及抗原性分析[J].广东畜牧兽医科技,2013,38(6):30-33.
[9]陆彦,赵红玉,刘宇,等.鸡源印第安纳沙门菌对喹诺酮类药物耐药性分析[J].中国人兽共患病学报,2013,29(6):605-608.
[10]陆彦,晏志勋,赵红玉,等.印第安纳沙门菌对氯霉素类药物耐药性分析[J].微生物学通报,2013,40(7):1225-1230.

