重组人BMP-2诱导C3H10T1/2间质干细胞定向成骨分化早期基因表达谱分析
左长清 汪宗桂 钟月春 卢旱云 戴忠 吴铁 崔燎
1.广东医学院药理学教研室,广东东莞523808;2.广东医学院生物化学教研室,广东东莞523808
重组人BMP-2诱导C3H10T1/2间质干细胞定向成骨分化早期基因表达谱分析
左长清1汪宗桂2钟月春1卢旱云1戴忠1吴铁1崔燎1
1.广东医学院药理学教研室,广东东莞523808;2.广东医学院生物化学教研室,广东东莞523808
目的研究间质干细胞早期定向成骨分化基因表达谱,为研究基因对早期成骨定向分化调控机制提供实验基础。方法分别提取重组人骨形成蛋白2(rhBMP.2)诱导组和对照组C3H10T1/2细胞总RNA,进行扩增标记后,与ArraySTAR小鼠基因芯片杂交,应用生物信息学软件GeneSpring和GATHER对基因芯片数据进行分析。应用STRING在线软件对差异表达基因构建蛋白互作网络并进行网络分析。结果C3H10T1/2早期成骨分化中,主要富集发育、器官形成等分子功能本体以及细胞因子.细胞因子受体作用信号通路。成骨分化1 d和4 d均上调表达基因42个,下调表达基因45个。网络分析研究表明:Egfr、Cxcl12等信号分子参与调控rhBMP.2诱导成骨分化。结论筛选的差异表达基因和信号分子对早期成骨分化调控具有重要作用,为进一步全面解析早期成骨定向分化提供实验基础。
早期成骨分化;基因表达谱;间质干细胞;生物信息学
成骨细胞主要由骨髓间质干细胞(mesenchymal stem cells,MSCs)分化而来,在其发育分化的整个过程中,不同的基因严格按照特定的时间顺序开启和关闭,表现为与分化的阶段相一致,支持并且控制着成骨细胞的分化与成熟。因此,骨髓间质干细胞定向成骨分化调控研究在国内外受到高度重视,促进间质干细胞成骨定向分化与成熟,将是治疗骨质疏松症的新的有效方法和手段。但是,目前关于间质干细胞早期成骨定向分化方面的调控机制尚未完全阐明。本实验室采用重组人骨形成蛋白2(rhBMP.2)诱导小鼠间质干细胞C3H10T1/2定向成骨分化细胞模型,采用小鼠全基因组芯片筛选鉴定差异表达基因谱并进行生物信息学分析,探讨rhBMP.2成骨分化调控的差异表达基因集,并进一步通过网络生物学分析,为探讨间质干细胞早期成骨定向分化提供实验依据。
1 材料与方法
1.1 材料
小鼠间质干细胞C3H10T1/2购自中国科学院上海细胞库。rhBMP.2(R&D systems),ArraySTAR mouse lncRNA microarray(8×60 K,上海康成生物,芯片包含31423条蛋白编码mRNA和25376条lncRNA,本文仅分析编码蛋白mRNA表达变化)。BCIP/NBT碱性磷酸酶染色试剂盒(Sigma)。
1.2 实验方法
1.2.1 碱性磷酸酶染色鉴定早期成骨定向分化C3H10T1/ 2接种于6孔板中,细胞生长至约90%融合,rhBMP.2诱导组加入含200 ng/mL rhBMP.2培养基,对照组加入不含rhBMP.2的培养基,每2~3天更换一次培养基。当成骨诱导分化7 d后,rhBMP.2诱导组、对照组的单层细胞用PBS清洗2次,然后用体积分数为0.7乙醇室温固定15 min,BCIP/NBT避光染色30 min,用蒸馏水漂洗细胞3次,倒置显微镜下观察并拍照记录。
1.2.2 C3H10T1/2早期成骨定向分化基因芯片检测及其生物信息学分析C3H10T1/2成骨定向分化1 d和4 d后,rhBMP.2诱导组、对照组采用TRIzol提取总RNA,按照说明扩增、标记荧光、纯化、与芯片杂交、洗脱。用Agilent Scanner G2505C扫描每张芯片的的信号强度,应用Agilent Feature Extraction软件(version 11.0.1.1)分析芯片图像文件,用GeneSpring GX v11.5.1软件(Agilent)进行数据处理分析,根据基因表达水平筛选出差异2倍以上的基因并采用GATHER软件[1](http://gather.genome.duke.edu/)进行生物信息学分析富集基因本体(gene ontology,GO)和生物通路。
1.2.3 差异表达基因蛋白互作网络分析STRING (http://string.db.org/)软件[2]从各种资源中整合了已知的和预测的蛋白质相互作用(包括直接和间接作用)来生成网络,其数据来自于基因组、高通量实验、共表达、已有知识4种资源。本研究采用此数据库资源对上述差异表达基因进行蛋白互作网络构建。
2 结果
2.1 间质干细胞C3H10T1/2成骨分化鉴定
间质干细胞C3H10T1/2经rhBMP.2成骨诱导分化7 d后,碱性磷酸酶染色显示:rhBMP.2诱导组呈蓝紫色(图1),这表明rhBMP.2能诱导C3H10T1/2间质干细胞定向成骨分化。此细胞模型可用于后续实验研究。

图1 C3H10T1/2间质干细胞成骨诱导7 d碱性磷酸酶染色(100×)
2.2 C3H10T1/2基因表达谱生物信息学分析
通过对C3H10T1/2成骨分化1 d和4 d芯片结果进行分析,筛选出两个时间点表达均升高2倍以上的基因42个;表达均降低2倍以上的基因45个(表1)。采用生物软件进行分子功能基因本体和通路分析发现,显著性差异分子功能本体为发育、器官形成等,并与细胞因子.细胞因子受体作用通路相关。

表1 C3H10T1/2细胞成骨分化早期差异表达基因集
2.3 一致性差异表达基因编码蛋白相互作用网络分析
采用STRING网络资源对差异表达基因编码蛋白进行网络分析,构建了部分基因的基因表达调控与蛋白互作网络,通过对网络进行分析(图2),发现经rhBMP.2诱导后差异表达的Egfr、Cxcl12等信号分子处于蛋白网络重要交叉点,可能与信号通路交谈有关,说明在rhBMP.2诱导C3H10T1/2间质干细胞早期成骨分化过程中,Egfr、Cxcl12等信号分子参与调控BMP.2信号。
3 讨论
间质干细胞成骨分化是一个多基因参与的,多步骤的复杂的生物过程。机体一些重要的转录因子如Runx2、Dlx2等[3.4]以及众多的信号通路在成骨分化起到非常重要调控作用[5]。但是,关于BMP.2诱导间质干细胞早期成骨定向分化相关调控机制以及不同信号间的交谈分子,目前尚未完全阐明。
基因芯片技术提供了一个用于同时研究一个细胞或组织全基因组表达的较好平台。本研究对rhBMP.2诱导C3H10T1/2成骨分化1 d和4 d后的基因表达谱进行分析,提取了rhBMP.2诱导后差异表达的基因共87个,其中上调基因42个,下调基因45个。通过文献分析发现,多个基因已经报道与成骨分化紧密相关,它们在成骨定向、分化、转分化过程中发挥着重要作用,如Frizzled家族成员FZD9[6]、同源蛋白家族基因Dlx2[7]、转录因子ID4[8]、细胞外基质相关基因Ecm1[9]等。其他差异基因,将成为笔者研究BMP.2成骨信号的重要切入点。同时,进行分子功能相关基因本体分析发现,在早期成骨分化过程,富集得分最高的为发育、器官形成、细胞因子.细胞因子受体作用相关信号,这可能与BMP.2诱导成骨分化密切相关。
复杂网络理论作为一门新兴学科,为系统水平上研究生物网络提供了新的理论依据和平台。2000年Jeong等[10]在《Nature》上第一次发表利用复杂网络理论研究代谢网络的拓扑特性的论文,自此以后,利用复杂网络理论研究各种生物网络迅速发展[11.12],主要集中在探索活细胞中所有分子的行为和它们之间的相互作用,以及从局部到整体,生物体如何形成了极其复杂的动力学机制。蛋白.蛋白互作网络和转录调控网络是生物信息调控的主要实现方式,在整个生命过程中有着非常重要的作用,是决定细胞命运的关键因素。通过对差异基因构建蛋白互作和转录调控网络,本研究发现EGFR、CXCL12等信号分子在rhBMP.2诱导间质干细胞早期成骨分化网络中处于非常重要的网络节点。研究表明,EGFR信号参与骨原始细胞群维持,成骨分化平衡调控[13],并与前体成骨细胞活性和增殖紧密相关[14]。最近的研究也表明,CXCL12/ CXCR4信号参与骨形成和骨吸收的调控[15],在BMP.9诱导的间质干细胞成骨分化的早期和中期,CXCL12/ CXCR4信号轴也发挥重要作用[16]。本研究提示EGFR、CXCL12信号可能与BMP.2信号“交谈”,参与调控BMP.2信号,因此进一步探索这些分子在成骨分化平衡调控中的作用机制,具有重要的意义。同时,趋化因子(C.C模体)配体成员CCL2、CCL7等在网络中也处于非常重要交叉节点,是否参与BMP.2信号调控成骨分化,笔者正在研究中。
综上所述,本研究通过对C3H10T1/2成骨分化早期基因表达谱进行分析,找到了一些受rhBMP.2调控表达的基因,这将是BMP.2成骨信号研究的重要切入点。同时,通过网络生物学分析发现,EGFR、CXCL12等可能参与BMP.2信号调控,控制着间质干细胞骨向分化。
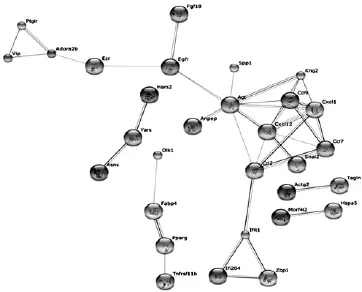
图2 STRING显示成骨早期部分差异基因蛋白互作网络图
[1]Chang JT,Nevins JR.GATHER:a systems approach to interpreting genomic signatures[J].Bioinformatics,2006,22 (23):2926.2933.
[2]Franceschini A,Szklarczyk D,Frankild S,et al.STRING v9.1:protein.protein interaction networks,with increased coverage and integration[J].Nucleic Acids Res,2013,41 (Database issue):808.815.
[3]Karsenty G.Minireview:transcriptional control of osteoblast differentiation[J].Endocrinology,2001,142(7):2731.2733.
[4]Lian JB,Stein GS,Javed A,et al.Networks and hubs for the transcriptional control of osteoblastogenesis[J].Rev Endocr Metab Disord,2006,7(1.2):1.16.
[5]Zuo C,Huang Y,Bajis R,et al.Osteoblastogenesis regulation signals in bone remodeling[J].Osteoporos Int,2012,23(6):1653.1663.
[6]Albers J,Schulze J,Beil FT,et al.Control of bone formation by the serpentine receptor Frizzled.9[J].J Cell Biol,2011,192(6):1057.1072.
[7]Harris SE,Guo D,Harris MA,et al.Transcriptional regulation of BMP.2 activated genes in osteoblasts using gene expression microarray analysis:role of Dlx2 and Dlx5 transcription factors[J].Front Biosci,2003,8:1249.1265.
[8]Tokuzawa Y,Yagi K,Yamashita Y,et al.Id4,a new candidate gene for senile osteoporosis,acts as a molecular switch promoting osteoblast differentiation[J].PLoS Genet,2010,6(7):1001019.
[9]Mongiat M,Fu J,Oldershaw R,et al.Perlecan protein core interacts with extracellular matrix protein 1(ECM1),a glycoprotein involved in bone formation and angiogenesis[J]. J Biol Chem,2003,278(19):17491.17499.
[10]Jeong H,Tombor B,Albert R,et al.The large.scale organizationofmetabolicnetworks[J].Nature,2000,407(6804):651.654.
[11]Barabasi AL,Oltvai ZN.Network biology:understanding the cell's functional organization[J].Nat Rev Genet,2004,5(2):101.113.
[12]Rual JF,Venkatesan K,Hao T,et al.Towards a proteome. scale map of the human protein.protein interaction network[J].Nature,2005,437(7062):1173.1178.
[13]Zhu J,Shimizu E,Zhang X,et al.EGFR signaling suppresses osteoblast differentiation and inhibits expression of master osteoblastic transcription factors Runx2 and Osterix[J].J Cell Biochem,2011,112(7):1749.1760.
[14]Chandra A,Lan S,Zhu J,et al.Epidermal growth factor receptor(EGFR)signaling promotes proliferation and survival in osteoprogenitors by increasing early growth response 2(EGR2)expression[J].J Biol Chem,2013,288 (28):20488.20498.
[15]Shahnazari M,Chu V,Wronski TJ,et al.CXCL12/CXCR4 signaling in the osteoblast regulates the mesenchymal stem cell and osteoclast lineage populations[J]. FASEB J,2013,27(9):3505.3513.
[16]Liu C,Weng Y,Yuan T,et al.CXCL12/CXCR4 signal axis plays an important role in mediating bone morphogenetic protein 9.induced osteogenic differentiation of mesenchymal stem cells[J].Int J Med Sci,2013,10(9):1181.1192.
Identification and analysis of gene expression profiles for early osteoblastic differentiation on C3H10T1/2 mesenchymal stem cells induced by rhBMP-2
ZUO Changqing1WANG Zonggui2ZHONG Yuechun1LU Hanyun1DAI Zhong1WU Tie1CUI Liao1l.Department of Pharmocology,Guangdong Medical College,Guangdong Province,Dongguan523808,China; 2.Department of Biochemistry,Guangdong Medical College,Guangdong Province,Dongguan523808,China
Objective To investigate the gene expression profiles associated with early osteoblastic differentiation on mesenchymal stem cells,and to provide an experimental basis for the study of gene regulation mechanism for early osteoblastic differentiation.Methods The total RNA was extracted from C3H10T1/2 mesenchymal stem cells between control and rhBMP.2 osteoblastic differentiation group,and then cRNA was labeled with fluorescence labels and hybridized with ArraySTAR mouse genechip.The gene expression profiles were analyzed with bioinformatics software GeneSpring and GATHER.The protein interaction network of differentially expressed genes was constructed and analyzed by online software STRING.Results The molecular function gene ontology(GO)including development and organogenesis and cytokine.cytokine receptor interaction signaling pathway were mainly enriched during C3H10T1/2 early osteogenic differentiation.A total of 42 differentially expressed genes were upregulated and 45 genes were downregulated from rhBMP.2 induced osteoblast 1 and 4 days.Protein network analysis showed that Egfr,Cxcl12 were very important signaling molecules which involved in rhBMP.2 induced osteoblast.Conclusion The screening differentially expressed genes and signaling molecules have an important role for regulation of early osteoblastic differentiation and provide further experimental basis for comprehensive analysis of early osteoblastic differentiation.
Early osteoblastic differentiation;Gene expression profiles;Mesenchymal stem cells;Bioinformatics
R966;R963;R336;R329
A
1673-7210(2014)02(a)-0025-04
2013.11.28本文编辑:程铭)
国家自然科学基金项目(编号81101357);广东省中医药局课题(编号20112145);广东省东莞市高等院校科研机构科技项目(编号2011108102029);广东省湛江市科技攻关项目(编号2010C3104003)。
左长清(1977.),男,博士;研究方向:干细胞成骨成脂分化调控,生物信息学。

