根癌农杆菌介导的赭曲霉遗传转化体系的建立
崔倩 李洁 刘晓光
(天津市工业微生物重点实验室 工业发酵微生物教育部重点实验室 天津科技大学生物工程学院 天津 300457)
根癌农杆菌介导的赭曲霉遗传转化体系的建立
崔倩 李洁 刘晓光
(天津市工业微生物重点实验室 工业发酵微生物教育部重点实验室 天津科技大学生物工程学院 天津 300457)
赭曲霉在工业上用于甾体C-11α羟基化。为了对现有赭曲霉生产菌株进行遗传改造,以农杆菌LBA4404作为侵染菌株,以赭曲霉(TCCC41060)作为受体菌株,以潮霉素B基因作为筛选标记,成功建立了根癌农杆菌介导的赭曲霉遗传转化体系并对其转化效率的主要影响因素,如农杆菌浓度、孢子浓度、共培养时间和温度等进行了分析。在最佳条件下,转化效率可以达到57个转化子/108个分生孢子。随机挑选的8个阳性转化子10代连续培养结果表明所获得的转化子能稳定遗传。该遗传转化体系的建立为赭曲霉菌株的定向遗传改造提供了重要的操作平台。
赭曲霉 根癌农杆菌 转化体系
赭曲霉(Aspergillus ochraceus),属于壳霉目,杯霉科,在自然界中分布广泛。目前工业上主要应用赭曲霉进行甾体类药物的C-11α羟基化反应,如制备心血管药物C-11α羟基化坎利酮[1]。若要进一步提高赭曲霉对甾体类药物的催化效率,需要从发酵条件优化和菌株改造两个方面进行研究。到目前为止,有关赭曲霉催化甾体类药物发酵条件优化的研究已有不少,但是对赭曲霉菌株的定向改造报道并不多,仅有学者报道通过原生质体转化法敲除了赭曲霉中合成赭曲霉毒素A的pks基因[2]。本研究意在建立一个高效的赭曲霉遗传转化体系,从而为生产菌株的定向遗传改造奠定基础。
目前已报道的丝状真菌的DNA转化方法主要有CaCl2/PEG转化法[3,4]、电击转化法[3,5]、基因枪转化法[3,6]、限制性内切酶介导的转化法[7,8]、农杆菌介导转化法(Agrobacterium tumefaciens-mediated transformation,ATMT)[9]。综合来看,CaCl2/PEG转化法具有原生质体的制备过程繁琐、稳定性较差、
再生频率较低等缺陷[4];电击转化法和基因枪转化法同时具有需要特别仪器设备和转化效率低的缺点[3];限制性内切酶介导的转化法所获得的突变子中很大比例的突变为非标记突变,这为基因克隆和分析带来很大困难[4];而农杆菌介导转化法具有较高的转化效率、转化子的稳定性较高,并且操作简单等优点[10-12]。
目前,农杆菌介导转化的方法已经成功实现了对多种丝状真菌的遗传转化。例如,日本曲霉[13]、泡盛曲霉[14]、黑曲霉[15]及烟曲霉[16]等。本研究利用农杆菌LBA4404成功构建了赭曲霉的农杆菌转化体系,并对影响其转化效率的主要因素进行了研究。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 赭曲霉TCCC41060、根癌农杆菌菌株LBA4404、大肠杆菌(Escherichia coli)DH5α、质粒pPZP-HYG和质粒pCSN44均为本研究室保存。
1.1.2 培养基 LB培养基[17]用于培养大肠杆菌;土豆培养基(PDA)[17]用于培养赭曲霉;YEB培养基[17]用于培养农杆菌;IM培养基[13]用于对农杆菌进行诱导和介导转化过程的共培养。
1.1.3 试剂、抗生素和引物 各种限制性内切酶、TaqDNA 聚合酶、DNA Marker等购自 TaKaRa 公司;乙酰丁香酮(AS)2-(N-吗啉代)乙烷磺酸钠盐(MES)购自Sigma试剂公司;质粒提取试剂盒、DNA切胶回收试剂盒、DNA 纯化回收试剂盒购自北京庄盟国际生物基因科技有限公司。
潮霉素B购自北京索来宝科技有限公司;卡那霉素和头孢霉素购自购自 TaKaRa 公司。
检测潮霉素抗性基因的引物为HYG-F-(5'-GACATCGACACCAACGATC-3'),HYG-R-(5'-GACTCTTATTAGCAGACAGG-3')由北京奥科鼎盛生物科技有限公司合成。
1.2 方法
1.2.1 表达载体的构建 用XhoI和Hind III将潮霉素B基因片段从质粒pCSN44上切下,同时用同样的酶切位点将质粒pPZP-HYG上的6.5 kb片段切下,构建重组质粒pPZP-hph。并将其转入大肠杆菌DH5α感受态中,在含有卡那霉素的LB培养基上挑选阳性转化子。提取质粒后进行酶切和PCR验证,获得正确的重组载体pPZP-hph。
1.2.2 潮霉素B对赭曲霉最小抑制浓度的确定 用无菌水将培养5 d的赭曲霉孢子从PDA斜面上洗下,经4层纱布过滤后用玻璃珠打散,再用无菌水稀释成107个/mL。取上述100 μL孢子悬液分别涂布于含有潮霉素B(浓度分别为0、50、100、150和200 μg/mL)的PDA平板上。放于28℃培养5 d,观察结果。每个浓度重复3次。
1.2.3 农杆菌的转化和培养 将构建好的载体(pPZP-hph)通过电击转化[18]的方法转入农杆菌LBA4404感受态中,将验证成功的阳性单克隆转化子在YEB(含卡那霉素50 μg/mL)平板上划线,28℃培养72 h后,放于4℃备用。挑取上述农杆菌于含有5 mL的液体YEB(50 μg/mL)试管中,28℃,180 r/min摇床培养48 h后,6 000 r/min,离心8 min收集菌体。用IM液体培养基重悬菌体,此时调整农杆菌悬液OD600至0.5,并加入AS(浓度200 μmol/L)。放于28℃,180 r/min摇床中进行诱导培养。将农杆菌培养到OD600=0.6、0.7、0.8、0.9、1.0时,分别取样备用。
1.2.4 不同孢龄的赭曲霉孢子悬液的制备 保存在4℃中1个月的赭曲霉斜面用无菌水将孢子洗下,无菌纱布过滤后,用无菌水稀释成1×107个/mL备用。将在28℃中培养5、6、7、8 d的赭曲霉斜面同上述方法分别稀释成1×107个/mL备用。
1.2.5 赭曲霉不同孢子浓度的制备 用无菌水将培养5 d的赭曲霉孢子从PDA斜面上洗下,经4层无菌纱布过滤除去菌丝体,并用无菌的玻璃珠将孢子打散均匀。将上述孢子悬液用无菌水稀释成浓度为1×106、107、108和109个/mL。
1.2.6 转化子的验证以及遗传稳定性的鉴定 随机挑选了8个赭曲霉阳性转化子,提取其基因组DNA,用引物HYG-F和HYG-R对转化子的基因组DNA进行扩增。并以野生型赭曲霉基因组作为对照。
2 结果
2.1 载体构建
构建含有潮霉素B基因的重组质粒pPZP-hph,
构建流程,如图1所示。重组质粒经PCR扩增得到的潮霉素B基因的片段(约1 390 bp),经Hind III和XhoI酶切验证得到的6 500 bp和2 432 bp的DNA片段如图2所示,证明含有潮霉素B筛选标记的重组质粒pPZP-hph构建成功。

图1 重组质粒(pPZP-hph)的构建

图2 重组载体PCR(A)及酶切验证(B)结果
2.2 潮霉素B对赭曲霉最小抑制浓度的确定
将赭曲霉培养在含有不同浓度潮霉素B的PDA平板上,观察其生长情况。结果如表1所示,随着潮霉素B的浓度不断提高,赭曲霉的生长逐渐受到抑制。当潮霉素浓度为200 μg/mL时,赭曲霉不能生长。

表 1 赭曲霉41060对潮霉素B的敏感性
2.3 农杆菌浓度对转化效率的影响
将农杆菌浓度OD600=0.6、0.7、0.8、0.9和1.0的菌悬液分别取200 μL与200 μL的1×107个/mL的赭曲霉孢子悬液混合,涂布于贴有0.45 μm的纤维素膜的IM(含卡那霉素50 μg/mL,AS 200 μmol/L)培养基上。放于25℃中共培养48 h后,再将上述纤维素膜倒贴于PDA(含有潮霉素B 200 μg/mL,头孢霉素20 μg/mL)平板上。放于28℃继续培养。培养3 d后,再对PDA平板上的转化子进行筛选。结果如图3所示,随着农杆菌浓度的升高,转化子个数也逐渐增多,当农杆菌浓度达到OD600=0.8得到的转化子个数最多。
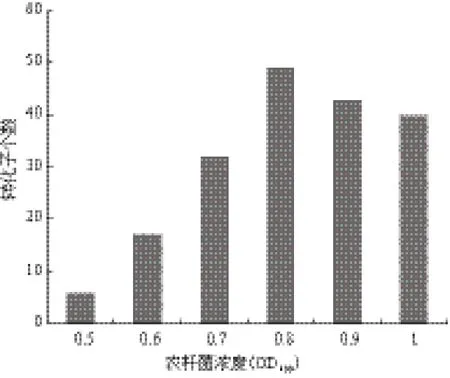
图3 农杆菌浓度对转化效率的影响
2.4 赭曲霉的孢龄对介导转化效率的影响
分别取已制备的不同孢龄的200 μL赭曲霉孢子悬液和200 μL OD600=0.7的农杆菌悬液涂布于IM固体培养基上在25℃共培养48 h后,转接到PDA平板上放于28℃培养,筛选转化子。 结果如图4所示,对于新鲜培养的孢子,除了培养5 d的孢子转化效率比较低,培养6、7和8 d的孢子转化效率要远远高于保存1个月的赭曲霉孢子。其中,培养6 d的
赭曲霉孢子转化率最高。
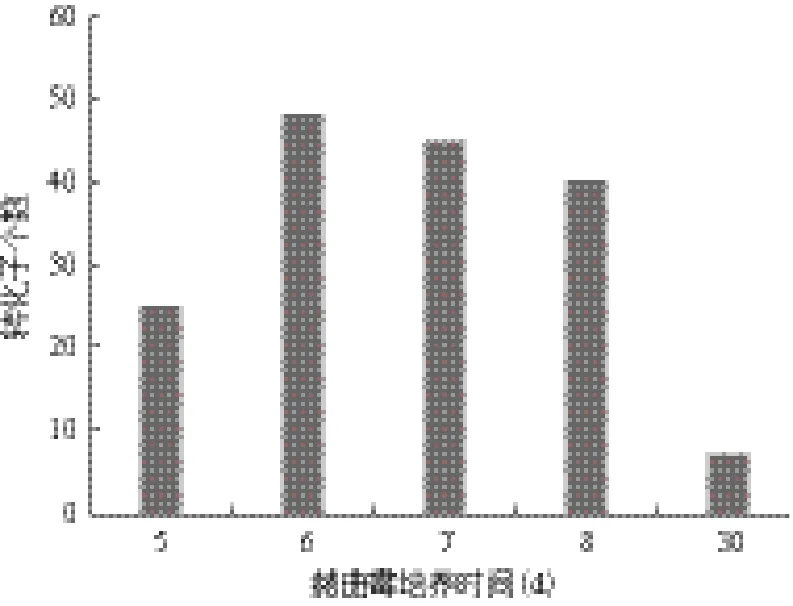
图4 赭曲霉孢龄对转化效率的影响
2.5 赭曲霉不同孢子浓度对转化效率的影响
分别取已制备的不同浓度的赭曲霉孢子悬液200 μL和OD600=0.7的农杆菌悬液200 μL涂布于IM固体培养基上在25℃共培养48 h后,转接到PDA平板上放于28℃培养,筛选转化子。
结果如图5所示,在赭曲霉孢子浓度为1×108个/mL时,转化效率明显较高,低于这个浓度时,转化效率下降。在孢子浓度为1×109个/mL时,平板上的单菌落也较多,但是其中的假阳性也较多,所以综合来看,其转化效率相对较低。
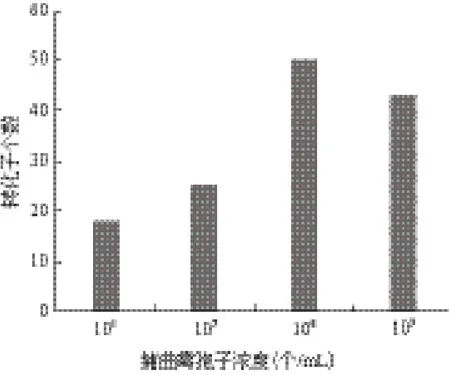
图5 赭曲霉孢子浓度对转化效率的影响
2.6 最佳共培养温度的确定
将农杆菌在含有AS的IM液体培养基中进行诱导培养至OD600=0.8时,取200 μL菌液与等体积的浓度1×108个的赭曲霉孢子悬液混合,在22、24、26和28℃下共培养,转膜到含有潮霉素B的PDA平板上,筛选转化子检测侵染效率。 如图6所示,最佳共培养温度为24℃,高于24℃时,农杆菌生长过快。低于或高于这个温度时,转化效率都不高。

图6 共培养温度对转化效率的影响
2.7 最佳共培养时间的确定
将农杆菌在含有AS的IM液体培养基中进行诱导培养至OD600=0.8时,取200 μL菌液与等体积的浓度1×108个的赭曲霉孢子悬液混合,在24℃下共培养24、48、72 h后,转膜到含有潮霉素B的PDA平板上,筛选转化子检测侵染效率。 如图7所示,最佳共培养时间为48 h,低于这个时间,转化效率明显降低。高于这个温度时,产生的假阳性较多。
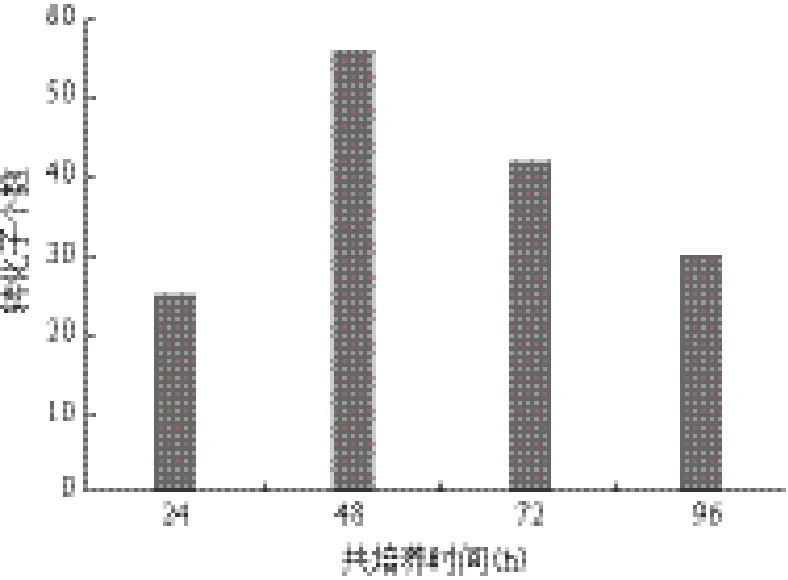
图7 共培养时间对转化效率的影响
2.8 转化子PCR验证和遗传稳定性的鉴定
从平板上随机挑选8个赭曲霉转化子,并且以野生型赭曲霉做为对照,提取基因组DNA进行PCR验证,8个转化子均能扩增出潮霉素片段约为1 390 bp,然而野生型赭曲霉的基因组作为模板时不能扩增出潮霉素基因的片段。结果如图8所示。
随机挑选8个阳性转化子转接至不含有潮霉素B的PDA培养基上进行传代培养。培养10代后,
将其转接至含有潮霉素B终浓度为200 μg/mL 的PDA平板上。发现转化子仍能正常生长,保持了对潮霉素B抗性的稳定性。由此表明突变体获得的潮霉素抗性基因能够稳定的遗传。

图8 赭曲霉转化子PCR验证
3 讨论
甾体激素药物是仅次于抗生素的第二类药物,具有很强的抗感染、抗过敏、抗病毒和抗休克等药理作用[19]。目前我国对赭曲霉的研究主要是应用其对环氧黄体酮、4-AD和左旋乙基甾烯双酮进行C-11α羟基化。甾体微生物转化的方法与之前化学转化法相比在一定程度上提高了转化效率,但距离真正的工业生产还存在一定的差距。例如,赭曲霉在进行甾体微生物转化过程中会产生一种砖红色色素,影响产物的分离纯化[20],并且现有菌株转化率不高。因此甾体转化工业急需引入新的技术手段或新思路来改善现状。
根癌农杆菌介导转化赭曲霉会受到很多因素的影响。首先,要选用新鲜的赭曲霉孢子。赭曲霉孢子培养时间不能太短,这可能是由于孢子还不够成熟。孢子培养时间过长,转化率也会有所下降。而且保存时间太久的孢子根本不能用于介导转化。
根癌农杆菌的菌悬液浓度和赭曲霉孢子悬液的浓度也极其重要。二者各自有其最佳浓度,高于或低于这个最佳浓度都会导致转化率的下降。当农杆菌浓度增加到OD600=0.8以上时,转化率并没有升高反而有下降的趋势。这可能是由于农杆菌的浓度增高导致其过度生长[21],抑制了赭曲霉的生长,从而导致了转化效率的下降。经查阅其他研究报道,根癌农杆菌对其他丝状真菌进行介导转化时,都要对二者的初始浓度进行优化,可见其对农杆菌侵染效率的影响[22]。
共培养温度和共培养时间同样是介导转化中的重要因素。农杆菌的最佳培养温度为28℃,但在介导转化中,温度过低,农杆菌不能生长。而温度过高又使得农杆菌生长过快,也会造成假阳性的产生。因此需要选择一个最佳共培养温度。同样,共培养时间太短,侵染过程还没有完全,而共培养时间太长,又会造成假阳性转化子太多[23]。
总之,该转化体系的成功构建在一定程度上解决了赭曲霉菌株定向改造的困难,并为赭曲霉基因的其他相关研究提供了重要工具。
4 结论
本试验选用农杆菌LBA4404,以赭曲霉TCCC41060为受体菌株,以潮霉素B为筛选标记,成功地建立了根癌农杆菌介导的赭曲霉的遗传转化体系。并成功优化了影响介导转化过程的主要因素,获得了较高转化率。
[1] 赵玉金, 杜连祥, 路福平. 深层培养中赭曲霉菌球对坎利酮11α羟化反应影响的研究[J]. 工业微生物, 2007, 37(3):20-23.
[2] O’Callaghan J, Caddick MX, Dobson ADW. A polyketide synthase gene required for ochratoxin A biosynthesis inAspergillus ochraceus[J]. Microbiology, 2003, 149(12):3485-3491.
[3] 苏彩云, 靳发彬, 张佳, 等. 丝状真菌的DNA转化方法[J].河北化工, 2007, 30(7):29-31.
[4] 李娟, 杨金奎, 梁连铭, 等. 丝状真菌遗传转化系统研究进展[J]. 江西农业大学学报, 2006, 28(4):516-520.
[5] Ruiz DB. Strategies for the transformation of filamentous fungi[J]. Journal of Applied Microbiology, 2002, 92(2):189-195.
[6] 卢萍, 王宝兰. 基因枪法转基因技术的研究综述[J]. 内蒙古大学学报, 2006, 35(1):106-109.
[7] Meyer V, Wedde M, Stahl U. Transcriptional regulation of the antifungal protein inAspergillus giganteus[J]. Molecular Genetics and Genomics, 2002, 266(5):747-757.
[8] Kahmann R, Basse C. REMI(Restriction enzyme mediated integration)and its impact on the isolation of pathogenicity genes in fungi attacking plants[J]. European Journal of Plant Pathology,
1999, 105(3):221-229.
[9] Michielse CB, Hooykass PJJ, Van den Hondel CMJJ, et al.Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J]. Current Genetics, 2005, 48(1):1-17.
[10] Mullins ED, Chen X, Romaine P, et al.Agrobacterium-mediated transformation ofFusarium oxysporum:An efficient tool for insertional mutagenesis and gene transfer[J]. Techniques, 2001, 91(2):173-180.
[11] Hanif M, Pardo AG, Gorfer M, et al. T-DNA transfer and intergration in the ectomycorrhizal fungusSuillus bovinesusing hygromycin B as a selectable marker[J]. Current Genetics, 2002, 41(3):183-188.
[12] Combier JP, Melayah D, Raffier C, et al .Agrobacterium tumefaciens-mediated transformation as a tool for insertional mutagenesis in the symbiotic ectomycorrhizal fungusHebeloma cylindrosporum[J].FEMS Microbiology Letters, 2003, 220(1):141-148.
[13] 郭慧, 杨哲, 邢来军, 等. 根癌农杆菌介导的日本曲霉转化体系的建立[J]. 微生物学报, 2011, 51(1):115-121.
[14] Michielse CB, Hooykaas PJJ, van den Hondel CAM, et al.Agrobacterium-mediated transformation of the filamentous fungusAspergillus awamori[J]. Nature Protocols, 2008, 3(10):1617-1687.
[15] 黎明, 刘萌, 黄云雁, 等. 根癌农杆菌介导的黑曲霉转化体系的建立及优化[J].中国生物工程杂志, 2012, 32(1):56-63.
[16] Sugui JA, Chang YC, Kwon-Chung KJ.Agrobacterium-mediated transformation of theAspergillus fumigates:an efficient tool for insertional mutagenesis and targeted gene disruption[J]. Applied and Environmental Microbiology, 2005, 71(4):1798-1802.
[17] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning[M]. 3rd Ed. Beijing:Science Press, 2002.
[18] Mahmood T, Zar T. Multiple pulses improve electroporation efficiency inAgrobacterium tumefaciens[J].Molecular Biology and Genetics, 2007, 26(4):13-16.
[19] 韩广甸, 韩卫亚. 关于我国皮质激素药物的发展策略[J]. 中国医药工业杂志, 1997, 28(12):559-562.
[20] 崔莹, 王敏. 赭曲霉P450 色素的提取与稳定性研究[J]. 现代食品科技, 2010, 26(4):370-371.
[21] 高兴喜, 杨谦, 郭兆奎, 等. 影响根癌农杆菌介导的木霉菌遗传转化因素分析[J]. 微生物学通报, 2005, 32(1):74-78.
[22] Mullins ED, Chen X, Romaine P, et al.Agrobacterium-mediated transformation ofFusarium oxysporum:an efficient tool for insertional mutagenesis and gene transfer[J]. Phytopathology, 2001, 91(2):173-180.
[23] av Takahara H, Tsuji G, Kubo Y, et al.Agrobacterium tumefaciensmediated transformation as a tool for random mutagenesis ofColletotrichum trifolii[J]. Journal of General Plant Pathology, 2004, 70(2):93-96.
(责任编辑 李楠)
Establishment of Agrobacterium tumefaciens-mediated Transformation System of Aspergillus ochraceus
Cui Qian Li Jie Liu Xiaoguang
(Tianjinn Key Laboratory of Industrial Microbiology,Key Laboratory of Industrial Fermentation Microbiology Ministry of Education,the College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457)
Filamentous fungus Aspergillus ochraceus TCCC41060 is an industrial strain used for microbial steroid C11-α hydroxylation. In order to create genetic tools for A. ochraceus, the transformation system of A. ochraceus was established using Agrobacterium tumefaciensmediated system(ATMT). A. tumefaciens LBA4404 was used as the infective strain and hygromycin B gene as the selection marker. The major factors affecting the transformation efficiency including the concentrations of A. tumefaciens cell and A. ochraceus spores, co-culture time, and co-culture temperature were investigated. Under the best conditions, the transformation efficiency of 57 transformants/107spores was obtained. A. ochraceus transformants were confirmed by PCR amplification . Randomly selected 8 transformants were shown to be genetically stable after 10 rounds of successive cultivation. Results indicated this ATMT transformation system would provide important means for the directed genetic manipulation of this important industrial strain A. ochraceus TCCC41060.
Aspergillus ochraceus Agrobacterium tumefaciens Transformantion system
2013-12-05
崔倩,女,硕士,研究方向:赭曲霉11α-羟化酶基因;E-mail:cuiqianyi@163.com
刘晓光,男,教授,硕士生导师,研究方向:酶与应用微生物;E-mail:liu_xg@tust.edu.cn

