水貂生长激素受体cDNA克隆与序列分析
荣敏,王雷,吴琼,李一清,徐佳萍,邢秀梅,杨福合
(中国农业科学院特产研究所吉林省省部共建特种经济动物分子生物学国家重点实验室,长春130112)
水貂是一种小型珍贵毛皮动物,貂皮是高档裘皮原料,自古就有“裘皮之王”的美称。对于水貂养殖业来说,皮张等级是直接影响经济效益的重要因素,而皮张大小是衡量皮张等级的重要指标。提高水貂皮张张幅的因素主要有增大体型、增加营养等,所以研究调控水貂生长发育的生长轴基因有非常重要的意义。生长轴是指动物体内从下丘脑—垂体—靶器官的由一系列激素及其受体所组成的神经内分泌系统。生长激素(GH)在动物生长轴中起着十分重要的作用,但是GH作为生物大分子,必须和靶细胞膜表面受体(GHR)相结合才能发挥作用[1]。
GHR基因最早是由Tsushima T等[2,3]1976年在兔肝细胞膜上发现的,Waters MJ等[4]1979年提纯了兔的GHR。目前已经成功克隆出了人、兔、大鼠、小鼠、猪、牛、羊等多种动物GHR基因[5~7]。人的GHR基因位于第5号染色体上,基因全长8.7kb[8],有10个外显子,共编码638个氨基酸,外显子2编码18个氨基酸的信号肽,外显子3~7编码246个氨基酸的胞外结构域,外显子8编码24个氨基酸的跨膜部分,外显子9~10编码350个氨基酸的胞外结构域[7]。成熟的人GHR是一个含有629个氨基酸残基的糖基化位点。猪的GHR基因cDNA也编码638个氨基酸,长1 952bp[9]。研究证明,哺乳动物的GHR基因cDNA同源性较高[10],目前,只有北美水貂GHR基因的622bp部分序列报道。
本研究以哺乳动物GHR基因cDNA序列为基础,克隆出水貂GHR基因的cDNA序列,为研究水貂GHR基因的全序列、功能及水貂生长发育的调控机理打下基础。
1 材料与方法
1.1 水貂肝脏
采自中国农业科学院特产研究所野生生物资源野外观测试验站打皮期美国短毛黑水貂的肝脏。
1.2 试剂
RNA提取试剂盒、反转录试剂盒、ExTaq酶、胶回收试剂盒、pMD19-T载体及DH5α感受态细胞(Takara公司)。
1.3 水貂肝脏RNA提取
按照RNA提取试剂盒说明书进行操作,提取完后放入-80℃超低温冰箱储存备用。
1.4 PCR扩增
根据GenBank中人、大鼠、牛、小鼠、羊、猪的GHR基因cDNA序列,用MEGA 4.1进行序列比对找到同源保守序列,结合Primer premier 5.0进行引物设计,选择简并度最低且分值较高的引物进行扩增。
上游引物:5′ACAGTGATGACTCTTGGGTTG3′
下游引物:5′GCATGATTTTGTTCAGTTGGT3′。
cDNA链的合成:按照反转录试剂盒进行。
PCR反应体系:ExTaq0.25μL,10×ExTaqbuffer 5μL,MgCl24μL,dNTP Mixture 4μL,cDNA 1μL,上、下游引物各1μL,ddH2O 33.75μL。PCR反应条件:94℃ 5min;94℃ 30s,58℃ 30s,72℃ 70s,30个循环 ;72℃ 5min。取5μL产物进行电泳并紫外成像。
1.5 PCR产物的纯化
将PCR产物进行1.5%凝胶电泳,并切胶回收(按照试剂盒操作进行)。
1.6 目的片段的测序鉴定
将PCR纯化产物送往上海生工生物工程技术服务有限公司进行测序。
1.7 目的片段生物信息学分析
在GenBank中进行blastn同源比对。利用MEGA 4.1软件进行进化树分析。
2 结果与分析
2.1 水貂RNA提取
水貂肝脏RNA提取后经紫外分光光度计测定,OD260/280在1.8~2.0之间,经1%琼脂糖凝胶电泳检测可清晰看到18S、28S 2条核糖体RNA条带,说明提取的RNA未出现明显降解。结果如图1。
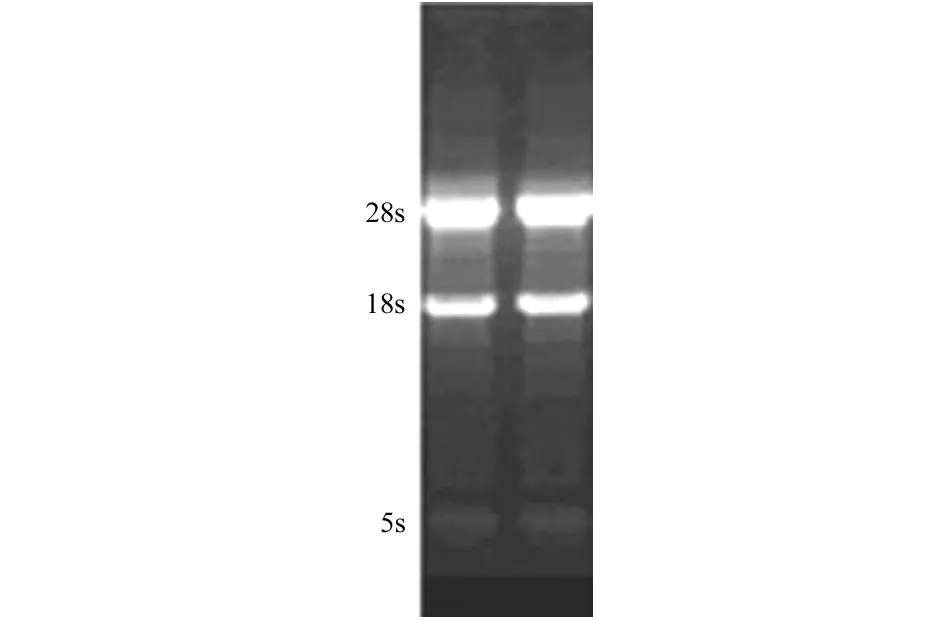
图1 水貂肝脏总RNA 1%琼脂糖凝胶电泳分析
Fig.11%agarosegelelectrophoresisanalysisofLivertotalRNAfrommink
2.2 PCR扩增结果
2.2.1cDNA链的合成按照反转录试剂盒2步法合成cDNA,在1%琼脂糖凝胶电泳中检测,条带呈弥散状。结果如图2所示。
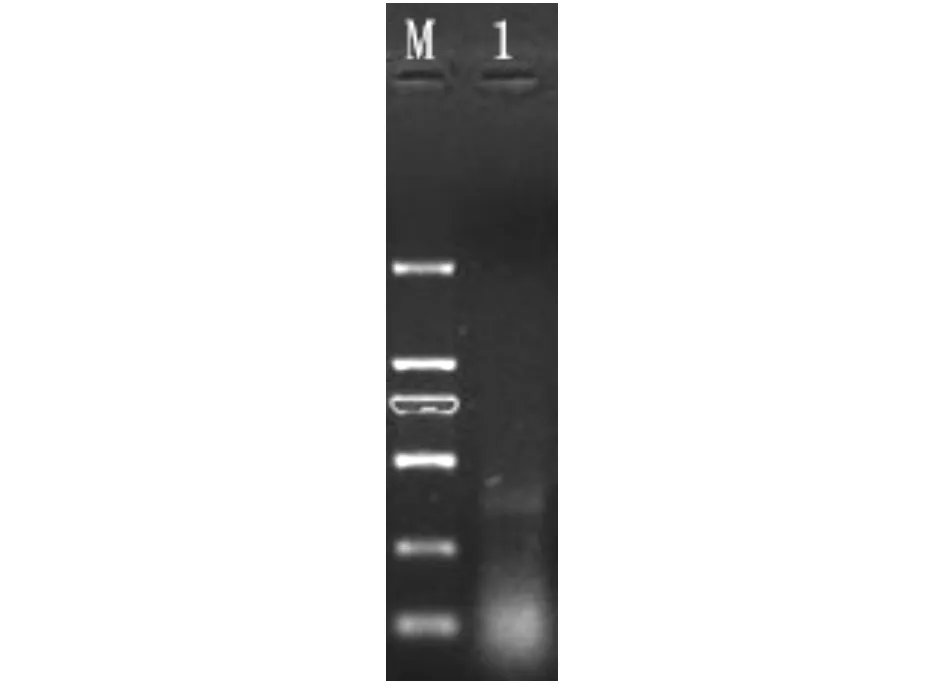
M.DL2 000;1.cDNA
2.2.2目的基因的扩增用设计的特异引物进行扩增,结果如图3所示,扩增条带为900bp左右,与设计的902bp接近,说明是目的片段。

M.DL2 000;1、2、3.PCR产物 M.DL2 000;1,2,3.PCRproducts
2.3 水貂GHR基因序列的生物信息学分析
PCR纯化产物测序后,对序列进行检查并去除两端的不准确序列,获得826bp的水貂GHR mRNA序列,如图4。
将序列提交到Http:∥blast.ncbi.nlm.nih.gov/网址进行序列比对,结果该序列与Genbank中雪貂(XM 004811437)的GHR mRNA预测序列同源性达98%;与獾(JN414715.1)的同源性也高达98%;与浣熊(JN414718.1)、小熊猫(JN414710.1)、新西兰海狗(JN414716.1)、海象(DQ240686.1)的同源性达94%;与港海豹(JN414717.1)、黑熊(DQ240683.1)、细尾獴(JN414712.1)同源性达93%;与大熊猫(AF395535.1)、家猫(EU448991.1)、狼(NM 001003123.1)、北极狐(EU304325.1)同源性达92%;与野猪(KC999114.1)同源性达89%;与山羊(DQ179245.1)同源性达87%;与梅花鹿(EU381142.1)、水牛(KC415270.1)、绵羊(NM 001009323.2)、牛(JQ711177.1)同源性达86%。

图4 水貂GHR基因的核苷酸序列
经分析,本研究获得的826bp水貂GHR基因部分编码序列A、T、G、C的平均含量分别为:26.51%、21.79%、23.24%、28.45%,A+T(48.31%) 图5 水貂GHR基因与其他哺乳动物同源基因序列系统进化树 生长轴的作用机制是:下丘脑分泌的生长激素释放激素以及生长抑素双重作用于垂体,调节垂体分泌生长激素,分泌的生长激素经血液循环到达肝脏,与肝脏细胞膜表面的生长激素受体结合,启动细胞内的信号转导机制,促进胰岛素样生长因子(IGFs)的表达,IGFs通过与靶组织中的类胰岛素生长因子(IGF)受体结合发挥生物学效应,而此效应受与类胰岛素生长因子受体(IGFR)竞争结合IGFs的IGF结合蛋白的调节。血液中高浓度的IGFs还可以负反馈作用于下丘脑和垂体,从而调节生长激素的释放。在这些生长因子中,GH-IGF-I作为生长轴的中心环节,在动物的生长调控中起着重要作用[11~14]。生长激素受体在动物生长发育过程中起着重要作用,它的突变将引起严重的生长障碍。 本研究根据已有的哺乳动物序列信息比对找到保守序列,并以其作为模板设计引物进行RT-PCR,成功扩增出水貂GHR cDNA序列。同源性分析表明,水貂GHR序列与其他哺乳动物具有较高的同源性,为进一步研究水貂GHR基因的全序列提供基础。进化树分析,水貂与熊猫归为一支,然后共同与北极狐归为一支,牛、羊与梅花鹿反刍动物归为一支,大鼠、小鼠啮齿类归为一支,与传统的物种系统进化关系基本一致。 水貂作为珍贵的毛皮动物,养殖前景非常广阔,但是水貂的科学研究却相对落后于其他动物,本研究也只是对水貂GHR基因的部分编码序列进行了克隆测序,为接下来研究全序列及该基因与生产性能的相关性提供基础。 [1]刘媛,孙志颖,孙少华,等.牛GHR基因编码区生物信息学分析[J].中国奶牛,2013,(8):1-4. [2]Tsushima T.Technics of growth hormone receptor assay[J].Nippon Rinsho,1976,34(3):461-465. [3]焦凯.生长激素受体[J].国外医学:内分泌分册,1993,13(6):58-60. [4]Waters M J,Friesen H G.Purification and partial characterization of a nonprimate growth hormone receptor[J].J Bio Chem,1979,254(14):6815-6825. [5]Wallis M.Growth hormone receptor cloned[J].Nature,1987,330(10):521-522. [6]Argetsinger L S,Carter-Su C.Mechanism of signaling by growth hormone receptor[J].Physiol Rev,1996,76(4):1089-1107. [7]孙逊,朱尚权.生长激素受体的结构、功能及其信号转导[J].国外医学:生理、病理科学与临床分册,1999,19(1):9-14. [8]Godowski P J,Leung D W,Meacham L R,et al.Characterization of the human growth hormone receptor gene and demonstration of a partial gene deletion in two patients with Laron-type dwarfism[J].Proc Natl Acad Sci USA,1989,86(20):8083-8087. [9]Cioffi J A,Wang X,Kopchick J J.Porcine growth hormone receptor cDNA sequence[J].Nucleic Acids Res,1990,18(21):645. [10]赵茹茜.鸡生长激素受体研究新进展[J].中国家禽,1999,21(6):41-42. [11]Gray ES,Kelley KM.Growth regulation in the goblid teleost Gillichthys roles of growthhormone,hepatic growth mirabilis;factor 1 receptors and insulin-like growth[J].J.Errdocrinol,1991,131:57-66. [12]Schlechter NL,Russell SM,Spencer EM,et al.Evidence suggesting that the direct growth-promoting effects of growth hormone on cartilage in vivo is mediated by local production of somatomedin[J].Proc Natl Acad Sci USA,1986,83:7932-7934. [13]LIN H R,Zhang Q,Peter R E.Effects of recombinant tuna growth hormone GH and analogues of gonadotropin-releasing hormone on growth of grasscarp Ctenopharyngodon idella[J].Aquaculture,1995,129:342-343. [14]MaMahon CD,Radcliff RP,Lookingl K.J,et al.Neuroregulation of growth hormone secretion in domestic animals[J].Domestic animal endocrinology,2001,20(2):65-87.
3 讨论

