文蛤蛋白水解制备抗氧化活性肽的研究
宋文静,白仁奥,何传波,魏好程,马 英,熊何健
(1.集美大学 生物工程学院,福建 厦门 361021;2.集美大学 水产学院,福建 厦门 361021)
生物活性肽是介于氨基酸与蛋白质之间的分子聚合物,由天然氨基酸以不同的组成和排列方式构成,分子质量一般小于 6 000 u,在空间构象上比较松散,是一类对生物机体的生命活动有益或具有特定生理作用的多功能化合物[1].许多生物活性肽具有良好的理化性质,使得它们在一些应用上比氨基酸和蛋白质更加广泛.作为营养物质,一些小肽的吸收速率比同一组成的氨基酸快,而且多肽溶液与相对应的氨基酸溶液相比较,具有较低的渗透压,口服时不易引起腹泻.多肽良好的水溶性和易吸水的特性,可以作为食品添加剂中优良的保湿剂.另外,生物活性肽具有多方面的生物活性功能,如抗微生物、降血压(ACE抑制)、抗氧化、细胞免疫调节和肿瘤抑制活性[2-6].
文蛤是我国主要的滩涂经济贝类之一,富含蛋白质、脂肪、碳水化合物以及钙、钾、镁、磷、铁等多种人体所需的矿物质[7].近年来的研究表明,文蛤含有多种天然活性物质,具有多方面的生理调节功能.文蛤中多糖类物质具有增强免疫和调节血糖的功效,文蛤中天然多肽和蛋白质也表现出较强的肿瘤抑制活性、抗氧化活性、ACE酶抑制活性等[8-11].
本研究通过用蛋白酶对文蛤蛋白进行水解,制备抗氧化活性肽,提高文蛤的资源利用率和经济附加值,有利于促进文蛤养殖、加工产业的可持续发展.
1 材料与方法
1.1 材料与仪器
鲜活文蛤,购于厦门市集美区,-18 ℃冷冻4 h后取肉、去内脏,绞成肉糜,分装后于-18 ℃冻存.
复合蛋白酶(Protamex)、中性蛋白酶(Neutrase)和碱性蛋白酶(Alcalase 2.4 L)购于诺维信(中国)生物技术有限公司;风味蛋白酶(Flavourzyme)和木瓜蛋白酶(Papain),购于广西庞博生物工程有限公司.福林酚试剂,甲醛,乙酸乙酯,TFA等所用化学试剂无特殊说明,都为分析纯(AR).
UDK132自动凯氏定氮仪:意大利VELP公司;Lab Scale Millipore超滤系统: Millipore;Ultimate 3000 高效液相色谱仪:DIONEX;4800 型质谱仪:Applied Biosystem.
1.2 实验方法
1.2.1 水解液多肽粉的制备
文蛤肉用复合蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶和木瓜蛋白酶在其最佳水解条件下分别水解1~5 h,85 ℃灭酶15 min,冷却后 5 000 r·min-1离心20 min,取上清液冷冻干燥,收集多肽粉冻存于-20 ℃冰箱.
1.2.2 多肽粉分子量分布的测定
HPLC分析条件:DIONEX Ultimate 3 000 HPLC,TSK gel G 2 000 SWXL( 7.8 mm×300 mm)凝胶柱,流动相为V(乙腈)∶V(超纯水)∶V(TFA)=45∶55∶0.1,流速为0.5 mL/min,检测波长为220 nm.
1.2.3 DPPH自由基(DPPH·)清除活性的测定
用95%乙醇配制浓度为0.2 mmol/L的DPPH溶液,取2 mL一定浓度的样品溶液,加入2 mL上述浓度的DPPH溶液,震荡混匀,避光室温放置30 min,在517 nm测定吸光值,记为Ai;对照组取2 mL 95%乙醇加入2 mL DPPH溶液,吸光值记为Ac;2 mL一定浓度的样品溶液加入2 mL 95%乙醇混匀后测定的吸光值记为Aj;以2 mL蒸馏水加2 mL 95%乙醇调零.
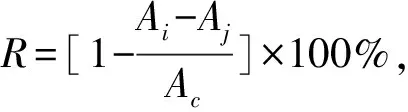
建议给涉农企业和人员建立单独的“数据采集平台”,将所有涉税信息进行上传,有关部门信息共享,工作人员会比较迅速和准确地进行处理,及时做出反应和判断,做好税收管理各项工作,提升执行力度和速度。涉农企业及人员也应尽量配合“平台”运转,按照要求及时登录“平台”,必要时机关指派专人协助完成此项工作,将票据和数据等整理后上传平台并做好相关信息登统工作。合理、科学地运用现代化技术进行税收管理,既能更加快速地通知企业、人员享受最新的税收优惠政策,也强化了税收管理力度,打击非法偷逃税行为,共同营造公平公正的纳税环境,保护涉农企业和人员的合法权益。
1.2.4 超滤膜分离抗氧化多肽组分
将制备的文蛤多肽粉用超纯水溶解,配制多肽溶液,经0.45 μm微孔滤膜过滤.然后依次过截留分子质量(MWCO)为8 ku和截留分子质量为5 ku的超滤膜,将木瓜蛋白酶分成分子质量大于8 ku,5 ku至8 ku和小于5 ku 3部分,并将其分别冻干,测定各个组分在1 mg·mL-1质量浓度下对DPPH自由基的清除率.
1.2.5 Sephadex G-25凝胶色谱柱分离抗氧化多肽组分
将处理过的葡聚糖凝胶Sephadex G-25装入2.5 cm×60 cm玻璃柱,用蒸馏水过夜平衡,将DPPH清除活性最高的活性肽超滤组分用超纯水溶解,配制多肽溶液,并经0.45 μm微孔滤膜过滤、上柱,用蒸馏水以60 mL/h流速洗脱,每管收集4 mL洗脱溶液,将收集的组分用紫外可见光分光光度计测定其280 nm处吸光度,并绘制吸光度曲线,按照先后顺序收集洗脱峰,冷冻干燥,并测定其DPPH·清除率.
1.2.6 RP-HPLC分离抗氧化多肽
将DPPH·清除率最高的Sephadex G-25凝胶分离组分用超纯水溶解,配制多肽溶液,经0.45 μm微孔滤膜过滤,用高效液相色谱仪DIONEX-Ultimate 3000(VWD-3400RS检测器)进行进一步地分离纯化[16].分离纯化条件如下:色谱柱Waters SunFire C18柱(4.6 mm×250 mm,5 μm),上样量100 μL,流速0.6 mL/min,柱温30 ℃,检测波长220 nm,线性梯度洗脱为乙腈(含0.1%TFA)5%至35%,洗脱54 min.收集各个组分峰,冷冻干燥,并测定各个组分峰的DPPH自由基清除率.
1.2.7 文蛤抗氧化多肽相对分子质量测定、结构鉴定
完成一级MS后,直接选择与对照基质有差异的肽段进行MS/MS分析,采用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS,Applied Biosystem 4800,USA)对抗氧化肽一级结构进行分析鉴定[13].
1.2.8 统计分析
所有数据都以平均值和标准偏差的形式表示,每个实验重复3次,结果采用 SPSS 软件进行方差分析(ANOVA),P<0.05的显著水平结果被采用.

表1 5种蛋白酶不同酶解时间水解产物的DPPH·清除率
2 结果与分析
2.1 5种蛋白酶水解产物的DPPH·清除活性
表1比较了5种蛋白酶不同酶解时间水解产物的DPPH·清除率(%),样品测定质量浓度为1 mg/mL.结果显示,5种蛋白酶水解产物清除DPPH自由基强弱顺序依次是:木瓜蛋白酶(Papain)>碱性蛋白酶(Alacalase 2.4 L)>风味蛋白酶(Flavourzyme)>中性蛋白酶(Neutrase)>复合蛋白酶(Protamex),其中,木瓜蛋白酶4 h水解产物的DPPH·清除率最高,达55.74%,故选用该水解产物进行后续抗氧化活性肽的筛选.
2.2 水解产物分子量分布
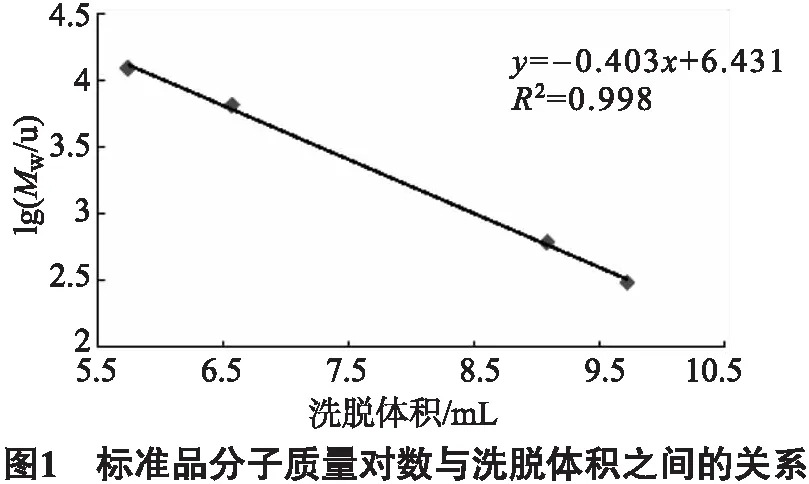
以细胞色素C、aprotinin、GSSG、GSH为标准品,洗脱体积为横坐标,标准品的分子质量的对数值为纵坐标作标准曲线,结果如图1所示,线性良好.
木瓜蛋白酶在其最佳水解条件下水解文蛤蛋白4 h,测定其水解产物中肽的分子质量分布(见表2).结果表明,分子质量低于 5 000 u的肽占95%以上.
2.3 抗氧化活性组分的分离纯化
2.3.1 超滤法分离纯化抗氧化多肽
木瓜蛋白酶水解产物依次过截留分子质量(MWCO)为8 ku和5 ku的超滤膜,获得分子质量大于8 ku(Ⅰ)、5 ku至8 ku(Ⅱ)、小于5 ku(Ⅲ)3个组分,表3显示的是3组分的DPPH·清除率.结果表明,水解产物中分子质量小于5 ku的产物具有较好的DPPH自由基的清除率,且该组分水溶性好,样品较均一,有利于后续的分离纯化,因此,选用该组分进行后续的组分分离操作.
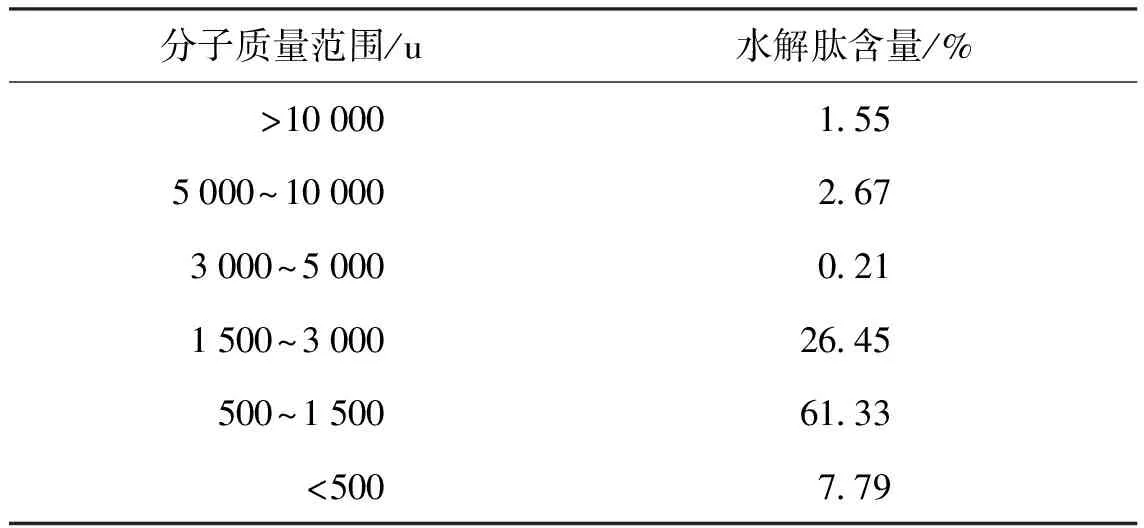
表2 木瓜蛋白酶4 h水解产物分子质量分布

表3 木瓜蛋白酶水解产物超滤组分的DPPH·清除率
2.3.2 凝胶层析法分离纯化抗氧化多肽
将超滤后分子质量小于5 ku的样品用Sephadex G-25凝胶色谱柱进行层析分离,得到4个主要组分PA、PB、PC和PD(如图2).它们对DPPH·的清除率依次为:(45.74±1.38)%、(61.53±1.68)%、(11.65±0.86)%和(16.3±1.12)%(见图3).峰PB清除DPPH·的活性最强,将此组分利用RP-HPLC进行进一步的分离.


2.4 RP-HPLC分离抗氧化多肽
图4显示的是组分PB进行RP-HPLC纯化分离的色谱图,按照出峰的先后顺序收集了12个组分,收集并冻干样品,测定不同组分对DPPH·清除率得到如图5所示结果,结果显示,PB4对DPPH自由基的清除率最高,为(71.41±1.1)%,对应的样品为图4所示的4号峰.

2.5 抗氧化多肽的结构鉴定
2.5.1 组分PB-4的质量指纹图谱
图6为MAILDI-TOF/TOF MS测定的PB-4组分的一级质谱图,即分子量质谱图.图谱显示组分PB-4的分子质量分布在(800~1 500)u之间.



实验采用MAILDI-TOF/TOF MS结合串联质谱仪(TOF-MS/MS)的方法分析PB-4组分的氨基酸序列.在组分PB-4一级质谱的基础上,我们选取所有可能的目的肽段,对其氨基酸序列进行进一步的分析鉴定,得到4个符合要求的目的多肽,其TOF-MS/MS图谱如图7所示,它们的氨基酸序列分别是:LNFNLEKSR(1 120.3 u)、SWLRPR(814.4 u)、RIGNIISQY(1 063.3 u)和LNFNLEK(877.2 u).
3 讨论
蛋白质水解时,由于蛋白酶的酶切位点的差异和水解度的不同,会导致产物的肽链长度、暴露的氨基酸基团、分子质量分布等的不同,因而产物抗氧化活性也不同.Ajibola等[14]发现非洲凉薯种子蛋白水解产物中分子质量小于 1 000 u的肽段抗氧化活性更强.Li等[15]报道的鹰嘴豆蛋白水解产物抗氧化活性最强的组分,其分子质量分布主要介于200~3 000 u;Zhong等[16]在水解白鲢内脏蛋白的研究中,发现分子质量小于1 ku的组分具有最佳的自由基清除能力.Ajibola等发现分子质量小于 1 000 u的肽段抗氧化活性最强,其中疏水性氨基酸和芳香族氨基酸在抗氧化活性中起重要作用,可能是因为这些疏水性氨基酸提高了非极性环境下多肽的溶解性,促进其与自由基的相互作用进而清除自由基.本研究用复合蛋白酶(Protamex)、中性蛋白酶(Neutrase)、木瓜蛋白酶(Papain)、碱性蛋白酶(Alcalase2.4 L)和风味蛋白酶(Flavorzyme)5种蛋白酶单酶水解文蛤蛋白,并测定其不同酶解时间水解产物的DPPH·清除率,结果表明木瓜蛋白酶4 h水解产物的DPPH清除率最高,该水解产物中分子质量小于5 ku的肽组分占95.78%,DPPH清除率达到52.31%.进一步地用超滤、凝胶色谱柱层析和RP-HPLC进行分离,并进行结构鉴定,得到4个目的多肽:LNFNLEKSR( 1 120.3 u)、SWLRPR(814.4 u)、RIGNIISQY( 1 063.3 u)和LNFNLEK(877.2 u).这4段多肽中疏水性氨基酸(HAA)和芳香族氨基酸(AAA)占绝大部分,其中Leu、Phe,Ile等疏水性氨基酸最多.
4 结语
木瓜蛋白酶水解文蛤蛋白的水解产物具有较高的抗氧化活性,其中分子质量小于 3 000 u的多肽具有更强的抗氧化活性,分离纯化后得到的4种符合要求的目的多肽,它们的氨基酸序列如下:LNFNLEKSR( 1 120.3 u)、SWLRPR(814.4 u)、RIGNIISQY( 1 063.3 u)和LNFNLEK( 877.2 u).

参考文献:
[1] 李维, 兰海楠, 郭风, 等. 生物活性肽的研究进展[J].中国畜牧兽医, 2012, 39(10): 105-107.
[2] LEE J K, PARK S C, HAHM K S, et al. A helix-PXXP-helix peptide with antibacterial activity without cytotoxicity against MDRPA-infected mice[J].Biomaterials, 2014, 35(3): 1025-1039.
[3] DOYEN A, UDENIGWE C C, MITCHELL P L, et al. Anti-diabetic and antihypertensive activities of two flaxseed protein hydrolysate fractions revealed following their simultaneous separation by electrodialysis with ultrafiltration membranes[J].Food Chemistry, 2014, 145: 66-76.
[4] TAHERI A, SABEENA FARVIN K H, JACOBSEN C, et al. Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J].Food Chemistry, 2014, 142: 318-326.
[5] WANG H, XIAO H, ZHONG L, et al. Cell-penetrating fusion peptides OD1 and OD2 interact with Bcr-Abl and influence the growth and apoptosis of K562 cells[J].Molecular and Cellular Biochemistry, 2014, 385(1/2): 311-318.
[6] NING X, ZHAO J, ZHANG Y, et al. A novel anti-tumor protein extracted fromMeretrixmeretrixLinnaeus induces cell death by increasing cell permeability and inhibiting tubulin polymerization[J].International Journal of Oncology, 2009, 35(4): 805-812.
[7] KARNJANAPRATUM S, BENJAKUL S, KISHIMURA H, et al. Chemical compositions and nutritional value of Asian hard clam ( Meretrix lusoria) from the coast of Andaman Sea[J].Food Chemistry, 2013, 141(4): 4138-4145
[8] 袁强, 袁弘. 文蛤多糖对实验性糖尿病大鼠免疫功能的影响[J].浙江中医药大学学报, 2007, 30(6): 612-613.
[9] 吴杰连, 张铂, 黄春洪, 等. 文蛤糖肽 (MGP 0501) 体外抗癌活性研究[J].药物生物技术, 2006, 13(4): 260-264.
[10] 张昊, 任发政. 天然抗氧化肽的研究进展[J].食品科学, 2008, 29(4): 443-447.
[11] 于志鹏, 赵文竹, 刘博群, 等. 血管紧张素转化酶抑制肽研究进展[J].食品科学, 2010, 31(11): 308-311.
[12] ZHANG X, SU B, LI J, et al. Analysis by RP-HPLC of mangiferin component correlation between medicinal loranthus and their mango host trees[J].Journal of Chromatographic Science, 2014, 52(1): 1-4.
[13] ZHANG J, ZHANG H, WANG L, et al. Isolation and identification of antioxidative peptides from rice endosperm protein enzymatic hydrolysate by consecutive chromatography and MALDI-TOF/TOF MS/MS[J].Food Chemistry, 2010, 119(1): 226-234.
[14] AJIBOLA C F, FASHAKIN J B, FAGBEMI T N, et al. Effect of peptide size on antioxidant properties of African yam bean seed (Sphenostylis stenocarpa) protein hydrolysate fractions[J].International Journal of Molecular Sciences, 2011, 12(10): 6685-6702.
[15] LI Y, JIANG B, ZHANG T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J].Food Chemistry, 2008, 106(2): 444-450.
[16] ZHONG S, MA C, LIN Y C, et al. Antioxidant properties of peptide fractions from silver carp (Hypophthalmichthys molitrix) processing by-product protein hydrolysates evaluated by electron spin resonance spectrometry[J].Food Chemistry, 2011, 126(4): 1636-1642.

