灰旱獭-长尾黄鼠鼠疫疫源地监测中应用ELISA检测F1抗体的可行性分析
热娜·吐尔地,阿不力米提·买托乎提,布仁明德,阿布力克木·阿不都热西提,雷 刚,王信惠,廖力夫,徐秉臣
我国的灰旱獭(Marmotabaibacina)-长尾黄鼠(Citellusundulatus)双宿主鼠疫疫源地,仅分布在北天山北坡,东起沙湾县的博尔霍拉地区,西到尼勒克县的恰克兰尼勒克沟。乌苏市古尔图山地牧场(N 44°050~44°20',E83°22'~83°50') 灰旱獭-长尾黄鼠混居,1964年从自毙长尾黄鼠脏器分离出第一株鼠疫菌,1967年发生1例人间腺鼠疫死亡病例,被定为灰旱獭-长尾黄鼠双宿主鼠疫疫源地[1]。古尔图山地牧场在各类鼠疫疫源地中,不仅动物血清鼠疫F1抗体阳性率较高,而且分离的鼠疫菌株也较多[1]。2010-2012年鼠疫监测工作中,应用酶联免疫吸附试验夹心法(ELISA)与间接血凝试验(IHA)检测鼠疫F1抗体,本文报告两种方法的检测结果并讨论ELISA鼠疫监测中的应用前景。
1 材料与方法
1.1材料
1.1.1标本 鼠疫监测工作中釆集的灰旱獭、长尾黄鼠和牧犬血清,加硫柳汞防腐,4 ℃保存备用。
1.1.2试剂 间接血凝试验检测鼠疫菌F1抗体诊断试剂盒:吉林博德医学免疫制品有限公司,批号:20100101,20110115,20111215;酶联免疫吸附试验检测鼠疫菌F1抗体诊断试剂盒:新疆维吾尔自治区疾病预防控制中心,兰州生物制品研究所研制,批号:20100315,20110501,20120103。
1.1.3仪器 酶标仪(Multiskan Mk3) 上海热电仪器有限公司;洗板机(WELLWASH 4MK2) 上海赛默飞世尔仪器有限公司。
1.2方法
1.2.1IHA检测鼠疫F1抗体(微量法) 微量血凝板管底为90°角V形,试验在28~37 ℃进行,设阳性、阴性对照。初筛:每份标本6管,每管加稀释液25μL,首管加标本25 μL,连续2倍稀释到最末管;每管加1%F1抗原致敏血细胞液25 μL,旋转振荡1 min,28~37 ℃静置90 min,观察结果,凝集血细胞布满管底为阳性反应终点。验证:包括测滴度试验和抑制试验,滴度试验列每管加稀释液,抑制试验列加含鼠疫F1抗原稀释液,首管加复检标本,连续2倍稀释到最末管;以下操作步骤同初筛试验。滴度试验的阳性反应滴度比抑制试验高2个或2个以上滴度为验证试验阳性,判为鼠疫F1抗体阳性反应,滴度用1∶2n表示,n为阳性反应终点管数[2]。
1.2.2ELISA检测鼠疫F1抗体 试验在28~37 ℃进行,设阳性、阴性对照。初筛:鼠疫F1抗原反应板每管加稀释液50 μL;每管加1份标本50 μL,静置90 min;流水冲洗5次;加酶标Fl抗原液100 μL,反应45 min,流水冲洗5次加TMB显色液A液B液,避光反应15 min,加终止液,阴性为无色或颜色很淡。观测记录结果:目测:距白色背景15~20 cm,从上方向下观察,阴性(-)无色或颜色很淡,阳性(+)颜色明显可见;比色计比色:双波长450 nm/630 nm,标本OD值>0.2为阳性反应。验证:初筛阳性反应标本做验证试验,滴度试验列加稀释液,抑制试验列加含鼠疫F1抗原的稀释液,两列的首管加同份标本,连续2倍稀释;以下操作步骤同初筛试验。标本OD >0.20为阳性反应滴度终点,滴度用1∶2n表示,n为阳性反应终点管数。检测滴度试验比抑制试验滴度高2个或2个以上滴度为验证试验阳性,判为鼠疫F1抗体阳性[2]。
1.2.3鼠疫细菌学检验 包括显微镜检查,分离培养,噬菌体裂解试验,和动物试验四个步骤[2]。
1.2.4统计方法 用SPSS 16.0统计软件,显著性检验,阳性率用χ2检验,阳性反应几何平均滴度用t检验。
2 结 果
2.1鼠疫F1抗体阳性率比较 乌苏市古尔图地区2010-2012年,灰 旱 獭、长尾黄鼠和牧犬血清,用ELISA和IHA检测血清鼠疫F1抗体,结果見表1。ELISA和 IHA检测血清鼠疫F1抗体,长尾黄鼠血清的阳性率分别为11.71%(118/1008) 和1.73% (21/1216),差异非常显著(χ2=93.67,P<0.001);牧犬血清的阳性率分别为38.89% (28/72) 和10.71% (7/75) ,差异非常显著(χ2=18.56,P<0.001)。检测长尾黄鼠和牧犬血清鼠疫F1抗体,ELISA的阳性率高于IHA。
2.2鼠疫F1抗体滴度分布 ELISA和IHA两种方法检测2010-2012年间的血清鼠疫F1抗体,阳性反应滴度分布列于表2,以ELISA的阳性标本数计算两种方法的平均滴度。检测长尾黄鼠血清鼠疫F1抗体, ELISA和IHA的平均滴度分别为27.805(s 23.427)和21.254(s 22.832),差异非常显著(t=51.38P<0.001);牧犬血清鼠疫F1抗体平均滴度分别为27.731(s 22.736)和21.50(s 22.611),差异非常显著(t=14.034P<0.001)。
2.3检验鼠疫菌结果 鼠疫细菌学监测数据見表3。从病死灰旱獭中分离的2株鼠疫菌,跳蚤分离的鼠疫菌株较多,受跳蚤保存液中结晶紫质量和保存时间的影响,不同年份的检出率差异较大;长尾黄鼠鼠疫菌检出率较高,且检出率较稳定。长尾黄鼠鼠疫菌检出率与F1抗体阳性率比较見表4。
3 讨 论
ELISA是目前多种疾病监测中最常用的方法,已成为国际主流技术,敏感性和特异性大大高于IHA[3]。在鼠疫监测中,ELISA已经成为采用国家最多的抗体检测方法,一些新近开展鼠疫监测的国家,在国际组织的支持下也开始使用这种方法[4-5]。我国在5年前,就把ELISA和IHA检测鼠疫F1抗体列入了鼠疫诊断标准(WS279-2008)[2]。
ELISA检测鼠疫F1抗体试剂盒,25 ℃以下阴凉处保存60 d效价稳定,冲洗步骤洗去与特异性反应无关的物质,排除溶血和腐败物质的干扰。酶标抗原催化底物的显色反应,显示F1抗体的含量。鼠疫F1抗原致敏红细胞是IHA检测鼠疫F1抗体的关键试剂,混悬液中醛化红细胞吸附F1抗原的量和牢度,对温度、pH值、离子种类和强度的变化十分敏感,野外现场工作中运输和保存试剂,经常偏离适宜条件,导致F1抗原从醛化红细胞表面脱落,试剂的效价降低甚至完全失效。抑制试验只能降低特异性凝集滴度,而不改变非特异性凝集滴度。IHA检测严重溶血、腐败标本,常出现高滴度非特异性凝集,低滴度特异性凝集被高滴度非特异性凝集掩盖,这是IHA检测鼠疫F1抗体滴度分布缺乏低滴度阳性的主要原因。检测长尾黄鼠和牧犬血清鼠疫F1抗体,ELISA的阳性率是IHA的6.77倍(χ2=73.67,P<0.001)和3.63倍(χ2=18.56,P<0.001),ELISA的几何平均滴度是IHA的6.22倍(t=51.38,P<0.001)和5.15倍(t=14.034,P<0.001)。ELISA和IHA检测长尾黄鼠和牧犬血清鼠疫F1抗体的敏感性差异非常显著。
IHA与ELISA检测鼠疫F1抗体阳性率显著性检验:长 尾 黃 鼠:χ2=73.67P<0.001 牧 犬:χ2系希腊文=18.56P<0.001.
Note: The significance between IHA and ELISA in detecting plague F1 antibody:Citellusundulates--χ2=73.67,P<0.001; husbandry dog--χ2=18.56,P<0.001.
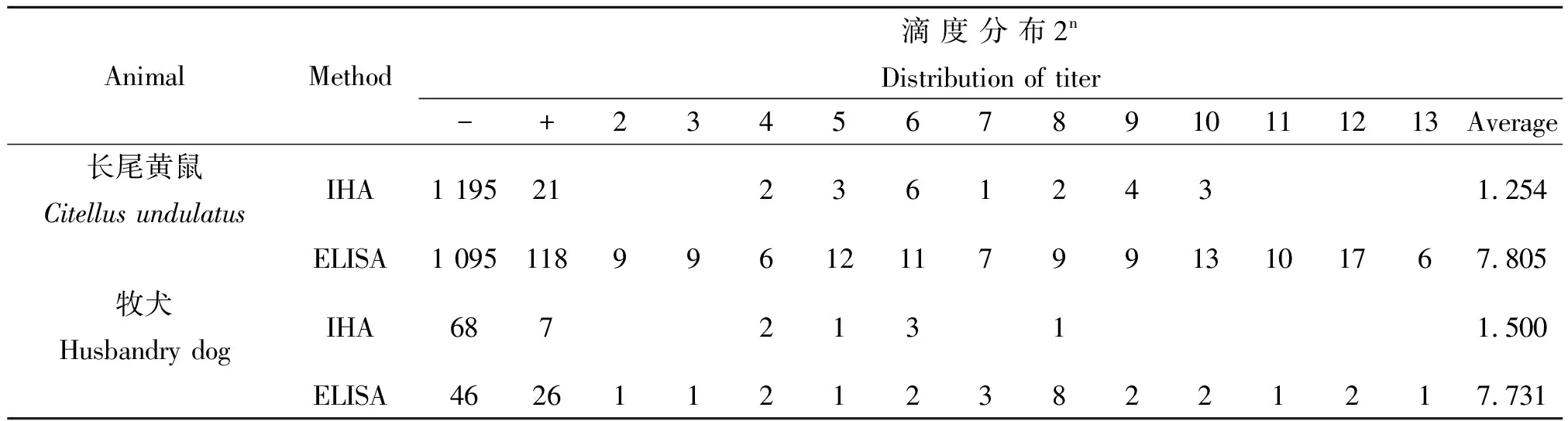
表2 两种方法检测长尾黄鼠和牧犬血清鼠疫F1抗体滴度分布
IHA与ELISA检测鼠疫F1抗体平均滴度显著性检验:长尾黄鼠t=51.38P<0.001 牧犬t=14.034P<0.001.
Note: The significance between IHA and ELISA in detecting the average titer of plague F1 antibody:Citellusundulates--t=51.38,P<0.001, husbandry dog--t=14.034,P<0.001.

表3 乌苏市古尔图地区检验鼠疫菌结果

表4 ELISA和IHA长尾黄鼠F1抗体阳性率与检菌阳性率比较
细菌学方法分离鼠疫菌和免疫学方法检测鼠疫F1抗体,都是鼠疫监测的重要内容,分离鼠疫菌试剂稳定,技术成熟,实验动物为清洁级小白鼠,表3显示长尾黄鼠脏器鼠疫菌检出率高,且检出率稳定。表4显示长尾黄鼠F1抗体阳性率与鼠疫菌检出率的比值,ELISA比值大、波动小(8.016~8.714),IHA比值小、波动大(0.528~1.649),提示ELISA检测长尾黄鼠F1抗体是灰旱獭-长尾黄鼠鼠疫疫源地监测的敏感稳定的指标。
我国开展鼠疫监测较早,至今仍沿用2005年的全国鼠疫监测方案,该监测方案检测鼠疫F1抗体只有IHA一种方法。为了能与世界同步,与周边国家的监测结果相比较,我国也应当在监测中推广ELISA检测抗体方法[6]。依照新版鼠疫诊断标准(WS279-2008)修订鼠疫监测方案,增加ELISA检测抗体方法,不仅附合方案服从标准的原则,而且可提高鼠疫诊断的准确性,减少根据错误检验结果实施防控措施的损失。在灰旱獭-长尾黄鼠鼠疫疫源地监测中,应用ELISA和 IHA检测血清鼠疫F1抗体,为修订全国鼠疫监测方案提供实验数据和参考资料。
参考文献:
[1]Zhang HY. Xinjiang plague[M]. Urumqi: Endemic Bulletin Editorial Board, 1994: 20-28. (in Chinese)
张鸿猷.新疆鼠疫[M].乌鲁木齐:地方病通报编辑部,1994: 20-28.
[2]MOH.Health care industry standard of the People's Republic of China WS 279-2008 diagnostic criteria of plague[S](The 2008-09-01 implementation). (in Chinese)
中华人民共和国卫生部.中国人民共和国卫生行业标准WS279-2008鼠疫诊断标准[S](2008-09-01实施).
[3]Hai R. Development and application of plague diagnostic techniques in China[J]. Chin J Endemiol, 2007, 26(5): 473-474. (in Chinese)
海荣.鼠疫诊断技术在我国的发展及应用前景[J].中国地方病学杂志, 2007, 26(5):473-474.
[4]Tikhomirov E, Dennis DT, Gage KL, et al. Plague manual: epidemiology, distribution, surveillance and control[M]. Geneva: WHO, 1999: 11-14
[5]Chu MC. Laboratory manual of plague diagnostic tests[M]. Geneva: WHO, 2000.
[6]Yu DZ. Animal plague epidemiology[M]. Beijing: Science and Technology Press, 2009: 179-181. (in Chinese)
俞东征.鼠疫动物流行病学[M].北京:科教出版社,2009:179-181.

