制药废水中磷霉素和α-苯乙胺的生物降解及相互作用
谢晓琳,曾 萍,3*,宋永会,祝超伟,刘瑞霞,崔晓宇,肖书虎(.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 0002;2.中国环境科学研究院,城市水环境科技创新基地,北京 0002;3.清华大学,国家环境保护环境微生物利用与安全控制重点实验室,北京 00084)
制药废水中磷霉素和α-苯乙胺的生物降解及相互作用
谢晓琳1,2,曾 萍1,2,3*,宋永会1,2,祝超伟1,刘瑞霞1,2,崔晓宇1,2,肖书虎1,2(1.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;2.中国环境科学研究院,城市水环境科技创新基地,北京 100012;3.清华大学,国家环境保护环境微生物利用与安全控制重点实验室,北京 100084)
以比耗氧速率SOUR、呼吸抑制率和发光细菌光损失为衡量指标, 研究了在磷霉素、α-苯乙胺及其混合物作用下,活性污泥和发光细菌的可生化性和急性毒性的变化.结果表明, α-苯乙胺的急性毒性和对活性污泥的呼吸抑制率均大于磷霉素. α-苯乙胺与磷霉素混合液的可生化性和急性毒性两者在混合物中的比例有关,当α-苯乙胺所占比例低于25%时,混合液的可生化性基本不受两者比例的影响;但当α-苯乙胺所占比例高于25%时,混合液的可生化性随着α-苯乙胺所占比例的增加而降低.当混合液中α-苯乙胺所占比例为25%时,其急性毒性最低.
磷霉素;α-苯乙胺;比耗氧速率(SOUR);发光细菌;E C50
磷霉素是一种高效广谱抗生素,它主要作用于细菌的细胞壁,抑制细菌细胞壁的早期合成[1],对革兰阳性菌和阴性菌都有一定的抗菌作用,同时与多数抗菌药物具有协同作用[2-3],在临床上具有广泛的应用.磷霉素的工业生产主要采用化学环氧化工艺[4].该工艺一般以顺丙烯磷酸为底物,环氧化生成(±)顺-环氧丙基膦酸后,拆分得到磷霉素.在拆分过程中大量的拆分剂α-苯乙胺的使用,以及有限的拆分效率(约20%),导致磷霉素废水中含有大量的α-苯乙胺和一定量的磷霉素[5].
α-苯乙胺是一种芳香胺,在室温时是无色液体.它可以溶于水、乙醇和乙醚中,有鱼腥味.α-苯乙胺也是工业和医药上首选的化学拆分剂之一,主要用于制备手性农药、医药品等[6].当环境中苯乙胺浓度高时,对降解微生物有抑制作用[7].
目前磷霉素的毒性研究主要集中在临床医学上,探讨了磷霉素钠对几种菌株的体外活性抑制效果[8-11].研究表明磷霉素钠对甲氧西林葡萄球菌[8]的最低抑菌浓度为256mg/L, 对李斯特氏菌[9]的抑菌浓度范围为64~1024mg/L,对大肠埃希氏菌[12]的最低抑菌浓度为64mg/L.
由于磷霉素制药废水中磷霉素和α-苯乙胺对微生物的抑制性较强[13],目前该类废水的处理以物化方法为主[13-15].但在制药厂废水处理的实际运行中,为降低处理成本,将磷霉素制药废水与生活污水混合,采用水解酸化-接触氧化工艺处理,通过增加水力停留时间来保证出水达标,但磷霉素的降解率仍然不理想.因此在α-苯乙胺共存下的磷霉素制药生产废水的生物降解成为一个迫切需要解决的问题.
为了回答一种废水能否易于降解,通常对废水的可生化性和毒性进行评估.废水的可生化性包括有机底物被微生物利用的可能性以及其被利用的分解速度;废水的毒性指一定浓度的毒害物引起的生理功能紊乱、组织细胞病变,直至死亡的性能[16].确定处理废水的可生化性和毒害性,对于废水处理的工艺方法选和技术参数的选择有重要的实际意义.因此,本研究探讨了磷霉素和α-苯乙胺对活性污泥和发光细菌的抑制性及急性毒性的影响,同时研究了活性污泥和发光细菌在α-苯乙胺和磷霉素共同作用下的呼吸抑制性及急性毒性的变化,以期为提高磷霉素制药废水的去除率提供理论指导.
1 材料与方法
1.1 试剂和仪器
主要试剂∶磷霉素钠(东北制药集团股份有限公司,99%),3,5-二氯苯酚(阿法爱莎天津有限公司,99%),α-苯乙胺(阿法爱莎天津有限公司,98%),蛋白胨,牛肉膏,尿素, NaCl, CaCl2·H2O, MgSO4·7H2O, K2HPO4,浓H2SO4和NaOH等均为分析纯.
合成废水∶蛋白胨16g,牛肉膏11g,尿素3g, NaCl 0.7g, CaCl2· H2O 0.4g, MgSO4·7H2O 0.2g, K2HPO42.8g,定容至1L.
参比物质3,5-二氯苯酚溶液配制:用10mL的1mol/L NaOH溶解0.5g 3,5-二氯苯酚,用蒸馏水稀释到约30mL,边振荡边加入0.5mg/L H2SO4直到刚刚出现沉淀,最后用蒸馏水稀释到1L,pH值为7~8.
主要仪器:pH计(Starter 3C,奥豪斯公司,美国),分析天平(ML204102,METTLER TOLEDO,美国),溶解氧测定仪(YSI5000,YSI,美国),多头磁力加热搅拌器(Hj-16A,国华,中国),高速冷冻离心机(3K15,sigma,美国),超静音可调节式气泵(ACO-308,海利,中国),急性毒性检测仪(DeltaTOXⅡ,SDI,美国).
1.2 污泥来源
实验使用的好氧活性污泥取自北京市某污水处理厂曝气池,该城市污水处理厂每日处理污水20万t.污水厂进水为市区生活污水,其中的抗生素未被检出.活性污泥的MLSS为2.83g/L, MLVSS为2.27g/L,SVI为115,SOUR为44.39mg/(g·h).
1.3 试验方法
1.3.1 呼吸抑制实验 试验用污泥采用自来水清洗、离心、倒出上清液,重复操作3次.曝气过夜.用纯水稀释污泥,调节污泥浓度在4000mg/L左右.取200mL活性污泥放入1000mL烧杯中,加入16mL的合成污水和一定浓度梯度的抗生素,稀释至500mL,连续曝气3h,控制曝气量在1.0L/min.接触3h后取出污泥,测试污泥的比耗氧速率(SOUR).计算式如式(1)所示:

式中:ΔDO为溶解氧的减少量,mg/L;VSS为混合液的MLVSS, g/L; t为测试的时间,h.
引入半有效浓度(EC50)定量表征化合物对污泥活性的抑制程度大小[17],该指标表示在该浓度条件下,化合物对好氧污泥抑制率为50%.抑制率的计算式如(2)所示∶
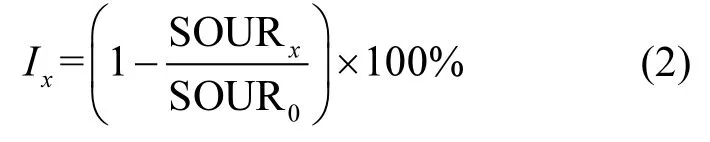
式中:Iχ为一定浓度化合物作用下的抑制率; SOURχ为一定浓度化合物作用下的比耗氧速率, mg/(g·h);SOUR0为空白条件下比耗氧速率.
实验数据用origin8.5处理,以Logistic方程进行拟合如式(3)所示∶
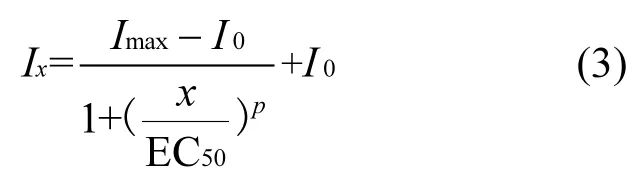
式中:Imax为最大抑制率,%;I0为空白抑制率,一般设置为0;p为该物质的潜在抑制能力常数;χ为该物质浓度,mg/L.
1.3.2 发光细菌急性毒性试验 发光菌急性毒性测试采用DeltaTOXⅡ(SDI)测定,选用B-TOX模式中的低毒性样本模式测试.测试系统包括一个高灵敏度的光度计、干冻的细菌试剂(费希尔弧菌)、稀释液和渗透压调节液.毒性物质作用于发光细菌时,抑制其活性,从而使其呼吸速率下降,进而导致发光强度降低.样品的毒性越强,发光细菌的光损失越多[18].光强的损失(受试菌的新陈代谢受到抑制)反映出样本的相对毒性.检测按照 DeltaTOXⅡ提供的急性毒性检测用户操作手册进行.光损失的计算见式(4):
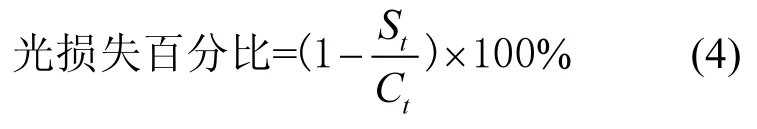
式中:Ct为空白在t时刻的光读数,t取5min;St和为测试样品在t时刻的光读数,t取5min.
1.4 检测对象

表1 磷霉素和α-苯乙胺混合溶液的比例及相应浓度Table 1 The ratio and concentration of fosfomycin and α-phenylethylamine mixfures
检测对象包括不同浓度的磷霉素、α-苯乙胺以及磷霉素和α-苯乙胺的混合液.其中磷霉素和α-苯乙胺混合液的COD为 300mg/L,磷霉素和α-苯乙胺分别以1:0; 3:1; 1:1; 1:3; 0:1的比例混合.开展呼吸抑制及毒性测试时的反应体系包括污泥、受试混合物和所需的微量元素.
1.5 测试方法
MLSS、MLVSS、SVI、SOUR均按照美国EPA的水和废水的标准测试方法进行[19],发光细菌急性毒性指标采用DeltaTOXⅡ急性毒性测试仪进行测试.每个样品测试3个平行样.
2 结果与讨论
2.1 以α-苯乙胺和磷霉素为基质的活性污泥的比耗氧速率变化
具有活性的污泥在降解基质和代谢的过程中需要消耗氧.SOUR能够表征单位质量污泥中活性污泥的耗氧状况,从微生物呼吸速率角度反映了活性污泥生理状态和基质代谢状况,与活性污泥行为相关性最好[20],可间接表征活性污泥的活性.在污水处理厂的运行中,当处理系统受到毒物冲击时,污泥的SOUR会下降,毒性越强,SOUR下降越剧烈,因此污泥SOUR的突然下降也常是最为灵敏的早期警报.污泥的SOUR值大小及其变化趋势可指示污水中有毒物质对污泥微生物的抑制效果[17].
根据前期试验,用于比好氧速率测试的磷霉素钠浓度为200,400,600,800,1000mg/L,α-苯乙胺浓度为20,40,60,80,100mg/L.参比物质3,5-二氯苯酚浓度设置为5,10,15mg/L.
分别以磷霉素和α-苯乙胺为基质测试活性污泥SOUR.由图1可知,SOUR随基质浓度的增加而降低,说明磷霉素和α-苯乙胺对污泥都有抑制作用.分别对磷霉素和α-苯乙胺SOUR变化曲线进行线性拟合,得到磷霉素SOUR拟合曲线y=43.84-0.015χ,α-苯乙胺的SOUR拟合曲线y=44.31-0.108χ.由拟合曲线可以看出α-苯乙胺SOUR的下降速率大于磷霉素,表明α-苯乙胺对活性污泥的抑制大于磷霉素.

图1 活性污泥SOUR在不同基质下的变化Fig.1 Change of SOUR affected by different substrates (a)fosfomycin, (b) α-phenylethylamineand (c) their mixtures
在保证混合溶液的COD恒定的前提下,逐渐增加磷霉素溶液中α-苯乙胺的比例,测试以磷霉素和α-苯乙胺混合液为基质的活性污泥的SOUR;根据混合液中磷霉素和α-苯乙胺的各自浓度分别代入磷霉素和α-苯乙胺的比耗氧速率变化曲线中计算得到混合液的SOUR,结果如图1(c)所示.从实测值的变化看,当α-苯乙胺在混合液中所占比例大于25%,SOUR随α-苯乙胺在混合液中所占比例的增加而下降;当α-苯乙胺在混合液中所占比例小于25%时,活性污泥的SOUR基本保持不变.但计算所得的不同比例下的两者混合溶液的SOUR值基本相同,这是由于混合液的COD浓度并没有改变,改变的只是磷霉素和α-苯乙胺的比例.比较实测值和理论值可以发现,当α-苯乙胺在混合液中所占比率为25%时,实测值同计算值都在80mg/(g·h)左右,但当混合液中α-苯乙胺所占比率大于25%并不断增加时,实测值同计算值的差距越来越大.由此可知当α-苯乙胺在混合液中比例增加到一定比例时,混合液对活性污泥的抑制增加,降低了混合溶液的可生化性.
2.2 磷霉素、α-苯乙胺及其混合物对活性污泥呼吸抑制率的影响
活性污泥的SOUR值可间接表征有毒物质对污泥微生物的抑制效果.为更直观表征有毒物质对污泥微生物的抑制效果,对SOUR随磷霉素、α-苯乙胺以及两者混合液浓度变化进行拟合,并计算得到EC50,如表2所示,拟合曲线如图2所示.

表2 磷霉素、α-苯乙胺、两者混合物和3,5-二氯苯酚对好氧污泥呼吸抑制率拟合曲线Table 2 Fitting curve of respiratory inhibiting rate on activated sludge affected by fosfomycin, α-phenylethylamine, their mixtures and 3,5-dichlorophenol
磷霉素和α-苯乙胺对活性污泥的抑制率都随基质浓度的增加而增加,说明二者对活性污泥都有抑制作用.为考察磷霉素和α-苯乙胺混合液对污泥的呼吸抑制率,在保持溶液的COD值不变的前提下,改变混合液中磷霉素和α-苯乙胺的比例.当α-苯乙胺占混合液的比例在25%以下时,其呼吸抑制率基本没有改变;但当α-苯乙胺占混合液的比例超过25%时,混合液对活性污泥的呼吸抑制作用随其比例的增高而加强.
EC50是反映基质急性毒性的指标,此值越大,毒性越低.经计算,磷霉素和α-苯乙胺的EC50值分别为537.03,68.14mg/L.根据环境保护部新化学物质危害评估导则(HJ/T154 2004)[21]生态毒理学危害性分级标准(表3),磷霉素和α-苯乙胺分别为低毒和中毒物质,赋值为0和1,均不属于高毒物质,急性毒性较低.分别以磷霉素和α-苯乙胺为变量计算混合物的EC50,混合物中磷霉素的EC50从537.02mg/L降低到110.15mg/L,虽然仍然为低毒物质,但毒性已经接近中性.混合物中α-苯乙胺的EC50从68.14mg/L降低到42.61mg/L,毒性改变不大,仍然在中毒的范围内,由此可知磷霉素对α-苯乙胺的影响较低.

图2 不同基质对活性污泥抑制率的拟合曲线Fig.2 Fitting curve of respiratory inhibition on activated sludge

表3 生态毒理学危害性分级Table 3 Ecotoxicology harmfulness classification
2.3 磷霉素、α-苯乙胺及其混合物对发光细菌的急性毒性
废水的毒性高低也是影响废水处理工艺选择的因素之一.目前用于水体毒性的综合评估的生物学方法主要是通过微生物、藻类、软体动物、鱼等来监测环境污染物对水生生物的毒性,但是由于其实验周期长,操作复杂等缺点不适用于常规监测[16].近年来,应用最为广泛的是以发光弧菌(Vibrio Fischeri)作为目标废水的指示生物的综合毒性评估方法.当发光细菌与基质接触后,其体内的荧光素酶催化荧光素的氧化作用而发光,通过一定条件下测定发光强弱的变化来指示该底物的生物毒性的强弱,样品毒性越强,发光细菌的光损失就越多[22-23].通过生物发光光强的测定即可计算得到样品毒性的强弱[24].该方法快速、简便,其灵敏度可与鱼类96h急性毒性试验相媲美[25].
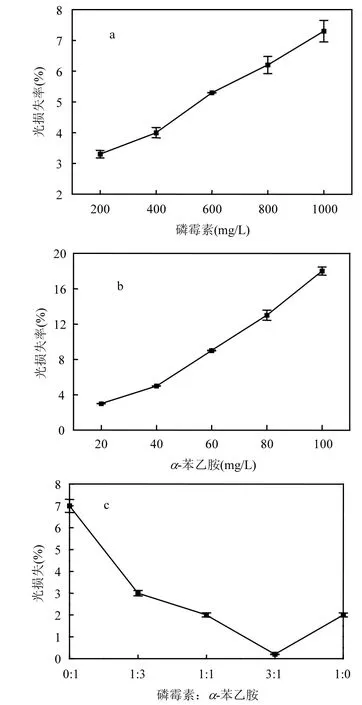
图3 磷霉素,α-苯乙胺,混合液作用下急性毒性的变化Fig.3 The changes of acute toxicity affected by fosfomycin, α-phenylethylamineand, their mixture
磷霉素和α-苯乙胺两种物质对发光细菌的毒性影响结果如图3所示.发光细菌的光损失百分率均随基质浓度的增加而提高,说明两种物质对发光细菌具有一定的急性毒性.
由表4可见磷霉素和α-苯乙胺对发光细菌的EC50分别为9568,253.6mg/L,说明磷霉素对发光菌有一定急性毒性,但毒性不显著,α-苯乙胺的毒性仍然大于磷霉素的毒性.同活性污泥SOUR法相比,发光细菌检测得到的值偏大,两种方法数值的差异可能来自两个方面的原因:一是由于受试微生物不同.活性污泥是由各种细菌构成的混合系统,发光细菌为单一菌种;二是由于暴露时间不同.活性污泥抑制试验中,基质的暴露接触时间为3h,而快速发光细菌法中,接触时间只有5min.磷霉素的毒性作用机理主要是作用于细菌细胞壁合成的第一步[26],在有限的时间内,处于细胞壁合成阶段的细菌数量有限,表现出的抑菌作用受限.与活性污泥抑制试验相比较,两者的结论均为α-苯乙胺的毒性大于磷霉素的毒性.因此发光细菌法作为一种快速的毒性检测方法,也能反映物质相对毒性的大小.
以100%的磷霉素溶液中逐渐增加α-苯乙胺比例来考察α-苯乙胺和磷霉素共存时急性毒性的变化.由图3(c)可知,当α-苯乙胺所占比例为25%时,磷霉素同α-苯乙胺的混合液的光损失率最低,即急性毒性最低.当α-苯乙胺所占比例低于25%时,随α-苯乙胺所占比例的增加,急性毒性降低;当α-苯乙胺所占比例高于25%时,随α-苯乙胺所占比例的增加,急性毒性增加.因此当α-苯乙胺在混合物中所占比例控制在25%时,α-苯乙胺和磷霉素混合物的急性毒性最低.
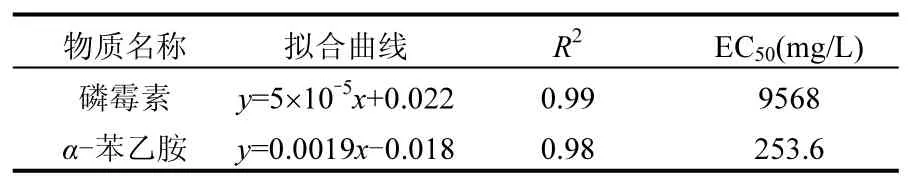
表4 磷霉素和α-苯乙胺对发光细菌抑制程度拟合曲线Table 4 Fitting curve of luminous bacteria inhibited by fosfomycin and α-phenylethylamine
综观整个实验,可以发现活性污泥呼吸抑制率和发光细菌检测的结果基本一致:α-苯乙胺的急性毒性高于磷霉素.对于磷霉素和α-苯乙胺的混合物,当α-苯乙胺在混合溶液中所占比例为25%,混合液的急性毒性最低.在磷霉素的实际废水处理中,为了提高废水的可生化性,一般采取磷霉素实际废水和生活污水混合的措施.如果按照本试验的结果使得混合后α-苯乙胺所占比例为25%,将更有利于磷霉素废水的降解.
3 结论
3.1 磷霉素和α-苯乙胺对活性污泥和发光细菌均有抑制作用,且α-苯乙胺的抑制作用大于磷霉素.
3.2 α-苯乙胺与磷霉素的混合液的可生化性同两者在混合物中的比例有关,当α-苯乙胺所占比例低于25%时,混合液的可生化性基本不受两者比例的影响;但当α-苯乙胺所占比例高于25%时,混合液的可生化性随着α-苯乙胺所占比例的增加而降低.当α-苯乙胺与磷霉素的混合液中α-苯乙胺所占比例为25%时,其急性毒性最低.
3.3 活性污泥呼吸抑制法和发光细菌法可用于评价受试基质的毒性.
[1] Popovic M, Steinort D, Pillai S, et al. Fosfomycin: an old, new friend? [J]. European Journal of Clinical Microbiology and Infectious Diseases, 2010,29,(2):127-142.
[2] Evren E, AzapÖ K, Çolakoğlu Ş, et al. In vitro activity of fosfomycin in combination with imipenem, meropenem, colistin and tigecycline against OXA 48-positive Klebsiella pneumoniae strains [J]. Diagnostic Microbiology and Infectious Disease, 2013, 76,(3):335-338.
[3] 佟金平,王镇山,薛 欣,等.磷霉素与14种抗菌药物分别联用的体外抗菌活性研究 [J]. 中国抗生素杂志, 2005,30,(4):233-237.
[4] Christensen B, Leanza W, Beattie T, et al. Phosphonomycin: structure and synthesis [J]. Science, 1969,166,(3901):123-125.
[5] 崔 娜.催化湿式氧化技术处理磷霉素钠制药废水研究 [D].大连:大连理工大学, 2011.
[6] 吴海霞,尹 琴,张 玲,等. α-苯乙胺的微波合成研究 [J]. 应用化工, 2006,(5):357-358.
[7] 乌锡康,有机化合物环境数据简表 [M]. 上海:华东理工大学出版社, 2009.
[8] 佟金平,王镇山,苗 姝,等.磷霉素对葡萄球菌生物被膜的抑制作用 [J]. 抗感染药学, 2009,6,(2):128-130.
[9] Lepe J A, Torres M J, Smani Y, et al. In vitro and intracellular activities of fosfomycin against clinical strains of Listeria monocytogenes [J]. International Journal of Antimicrobial Agents, 2014,43,(2):135-139.
[10] 徐志豪,刘富光,王选锭,等.红霉素、磷霉素对铜绿假单胞菌生物被膜体外作用的研究 [J]. 中华结核和呼吸杂志, 2001,24,(6): 342-344.
[11] 聂大平,马 荣,刘永娥.磷霉素对革兰阴性菌的体外抗菌活性研究 [J]. 大连医科大学学报, 2010,32,(5):577-579.
[12] 王艳萍,董 林,沈志强,等.磷霉素钠和硫酸阿米卡星体外联合抗大肠埃希菌试验 [J]. 动物医学进展, 2010,31,(5):121-123.
[13] 邱光磊,宋永会,曾 萍,等.湿式氧化-磷酸盐固定化组合工艺处理磷霉素制药废水及其资源化 [J]. 环境科学学报, 2011,31,(7): 1431-1439.
[14] 尹 莉,陈 丹.应用微电解法预处理磷霉素钠制药废水 [J].环境保护科学, 2010,36(3):47-49.
[15] 肖宏康,肖书虎,宋永会,等.高温强化电化学法处理磷霉素钠制药废水试验研究 [J]. 环境工程技术学报, 2011,1(2):106-110.
[16] 冯 斐.Fenton氧化耦合MBR工艺处理蒽醌染料废水的研究[D]. 上海:华东理工大学, 2010.
[17] 邵一如,高如泰,刘树庆,等.抗生素对好氧污泥氧摄取速率单独和联合抑制效果 [J]. 环境科学学报, 33:1186-1187.
[18] 郁建桥,钟 声,徐 亮.DeltaTox®毒性仪简介及其在环境污染事件中的应用 [J]. 生命科学仪器, 2009,(7):48-50.
[19] APHA. The standard methods for the examination of water and wastewater (20th ed.) [S]. Washington, DC, USA: American Public Health Association, 1998.
[20] 卢培利,张代钧,张 欣,等.混合呼吸仪评估pH值和重金属对污泥活性的抑制 [J]. 中国环境科学, 2008,28(5):422-426.
[21] HJ/T 154-2004 新化学物质危害评估导则 [S].
[22] 赵红宁,王学江,夏四清.水生生态毒理学方法在废水毒性评价中的应用 [J]. 净水技术, 2008,(5):18-24.
[23] 杜丽娜,袁杨帆,穆玉峰,等.某制药废水对发光细菌急性毒性的评价研究 [J]. 环境科学, 2014,35(1):286-291.
[24] 张俊强,魏建军,张 杨,等.Microtox○R毒性检测系统与给水水质预警 [J]. 中国给水排水, 2007,8:16.
[25] 杜晓丽,徐祖信,王 晟,等.发光细菌法应用于环境样品毒性测试的研究进展 [J]. 工业用水与废水, 2008,39,(2):13-16.
[26] Raz R. Fosfomycin: an old-new antibiotic [J]. Clinical Microbiology and Infection, 2012,18,(1):4-7.
Biodegradation and interactions of fosfomycin and α-phenylethylamine in pharmaceutical wastewater.
XIE Xiao-lin1,2, ZENG Ping1,2,3*, SONG Yong-hui1,2, ZHU Chao-wei1, LIU Rui-xia1,2, CUI Xiao-yu1,2, XIAO Shu-hu1,2(1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.Department of Urban Water Environmental Research, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;3.State Environmental Protection Key Laboratory of Microorganism Application and Risk Control (MARC), Tsinghua University, Beijing 100084, China). China Environmental Science, 2014,34(11):2824~2830
Specific oxygen uptake rate (SOUR), respiratory inhibitory rate of activated sludge and light loss from luminous bacteria were used as indicators, biodegradability and acute toxicity of fosfomycin, α-phenylethylamine as well as their mixtures were investigated. The results showed that the acute toxicity and respiratory inhibitory rate of α-phenylethylamine were higher than those of fosfomycin. The biodegradability and acute toxicity of their mixtures highly depended on the ratios of α-phenylethylamine. For instance, biodegradability of the mixtures didn’t change when the ratio of α-phenylethylamine was lower than 25%. However, biodegradability of the mixtures decreased while the ratio of α-phenylethylamine exceeded 25%. The acute toxicity of the mixture was the lowest when the ratio of α-phenylethylamine was 25%.
fosfomycin;α-phenylethylamine;specific oxygen uptake rate (SOUR);luminous bacteria;EC50
X703.5
A
1000-6923(2014)11-2824-07
谢晓琳(1986-),女,山东潍坊人,中国环境科学研究院硕士研究生,研究方向为水污染控制.
2014-02-20
国家水体污染控制与治理科技重大专项(2012ZX07202-002);国家环境保护环境微生物利用与安全控制重点实验室开放基金资助(MARC 2012D008)
* 责任作者, 研究员, zengping71@hotmail.com

