对硝基苯甲异羟肟酸-过渡金属配合物催化双氧水降解甲基橙
邓 强,徐敬芳,顾雪凡,张智芳
(1.西安石油大学化学化工学院,陕西 西安 710065;2.榆林学院化学化工学院,陕西 榆林 719000)
对硝基苯甲异羟肟酸-过渡金属配合物催化双氧水降解甲基橙
邓 强1,徐敬芳1,顾雪凡1,张智芳1
(1.西安石油大学化学化工学院,陕西 西安 710065;2.榆林学院化学化工学院,陕西 榆林 719000)
采用对硝基苯甲异羟肟酸为配体,与Co(Ⅱ)、Cu(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)、Fe(Ⅲ)氯化物配位制备了系列配合物。通过红外光谱法(IR)和循环伏安法对合成的配合物进行了分析,推断了配合物可能的结构,并将其用作催化剂催化双氧水氧化降解甲基橙,考察这些金属配合物的催化氧化性能和影响条件。
对硝基苯甲异羟肟酸;过渡金属配合物;氧化降解
异羟肟酸也称氧肟酸,作为一类重要的金属螯合剂能与多种过渡金属离子等形成稳定的金属螯合物,主要在氧化矿浮选中用作捕收剂[1-2]。它在酶抑制剂、铁载体蛋白、金属核酸酶、核燃料处理、土壤促进剂、DNA切割、抗癌药物、药物传输体系等方面有着广泛的应用,该领域的研究发展迅速且受到了越来越多的重视。而异羟肟酸过渡金属配合物作为仿单加氧酶模型,具有合成简便、结构易修饰和较强的仿酶功能等优点[3-6]。邓强等[7]报道了一系列简单异羟肟酸过渡金属配合物的催化双氧水氧化降解甲基橙的研究;孙斌等[8]报道了异羟肟酸过渡金属配合物催化空气氧化对氯甲苯的性能;李鸿波等[9]报道了聚醚桥连的对、间和邻位异构体二异羟肟酸Co(Ⅱ)配合物催化氧化对二甲苯的性能。
本文采用对硝基苯甲异羟肟酸为配体制备了异羟肟酸-过渡金属配合物,通过红外光谱法、循环伏安法对制备出的配合物进行结构和性质表征,并将其用作催化剂,催化H2O2氧化降解有机污染物的代表物甲基橙,考察这些金属配合物的催化氧化性能。
1 实验部分
1.1 试剂与仪器
所用试剂均为分析纯试剂,使用前未经进一步纯化。
CHI760D电化学工作站,DU-7500型紫外可见分光光度计。
1.2 配合物的合成
取2mmol配体(对硝基苯甲异羟肟酸)溶于15 mL乙醇中,搅拌下将与配体物质的量比为1∶2的过渡金属氯化物缓慢加到上述溶液中,60℃保温反应1h,过滤至样品瓶中,室温放置让其自然挥发,约7d后得粉末或晶体,再经乙醇重结晶即得配合物。反应如图1所示,Co(Ⅱ)、Cu(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)、Fe(Ⅲ)配合物标记为配合物1~5。

图1 对硝基苯甲异羟肟酸与过渡金属离子的配位反应
1.3 配合物电学性质研究
所有电化学实验均在CHI760D电化学工作站上进行,对电极为铂电极,参比电极为饱和甘汞电极。
1.4 配合物催化H2O2氧化降解甲基橙实验
取 25mg·L-1甲基橙溶液50mL加入100mL烧杯中,加入一定量的H2O2和一定量的催化剂,加适量水稀释至60mL恒温下不断搅拌,每隔10min测定一次溶液的吸光度。分别考察反应时间、双氧水用量、催化剂用量、反应温度等条件对配合物催化双氧水氧化降解甲基橙的影响,按照下式计算脱色率。

式中:A0-甲基橙未反应时的吸光度;A-甲基橙进行反应后的吸光度。
2 结果与讨论
2.1 配合物的结构表征
通过红外光谱对配体和配合物进行了表征,其主要的吸收峰值如表1所示。配体(对硝基苯甲异羟肟酸,L1)在3113.6cm-1处宽而强的吸收峰为N-H和O-H的振动吸收,1693.9cm-1处为C=O振动吸收,1602.9cm-1为苯环上的C=C振动吸收,1525.3cm-1、1346.7cm-1处为硝基的振动吸收。形成配合物之后在以上3处的振动吸收峰值都发生了一定的变化。例如,在配合物1中3115.2 cm-1处宽而强的吸收峰为N-H和O-H的振动吸收,1693.5 cm-1处为C=O振动吸收,1606.1为苯环上的C=C振动吸收,1541.3 cm-1、1351.0 cm-1处为硝基的振动吸收。在配合物2和4中,1600cm-1~1700cm-1处的吸收峰发生了显著位移,都在1692 cm-1左右,这与C=O键的特征吸收差距较大,而体现出了C=N键的特征吸收,这说明在配合物中配体可能受到金属离子的诱导作用发生了异构化。
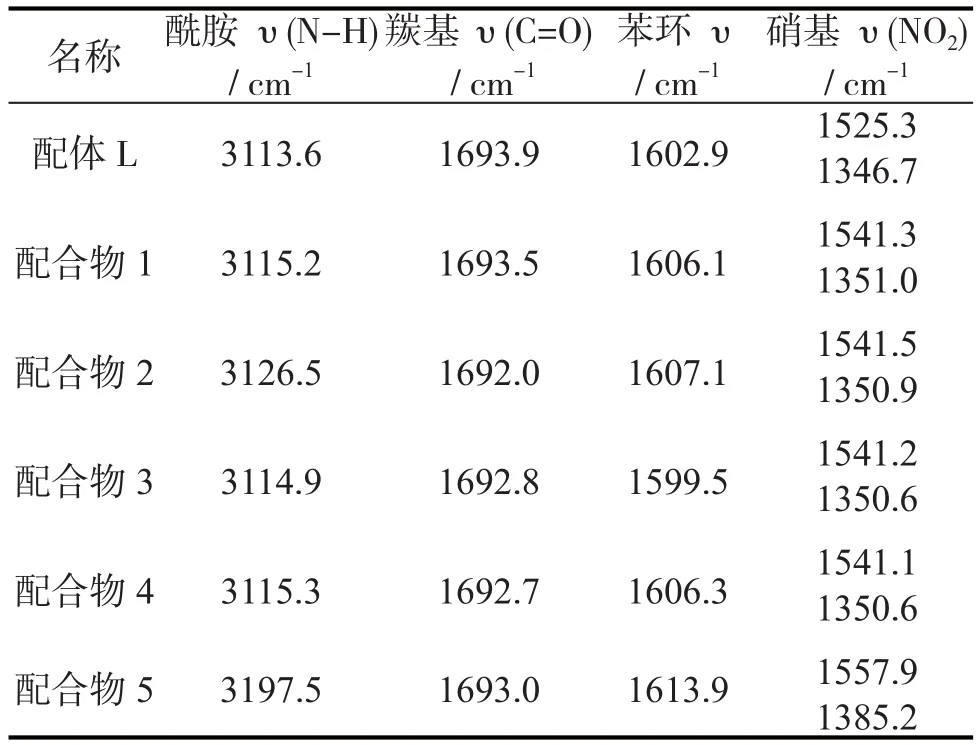
表1 配体及其它的配合物主要官能团数据
由于Mn2+、Fe3+离子属于典型的亲氧离子,极易与氧原子发生配位,在Mn2+、Fe3+离子的诱导作用下羟肟酸重排为异羟肟酸(图2),而这种结构可以解释配合物3呈现类似于Fe3+离子与邻苯二酚配位后会显红棕色的实验现象。
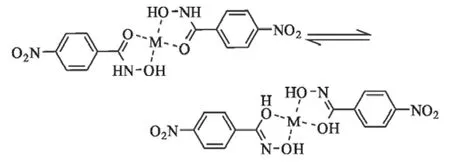
图2 配合物中配体的异构化
2.2 配合物氧化还原性
利用电化学分析方法——循环伏 安法,对以对硝基苯甲异羟肟酸为配体合成的金属配合物进行氧化还原性分析,结果如图3~7所示。根据其峰电位及峰电流可知,对硝基苯甲异羟肟酸-过渡金属配合物的氧化还原性差异较大,其中配合物2~4具有明显的氧化还原性,而配合物1和配合物5的氧化还原性则相对较弱。
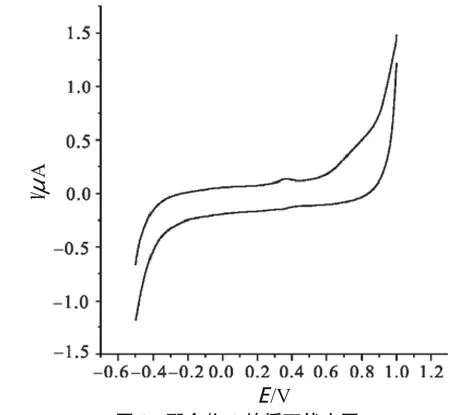
图3 配合物1的循环伏安图
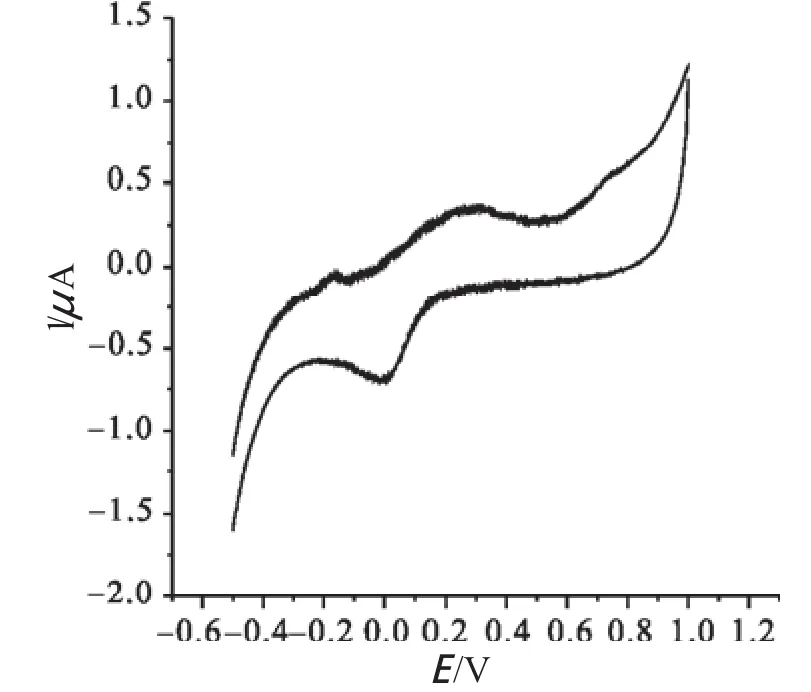
图4 配合物2的循环伏安图
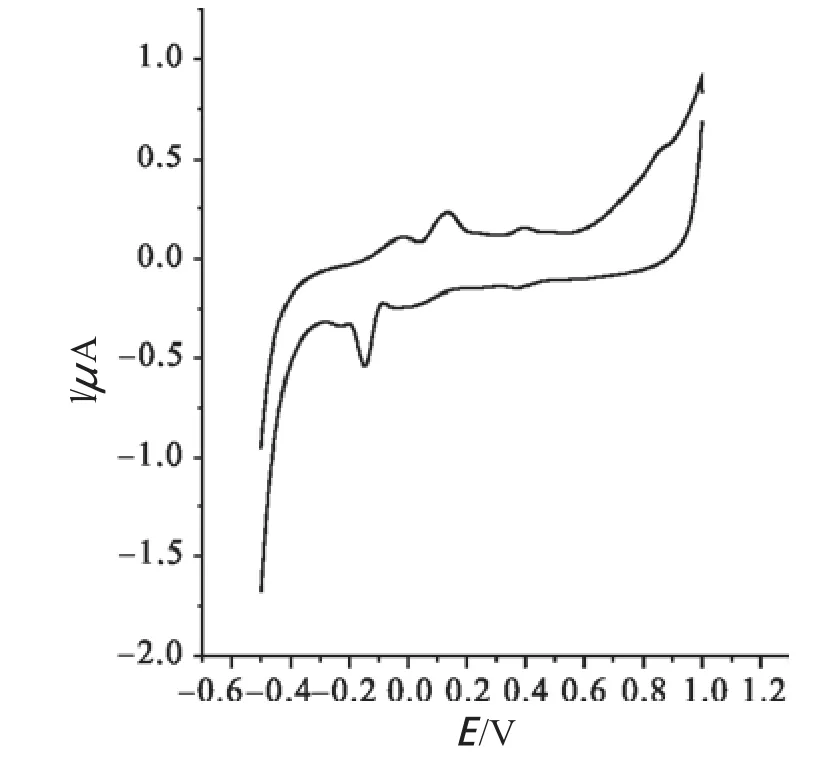
图5 配合物3的循环伏安图

图6 配合物4的循环伏安图

图7 配合物5的循环伏安图
2.3 配合物催化H2O2氧化降解甲基橙
室温下,加入4mL 2mmol·L-1H2O2和甲基橙物质的量的10%的催化剂(2、3、5),稀释至60mL,不断搅拌下每隔10min测定一次甲基橙的吸光度,直至其数值稳定不变,结果如表2所示。由表2可见,H2O2用量为12 mL较为合适,配合物3的催化活性略高于前两者,脱色率最高达71.4%。

表2 H2O2用量对脱色率的影响
室温下,取50mL 25mg·L-1甲基橙溶液于100 mL烧杯中,加入12mL 2mmol·L-1H2O2和一定量催化剂,稀释至60mL,反应60 min后测定甲基橙的吸光度,结果如表3所示。由表3可见,催化剂用量为5.0%时反应基本达到平衡,继续增加用量脱色率增加不显著,因此催化剂的用量确定为5.0%。

表3 催化剂用量对甲基橙降解效果的影响
不同温度下,取50mL 25mg·L-1甲基橙溶液于100 mL烧杯中,加入12mL 2mmol·L-1H2O2和甲基橙物质的量5.0%的催化剂,稀释至60mL,反应60 min后测定甲基橙的吸光度,结果如表4所示。由表4可见,温度对该反应有一定的影响,但并不显著,考虑到实际应用的条件,选择反应温度为室温。
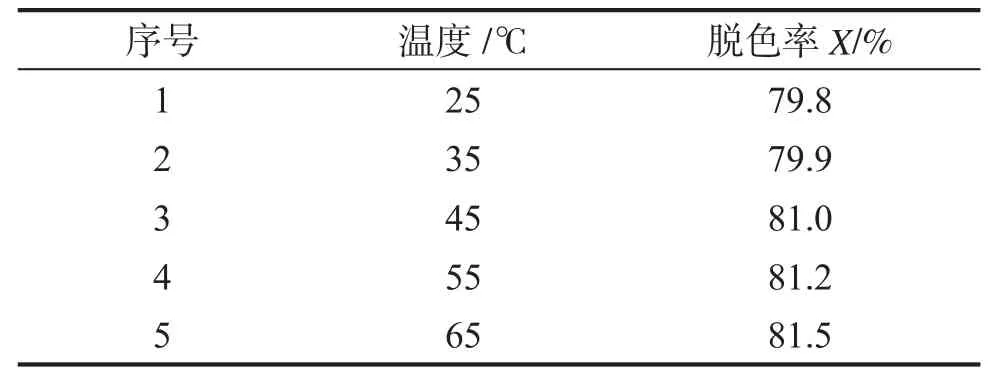
表4 温度甲基橙降解效果的影响
3 结论
(1) 以对硝基苯甲异羟肟酸为配体,与Co(Ⅱ)、Cu(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)、Fe(Ⅲ)氯化物配位制备了系列配合物,通过红外光谱法和循环伏安法对合成的配合物进行表征,推断了配合物可能的结构。
(2) 该系列配合物可以催化H2O2氧化降解甲基橙,其中对硝基苯甲异羟肟酸Fe(Ⅲ)配合物的催化活性最高,脱色率可达到81.5%。
(3) 该系列配合物催化H2O2氧化降解甲基橙的较优条件为:室温、催化剂用量为甲基橙物质量的5.0%、H2O2用量为12mL、反应为60min。
[1] 曾伟,曾贵玉,秦圣英.异羟肟酸的合成与应用研究新进展[J].有机化学,2003, 23(11):1213-1218.
[2] Hashimoto S, Nakumura Y, Nuclease Activity of a hydroxamic acid derivative in the presence of various metal ions[J]. Chem. Soc. Chem. Commun., 1995:1413-1414.
[3] Yang H, Qin S Y, Lu X X. Dioxygen affinities and catalyticepoxidation performance of transition-metal hydroxamates[J]. Chin Chem Lett., 1999(10): 845-848.
[4] Zhang C C, Zeng W, Li J Z., et al. Dioxygen affinities and catalytic oxidation performance of cobalt(Ⅱ )complexes with N-aryl hydroxamic acid[J]. Chin Chem Lett., 2003(14): 627-630.
[5] Rybak-Akimova E V, Otto W, Deardorf P, et al. Kinetics and equilibria of dioxygen binding to a vacant site in cobalt(Ⅱ ) complexes with pentadentate ligands[J]. Inorg Chem., 1997, 36(13): 2746-2753.
[6] 吕志凤,李鸿波,秦圣英.异羟肟酸过渡金属配合物的全合成和催化氧化性能研究[J].现代化工,2000,20(5): 32-35.
[7] 邓强,徐敬芳.苯甲羟肟酸配合物催化降解甲基橙[J].石油化工应用,2011,30(1):5-7.
[8] 孙斌,秦圣英.异羟肟酸过渡金属配合物对对氯甲苯催化氧化性能的研究[J].化学研究与应用,2011,23(1):92-95.
[9] 李鸿波,杜瑛,秦圣英,等.聚醚桥连二异羟肟酸及其钴(Ⅱ)配合物的合成和氧化性能研究[J].化学学报,2002,60(5):886-891.
Catalysis for Oxidation Degeneration of Methyl Orange by p-Nitro-benzyl Hydroxamic Acid-Transition Metal Complexes
DENG Qiang1, XU Jing-fang1, GU Xue-fan1, ZHANG Zhi-fang2
(1. College of Chemistry and Chemical Engineering, Xi’an Shiyou University, Xi’an 710065, China; 2. School of Chemistry and Chemical Engineering, Yulin University, Yulin 719000, China)
Co(Ⅱ), Cu(Ⅱ), Mn(Ⅱ), Ni(Ⅱ) and Fe(Ⅲ) complexes were prepared using p-nitro-benzyl hydroxamic acid as ligand. These complexes were characterized by IR and CV, and the possible structures were discussed. These complexes were used as catalyst in the oxidation degeneration reactions of H2O2and methyl orange, and the reaction conditions were studied.
p-nitro-benzyl hydroxamic acid; complexes; oxidation degeneration
O 643.36
A
1671-9905(2014)05-0010-04
陕西省科技厅项目(2012JZ2003);陕西省教育厅专项科研计划项目(2013JK0649);榆林市科技局项目(2011kjzx08)
邓强(1965-),男,副教授,研究方向为油田应用化学。E-mail:deng63@126.com,电话:029-88382693
2014-02-27

