多沙普仑在中国五民族健康受试者的药代动力学
郭 涛,赵龙山,程 佳,,夏东亚,曾 平,肖 勇,赵东祥,李 强,白 音,杨长青
(1.沈阳军区总医院药剂科,辽宁 沈阳 110016;2.沈阳药科大学药学院,辽宁 沈阳 110016;3.兰州军区乌鲁木齐总医院药剂科,新疆乌鲁木齐 830000;4.解放军第五医院药剂科,宁夏 银川 750004;5.解放军第313医院赤峰临床部,内蒙古赤峰 024006;6.赤峰学院医学部,内蒙古赤峰 024000;7.延边大学医学院,吉林延吉 133002)
多沙普仑(doxapram)为非特异性呼吸兴奋药,主要通过直接兴奋延髓呼吸中枢、外周化学感受器及加强膈肌活动,使患者潮气量增加,呼吸频率变快,有效拮抗全麻后阿片类药物引起的呼吸抑制。本品系临床必备急救药,常用于全麻术后催醒和呼吸衰竭抢救[1-2]。目前,除本课题组前期报道外[3-4],尚未见到国内有关本品在中国多民族人体药代动力学研究的报道。中国是一个多民族国家,各民族生活环境、饮食习惯以及遗传因素的不同,可能会导致同一药物在不同民族受试者体内的药动学过程出现差异。本文以汉族、蒙古族、朝鲜族、维吾尔族和回族健康受试者为研究对象,采用高效液相色谱法测定多沙普仑的血浆浓度,研究并比较多沙普仑在不同民族健康受试者体内的药动学,为战、创伤及平时临床合理用药提供依据。
1 材料与方法
1.1 仪器 高效液相色谱仪,包括Waters 600型四元泵、Waters 2487型紫外检测器(美国 Waters公司);N-2000色谱工作站(浙江大学智达信息工程有限公司);KQ3200DE型超声波清洗器(昆明市超声仪器有限公司);TGL型离心机(上海安亭科学仪器厂);YKH-2型液体快速混合器(江西医疗器械厂);AEL-160电子分析天平(日本岛津制作所)。
1.2 药品与试剂 多沙普仑对照品(含量:98.5%,批号:0068-9701,中国药品生物制品检定所);内标:非那西丁对照品(含量:99%,中国药品生物制品检定所);盐酸多沙普仑注射液(规格:0.1 g/5 ml,批号:20090103,江苏恩华药业股份有限公司);甲醇、乙腈为色谱纯,其他试剂均为分析纯。空白人血浆(沈阳军区总医院输血科提供)。
1.3 受试者选择 选择汉族、蒙古族、朝鲜族、维吾尔族和回族健康受试者50名(每个民族10人,男女各半),其父母、祖父母、外祖父母3代均为同族婚配。所有受试者试验前均进行体检和血液生化检查,检查结果显示受试者心、肝、肾功能未见异常,无过敏史,家族无精神病史,试验前两周内未服用任何其他药物,试验期间禁烟、酒及含咖啡饮料等。受试者试验前签署书面知情同意书。受试者的基本情况见Tab 1。
1.4 给药方案及药品采集 试验方案经沈阳军区总医院医学伦理委员会批准。采用单剂量静脉滴注给药。受试者试验前1 d进食清淡晚餐后禁食12 h,试验当日清晨,将50 mg盐酸多沙普仑注射液注入到100 ml 0.9%氯化钠溶液中后开始滴注,恒速滴注时间为30 min,给药后受试者避免剧烈活动;4、10 h进食统一标准餐。
受试者于给药前0 h、静脉滴注给药后15、30、35、45 min,1、1.5、2.5、3.5、4.5、6.5、8.5、12.5 h分别取前臂静脉血4.0 ml,置于肝素抗凝管中,离心取上清血浆,-20℃冻存,待测。
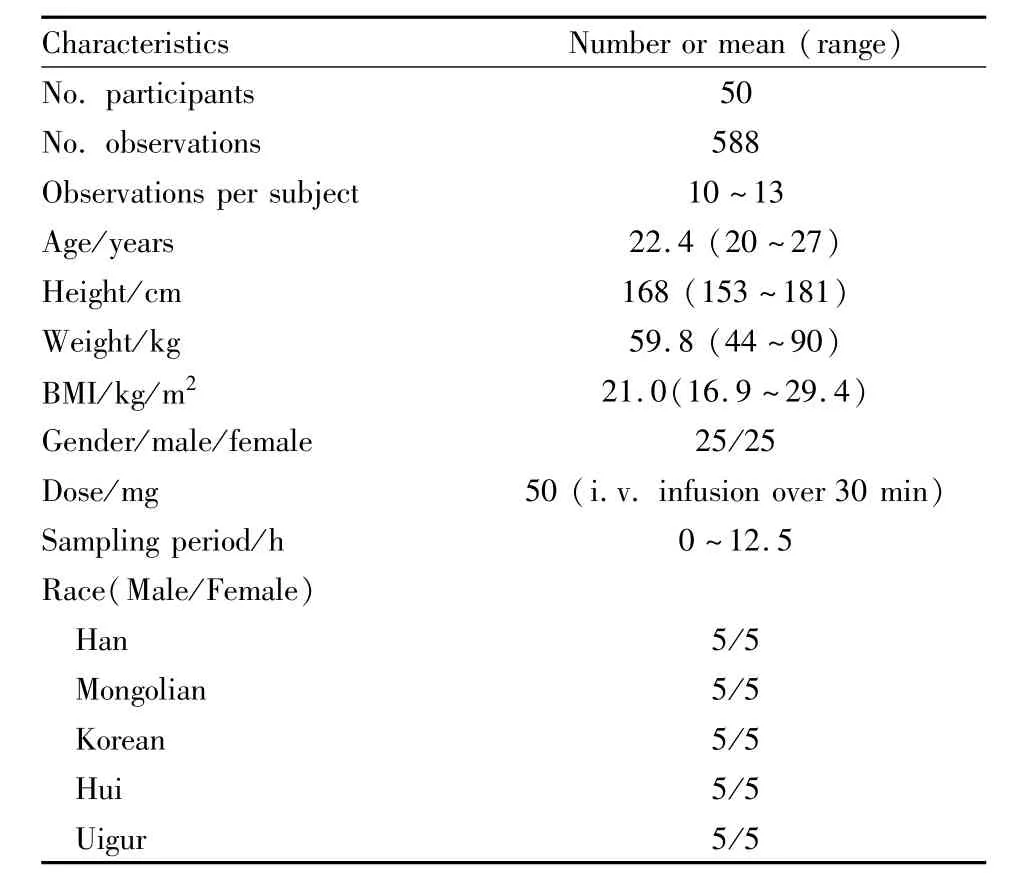
Tab 1 Demographic background of subjects for modeling
1.5 测定条件 色谱条件 色谱柱:Diamonsil C18(200 mm×4.6 mm,5μm);流动相:甲醇 -乙腈 -0.01 mol·L-1磷酸二氢铵缓冲液 (pH 4.5)-(30∶14∶56);流速:1.3 ml·min-1;柱温:室温;紫外检测波长:214 nm;进样量:20μl。
1.6 样品测定
1.6.1 对照品与内标溶液的配制 精密称取多沙普仑对照品10.00 mg,置于10 ml量瓶中,加水溶解稀释至刻度,使成1 mg·L-1的对照品溶液,-4℃保存备用。另精密称取非那西汀对照品10.00 mg,置于10 ml量瓶中,加水溶解稀释至刻度,使成1 mg·L-1的内标储备液,用时取储备液1 ml,置于100 ml量瓶中,加水稀释至刻度,制成10 mg·L-1的内标工作溶液,-4℃保存备用。
1.6.2 血浆样品预处理 取血浆0.5 ml,置于具塞玻璃试管中,加水50μl,然后加入 10 mg·L-1的非那西汀50μl,涡旋30 s,加入 pH 9.0缓冲液500 μl,然后加入 3 ml乙酸乙酯,涡旋 1 min,4 000 r·min-1离心10 min。将上清液转移至另一试管,于40℃氮气流吹干,加入100μl流动相复溶,20μl进样。
1.6.3 质控样品 每批血浆样品测定时均建立新的标准曲线,同时,随行多沙普仑浓度分别为0.1、0.5和4.0 mg·L-1的低、中、高3个浓度的质控样品,并均匀分布在未知样品的测试序列中,以判断每批样品测定结果的可靠性。本法测定结果RE均<15%,符合生物样品测定要求。
1.7 数据处理与统计学分析 采用DAS2.0药动学软件对血药浓度-时间数据进行拟合,根据AIC值确定药动学模型进行参数计算。受试者的Cmax、Tmax以实测值求得,AUC以梯形法计算。采用SPSS 13.0软件进行统计学处理。首先,对各民族受试者的主要药动学参数进行正态分布和方差齐性检验,然后,对符合正态分布和方差齐性的参数进行ANOVA检验,再采用S-N-K法对存在民族差异的参数进行检验,进一步确定差异存在于哪些民族之间。
2 结果
2.1 方法学评价
2.1.1 专属性 在上述色谱条件下,空白血浆、空白血浆加多沙普仑对照品及内标、受试者用药后血浆样品的色谱图见Fig 1。由图可见,内标非那西丁与多沙普仑的保留时间分别为7.4 min和13.6 min,两者分离良好,血浆中内源性杂质不干扰样品的测定。

Fig 1 HPLC chromatograms of doxapramA:Blank plasma;B:Blank plasma spiked with doxapramand internal standard;C:Han volunteer plasma sample;D:Mengolia volunteer plasma sample;E:Korean volunteer plasma sample;F:Hui volunteer plasma sample;G:Uigur volunteer plasma sample.1:IS;2:doxapram
2.1.2 标准曲线 在空白血浆中加入不同量的多沙普仑对照品溶液,配制成多沙普仑浓度分别为0.05、0.1、0.2、0.5、1.0、2.0、5.0 mg· L-1的血浆样品,按上述血浆样品处理方法处理后进样分析。以多沙普仑浓度C为横坐标,多沙普仑与内标的峰面积比Y为纵坐标,选择权重为1/c2,用加权最小二乘法进行回归,得回归方程为:^Y=1.264 C-0.003,r=0.999。定量下限为0.05 mg·L-1(n=6,RSD<10%)。
2.1.3 回收率与精密度 在空白血浆中加入多沙普仑对照品溶液适量,配制成浓度分别为0.1、0.5和4.0 mg·L-1的低、中、高3种浓度的血浆质控样品各5份,按血浆样品处理方法处理后进样分析,计算测得量与加入量的比值,求得方法回收率。另将测得的血浆质控样品的峰面积与多沙普仑对照品溶液用流动相稀释后直接进样测得的峰面积比较,计算提取回收率。同法配制0.1、0.5和4.0 mg·L-1的低、中、高3个浓度的血浆质控样品,按血浆样品处理方法处理后进样分析,测定日内精密度和日间精密度,结果见Tab 2。
Tab 2 Recovery and precision of doxapram(±s,n=5)

Tab 2 Recovery and precision of doxapram(±s,n=5)
Concentration/mg· L-1 Relative recovery/%Absolute recovery/%Within-day RSD/%Between-day RSD/%0.1 110.7±7.2 64.0±3.5 6.49 8.69 0.5 100.0±3.7 60.6±6.5 3.73 13.40 4.0 111.3±2.9 60.7±1.1 2.64 6.50
2.1.4 样品稳定性试验 配制多沙普仑浓度分别为0.1、0.5和4.0 mg· L-1的质控血浆样品,分别在室温放置8 h,-25℃冻融3次;-25℃冰冻存放30 d,进行样品稳定性考察。结果3个浓度血浆样品的多沙普仑浓度偏移均小于±5%,测定RSD均小于10.3%。
2.2 血药浓度-时间曲线 50名健康受试者静脉滴注多沙普仑50 mg后的平均药-时曲线见Fig 2。由Fig 2可见,静脉滴注给药期间,多沙普仑血药浓度逐渐升高,停滴后,多沙普仑血药浓度有一较快下降的过程,而后消除减慢,经模型确定符合静脉滴注二室模型。

Fig 2 Mean plasma concentration-time curve of doxapram in healthy subjects of five ethnic groups after intravenous infusion of 50 mg doxapram(±s,n=10)
Tab 3 The pharmacokinetic parameters of doxapram in healthy subjects±s,n=10)

Tab 3 The pharmacokinetic parameters of doxapram in healthy subjects±s,n=10)
Parameter Han Mongolian Korean Hui Uigur T1/2α/h 0.33±0.24 0.51±0.39 0.39±0.27 0.39±0.27 0.49±0.42 T1/2β/h 3.87±2.17 4.30±3.20 4.06±3.06 3.91±2.05 3.65±2.07 V c/L·kg-1 0.35±0.20 0.60±0.35 0.34±0.15 0.42±0.11 0.79±0.53 V d/L·kg-1 1.35±0.96 1.80±0.85 1.53±1.19 1.34±0.45 1.81±0.99 CL/L·h-1·kg-1 0.25±0.11 0.33±0.11 0.27±0.07 0.26±0.06 0.39±0.25 AUC0-12.5/mg·h·L-1 3.51±1.26 2.47±0.80 2.64±0.46 3.02±0.56 2.32±0.70 AUC0-∞/mg·h·L-1 4.06±1.44 2.89±1.06 3.01±0.63 3.49±0.73 2.68±0.80 C max/mg·L-1 1.55±0.52 1.02±0.30 1.31±0.47 1.48±0.46 0.99±0.35
2.3 药代动力学参数 五个民族健康受试者静脉滴注多沙普仑50 mg后的主要药动学参数见Tab 3,不同性别间药动学参数见Tab 4。
Tab 4 Comparison of pharmacokinetic parameters between male and female subjects(±s,n=5)
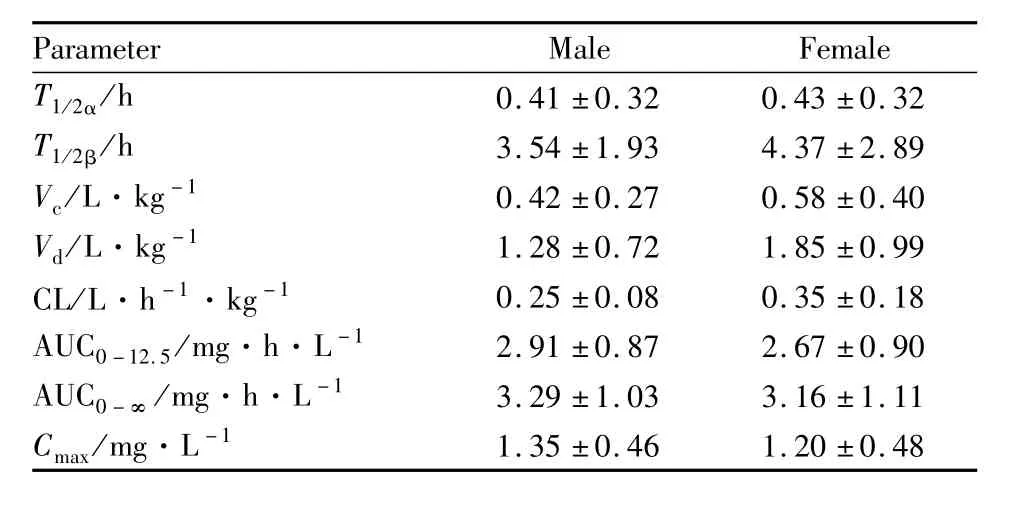
Tab 4 Comparison of pharmacokinetic parameters between male and female subjects(±s,n=5)
Parameter Male Female T1/2α/h 0.41±0.32 0.43±0.32 T1/2β/h 3.54±1.93 4.37±2.89 V c/L·kg-1 0.42±0.27 0.58±0.40 V d/L·kg-1 1.28±0.72 1.85±0.99 CL/L·h-1·kg-1 0.25±0.08 0.35±0.18 AUC0-12.5/mg·h·L-1 2.91±0.87 2.67±0.90 AUC0-∞ /mg·h·L-1 3.29±1.03 3.16±1.11 C max/mg·L-11.35±0.46 1.20±0.48
2.4 安全性评价 50名受试者在静脉滴注盐酸多沙普仑注射液过程中,多数人主诉身体发热,滴注结束后缓解。
3 讨论
本研究建立的高效液相色谱法对多沙普仑、内标与血浆中内源性物质可得到较好的分离效果及合适的保留时间。简便、快速,同时,方法学确证指标符合临床药代动力学研究的要求。每批血浆样品测定时均建立新的标准曲线,同时,随行多沙普仑浓度分别为 0.1、0.5、4.0 mg· L-1的低、中、高3个浓度的双质控样品,并均匀分布在未知样品的测试顺序中,测定结果均符合生物样品测定的要求。
多沙普仑的药动学研究,除本课题组的报道外,国内未见其它文献报道。本研究结果表明,多沙普仑在中国五民族人群的药动学过程符合二室模型,与文献报道的接近[5]。其代谢产物为活性的多沙普仑酮,因无对照品,故未对其药动学过程进行研究。
多沙普仑在健康人体内药动学过程五民族间差异不一[6-7],数据经 SPSS 13.0软件进行统计学分析,显示汉族受试者的 AUC0-12.5、AUC0-∞和 Cmax明显高于维吾尔族和蒙古族(P<0.05),其他药动学参数五民族间差异无统计学意义(P>0.05)。其原因可能是维吾尔族和蒙古族肝脏药物代谢酶不同所致,提示临床应用本品时应予以注意。
性别差异可能会影响药物在体内的吸收、分布、代谢和排泄[8],为此,我们按性别分组,采用 SPSS 13.0软件进行统计学分析,经体重校正后,比较了多沙普仑的药动学参数。结果表明,男性与女性的Vc、Vd和CL差异有统计学意义(P<0.05)。文献报道[9],多沙普仑的快速消除是由于多沙普仑快速从血浆中分布到其他组织中,如大脑、骨骼肌和脂肪等;另外,多沙普仑的表观分布容积大于人总体液容积0.6 L·kg-1,也说明多沙普仑分布到除体液外的组织中。男女受试者生理结构有一定的区别,一般来说,女性受试者的脂肪相对较多,这可能是造成女性受试者的表观分布容积较大的原因。文献报道[10-11],药物代谢存在性别差异的原因有很多,生理因素包括体质量、组织大小、肾小球滤过率和肠动力等;分子水平包括药物代谢酶等。另有文献报道[12],药物代谢方面的性别差异与雌激素有关。
参考文献:
[1] Sandhu M S,Lee K Z,Gonzalez-Rothi EJ,et al.Repeated intravenous doxapram induces phrenic motor facilitation[J].Exp Neurol,2013,250:108-15.
[2] 陈新谦,金有豫,汤 光.新编药物学(第16版)[M].北京:人民卫生出版社,2007:166.
[2] Chen X Q,Jin Y Y,Tang G.New edition of pharmacology[M].16th ed.Beijing:People′s Medical Publishing House,2007:166.
[3] 程 佳,夏东亚,郭 涛.HPLC法测定人血浆中多沙普仑的浓度[J].中国药师,2010,13(5):618-9.
[3] Cheng J,Xia D Y,Guo T,et al.Determination of doxapram in human plasma by HPLC[J].China Pharm,2010,13(5):618-9.
[4] 郭 涛,程 佳,夏东亚,等.盐酸多沙普仑在中国蒙古族和汉族健康人体内的药动学特征[J].中国临床药学杂志,2011,20(1):5-8.
[4] Guo T,Cheng J,Xia D Y,et al.Pharmacokinetics of doxapram in Chinese Han and Mongolian healthy volunteers[J].Chin J Clin Pharm,2011,20(1):5-8.
[5] Bairam A,Blanchard PW,Mullahoo K,et al.Pharmacodynamic effectd and pharmacokinetic profiles of keto-doxapram and doxapram in newborn lambs[J].Pediatr Res,1990,28(2):142-6.
[6] 夏东亚,程 佳,郭 涛,等.多沙普仑在中国朝鲜族和汉族健康人体的药代动力学[J].中国临床药理学杂志,2010,26(12):912-5.
[6] Xia D Y,Cheng J,Guo T,et al.Pharmacokinetics of dosapram in Chinese Korean and Han healthy volunteers[J].Chin J Clin Pharmacol,2010,26(12):912-5.
[7] 郭 涛,程 佳,夏东亚,等.多沙普仑在中国蒙古族、维吾尔族和汉族健康人体的药动学研究[J].解放军药学学报,2011,27(4):331-3.
[7] Guo T,Cheng J,Xia D Y,et al.A comparison of pharmacokientics of doxapram in Chinese Mongolian Uigur and Han Healthy volunteers[J].Pharm J Clin Pla,2011,27(4):331-3.
[8] 杨积平,许善初.性别对药动学的影响[J].中国药房,2005,16(15):1188-90.
[8] Yang JP,Xu SC.The influence of gender on the pharmacokinetics[J].Chin Pharm,2005,16(15):1188-90.
[9] Sams R A,Detra R L,Muir.Pharmacokinetics and metabolism of intravenous doxapram in horses[J].Equine Vet JSuppl,1992,24(11):45-51.
[10]Chen L H,Zhang H M,Guan Z Y,et al.Sex dependent pharmacokinetics,tissue distribution and excretion of peimine and peiminine in rats assessed by liquid chromatography-tandem mass spectrometry[J].J Ethnopharmacol,2013,145(1):77-84.
[11]Xu H Y,Gan JJ,Liu X H,et al.Gender-dependent pharmacokinetics of lignans in rats after single and multiple oral administration of Schisandra chinensis extract[J].J Ethnopharmacol,2013,147(1),224-31.
[12]张松波,周宏灏.药物代谢性别差异及与核受体的关系[J].中国药理学通报,2007,23(3):292-4.
[12]Zhang SB,Zhou H H.Gender difference of drug metabolism and its mechanism[J].Chin Pharmacol Bull,2007,23(3):292-4.

