一种高纯度和高活力的大鼠脑微血管内皮细胞的提取及原代培养方法
查雨锋,张 顺,苏 航,刘 亭,傅晓钟,董永喜,王爱民,王永林
(1.贵阳医学院民族药与中药开发应用教育部工程研究中心、2.贵州省药物制剂重点实验室,贵州贵阳 550004)
血脑屏障(blood-brain barrier,BBB)是存在于血液与脑组织间的一道生理屏障,对于维持中枢神经系统的稳定起着重要作用。它的存在使处于循环中的内源性和外源性物质无法轻易透过其进入大脑组织,从而保护大脑不被血液内的微生物和毒素伤害[1],但同时也导致绝大多数药物无法进入大脑组织,使得中枢神经系统药物的开发受到巨大阻碍。寻找新的脑靶向给药系统以及与之相对应的筛选工具将是今后药学研究的重点,由于整体实验的复杂性和影响因素的多重性,使得对新药透过BBB的筛变得困难,而体外BBB模型避免了体内研究的多种复杂干扰因素,被广泛应用于新药开发中预测其BBB通透能力的重要工具[2]。脑微血管内皮细胞(brain-microvessl endothelial cells,BMECs)是建立体外BBB模型的重要材料,而如何获得高纯度的BMECs一直是建立体外BBB的关键和难点。目前,国内外关于BMECs的分离方法有筛网法、酶消化法及组织块法[3-4],但这些方法都不能够有效获得高纯度及高活力的BMECs。本研究参照国内外报道的筛网法[5]和酶消化法[6],摸索出了获得高纯度和高活力BMECs的分离及培养方法。
1 材料
1.1 动物 10 d的 SD大鼠5只,♀♂均可,由贵阳医学院实验动物房提供,动物合格证号:SCXK(黔)2012-0001。
1.2 试剂 DMEM高糖培养基(批号8114031)、胎牛血清(FBS,批号1227694)、胰蛋白酶(批号J130049)均购自Gibco公司;青霉素-链霉素(批号15140-122)购自Hyclone公司;碱性成纤维细胞生长因子(bFGF,批号1210432)购自Pepro Tech公司;牛血清白蛋白(BSA,批号1213G051)、Ⅱ型胶原酶(批号 C6885)、D-NaseⅠ酶(批号 D8071)、鼠尾胶原蛋白(批号 C8062)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,批号705B054)、TritionX-100(批号 T8200)、肝素钠(批号H8060)、胰岛素(批号1205A025)、转铁蛋白(批号823A0410)、L-谷氨酰胺(批号 312A043)、Percoll(批号305A046)、苏木精(批号20130624)均购自 Solarbio公司;亚硒酸钠(批号10102-18-8)购自Amresco公司;胶原酶/分散酶(批号14093221)购自Roche公司;4%多聚甲醛(批号07K29C68)购自博士德生物公司;兔抗人Ⅷ因子相关抗原单克隆抗体(批号bs-2974R)购自Bioss公司;D-Hanks缓冲液(自配);SP免疫组化试剂盒(批号SP-9001)、DAB显色试剂盒(批号ZLI-9018)购自中杉金桥公司。
1.3 仪器 6孔细胞培养板、细胞培养瓶(corning,USA);数显立式压力蒸汽灭菌器(上海博讯实业有限公司医疗仪器厂);超净工作台(北京东联哈尔仪器制造有限公司);CO2细胞培养箱(Thermo scientific公司);Allegra 64R冷冻高速离心机(美国Beckman);倒置显微镜(日本尼康公司)。
2 方法
2.1 大鼠BMECs的原代培养 取5只新生10 d的SD大鼠,无菌条件下取脑,分离并收集灰质于冷DMEM培养液中。将收集到的大脑灰质用D-Hanks液清洗3次后,剪成1 mm3左右大小,加入5 ml质量分数为0.1%的Ⅱ型胶原酶(内含0.005%D-NaseⅠ)悬浮混匀后用5 ml吸管吹打30次,37℃振荡消化40 min后,加入质量分数为0.1%的胶原酶/分散酶共同消化40 min,4℃,800×g离心5 min。弃上清液,添加适量DMEM培养液混匀后通过100目的筛网,收集滤液,800×g离心5 min。将沉淀加入适量质量分数为20%的BSA混悬后,4℃,1 000×g离心20 min,取底部沉淀。将沉淀用DMEM培养液洗1次,4℃,800×g离心5 min,弃上清液,平铺于质量分数为44%的连续percoll离心液表面,4℃,1 000×g离心10 min,离心后取靠近底部红色沉淀的黄白色部分,DMEM培养液清洗1次后离心,即得到纯度较高的微血管段(注:以上操作均在冰上进行)。用7 ml含20%FBS的高糖 DMEM(另含 bFGF 2μg·L-1;肝素钠100 mg·L-1;牛胰岛素 50 mg·L-1;cAMP 312.4μmol·L-1;转铁蛋白 5 mg·L-1;亚硒酸钠 2μg·L-1;L-谷氨酰胺 2.5 mmol·L-1;青霉素1×105U·L-1;链霉素100 mg·L-1)悬浮后接种于涂有鼠尾胶的培养瓶中,最后加入4 mg·L-1的嘌呤霉素,置于37℃,5%CO2培养箱内培养2 h后换液,培养48 h后换不含嘌呤霉素的培养液培养,随后隔1 d换1次培养液。
2.2 大鼠BMECs的传代 大鼠BMECs长至单层时,用质量分数为0.125%的胰酶(含0.01%EDTA)消化,并于倒置显微镜下观察,当发现细胞变圆,间隙增大时,加入2~3 ml含有血清的培养液终止消化,轻轻吹打至细胞脱落,800×g离心5 min,弃上清液,按1∶2的传代方式接种于鼠尾胶包被的培养瓶中,用含20%FBS的高糖DMEM培养,每天换1次液。
2.3 大鼠BMECs的鉴定
2.3.1 形态学 将培养有BMECs的培养瓶置于倒置显微镜下观察细胞贴壁、生长状况及形态,并进行拍照。
2.3.2 Ⅷ因子相关抗原免疫组化鉴定 将扩增培养的BMECs以每孔100万个细胞的密度接种于涂有鼠尾胶的6孔板中,当细胞铺满板底时吸出培养液,给予4%的多聚甲醛固定1 h,PBS冲洗3次(每次3 min),按照SP免疫组化试剂盒说明书依次操作,兔抗大鼠Ⅷ因子相关抗原单克隆抗体按1∶200稀释。DAB显色,苏木精复染,于倒置显微镜下观察,以胞质呈现棕色信号为阳性细胞,阴性对照用PBS代替兔抗Ⅷ因子相关抗原单克隆抗体。
2.4 BMECs生长曲线的绘制 分别绘制BMECs在普通培养基(即含有 20%FBS,bFGF 2μg·L-1,肝素钠 100 mg·L-1,L-谷氨酰胺2.5 mmol·L-1,青霉素 1×105U·L-1,链霉素100 mg·L-1的高糖 DMEM)和生长培养基(即含有20%FBS,bFGF 2μg·L-1,肝素钠 100 mg·L-1,牛胰岛素50 mg·L-1,cAMP 312.4μmol·L-1,转铁蛋白 5 mg·L-1,亚硒酸钠 2μg·L-1,L-谷氨酰胺 2.5 mmol·L-1,青霉素 1×105U·L-1,链霉素100 mg·L-1的高糖 DMEM)的生长曲线。取2~3代的BMECs,每孔20万个细胞接种于96孔板中,采用MTT法测定1周内每天的细胞活力。每天测定10个复孔,取平均值。最后以时间(d)为横坐标,吸光度值(A)为纵坐标描绘一条曲线,即为BMECs的生长曲线。
3 结果
3.1 倒置相差显微镜观察细胞形态 将提取得到的脑微血管段置于倒置显微镜下观察,微血管段表面光滑,长短不一,呈单枝或多枝状,也有呈串珠状,有部分被分散成小碎段和单个细胞。2 h后微血管段贴壁,并有内皮细胞爬出生长。48 h后细胞融合为单层,细胞呈梭形和多角形。72 h后细胞呈典型的铺路卵石样结构,并呈“漩涡状”分布,其形态与文献报道相似[7]。

Fig 1 Morphology of BMEC(×100)A:Brain microvascular section obtained by primitive extract;B:BMECs culture for 2 h;C:BMECs culture for 48 h;D:BMECs culture for 72 h
3.2 Ⅷ因子相关抗原免疫组化鉴定 经DBA显色后,细胞胞质呈棕色,说明所培养的细胞为脑微血管内皮细胞。

Fig 2 Factor-VIII relative antigen immunohistochemistry identification(×200)A:Negative control;B:Positive control
3.3 BMECs生长曲线的绘制 在生长培养基中,BMECs从d 2开始进入对数生长期,生长高峰在3~4 d,d 5后生长趋于稳定。与在生长培养基中培养相比,BMECs在普通培养基中的生长速度较慢,生长周期延长,细胞活力偏低,如Fig 3所示。

Fig 3 Growth curve for BMECsa:Cultured in ordinary medium;b:Cultured in growth medium
3.4 嘌呤霉素对BMECs纯化的考察 在培养介质中加入4 mg·L-1的嘌呤霉素培养48 h,可有效抑制杂细胞的生长。而未加入嘌呤霉素培养48 h后,可见大量有突触的杂细胞生长,如Fig 4所示。
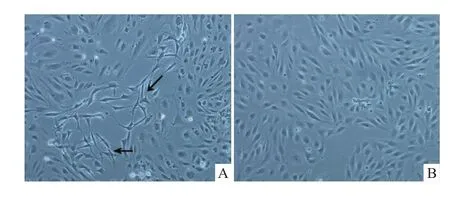
Fig 4 Investigation on purification of BMECs by using puromycin(×200)A:Culture without puromycin,a large number of parenchyma cell growth can be observed;B:Culture with puromycin for 48 h,no obvious parenchyma cell growth can be observed.
4 讨论
目前,国内外有关BMECs的分离大多采用筛网法和两次酶分步消化法,但这两种方法都有缺陷。采用筛网法细胞得率较低,往往需要大量实验动物;另外,匀浆过程对细胞损伤较大,所得细胞活力较低,接种后难以存活,而且还掺杂有较多杂细胞。而采用两次酶分步消化法所分离的细胞虽存活率和细胞得率都有所提高,但其耗时较长,并且所得到的微血管段中杂有大量动脉和静脉血管,最后培养得到的内皮细胞并非完全为BMECs;另外,由于消化时间过长,微血管段大多被分解成小碎段,这对于BMECs的活力是有很大影响的。此外,还有相关文献报道,采用匀浆法与两次分步酶消化法相结合[8],这不仅可以缩短消化时间,还可以获得较完整的微血管段,但本研究通过反复实验发现,匀浆对BMECs的损伤是巨大的,虽用缩短消化时间来弥补匀浆带来的损伤,但最终结果也不是很理想。针对以往分离方法的不足,本研究摸索出既可以分离得到高纯度BMECs,又能有效缩短分离时间和最大程度提高细胞活力的分离培养方法,本方法分离得到的BMECs培养周期较短,为3~4 d,明显低于相关文献报道[9-10],大大缩短了实验周期。该方法的总结主要如下:①鉴于分散酶主要作用于细胞基底膜,作用温和,对细胞膜伤较小的特点,本研究采用Ⅱ型胶原酶,分散酶/胶原酶连续消化法,即先加入Ⅱ型胶原酶消化40 min,再继续加入分散酶/胶原酶,两种酶共同作用消化40 min,与两次酶分步消化相比,消化结果相同,但缩短了近一半的消化时间[11-13],从而较好的保留了细胞活力。②采用100目筛网对消化好的组织进行过滤,可将未分散开的组织团块及大血管如静脉和动脉有效去除,使分离出的微血管段更为纯净。③所有操作均在冰上进行,以最大限度的保留细胞活力。④基于BMECs高度表而其他细胞较少表达P-糖蛋白,因此在培养介质中加入P-糖蛋白底物嘌呤霉素培养48 h,可有效杀灭杂细胞,从而进一步提高细胞纯度[14]。⑤加入微量的细胞培养添加物,如胰岛素、cAMP、亚硒酸钠和转铁蛋白,可促进细胞生长,缩短生长周期,这可能与其促进细胞的物质代谢有关。⑥与采用明胶包被的培养瓶相比,鼠尾胶原蛋白包被的培养瓶更利于BMECs的生长。⑦共考察了质量分数为33%、44%和55%3个浓度percoll离心液的分离效果,发现随着percoll离心液浓度的升高,微血管段层距底部的红细胞和周细胞层就越远,但细胞得率也会逐渐降低,最后本研究采用了质量分数为44%的percoll作为离心介质,这样既可以保证细胞得率,又能将其与杂细胞较好分离。⑧文献报道,BMECs接种1 h后开始贴壁,4 h贴壁率达60%以上[15],而胶质细胞的贴壁高峰在6 h以后。而本研究发现,采用本方法获得和培养的BMECs在接种2 h后贴壁率就可达到90%以上,因此选择在接种后2 h换全液,可以有效去除杂细胞。⑨根据BMECs较容易消化脱落的特性,采用分次收集消化液的方式对其进一步纯化,反复实验证明,较先脱落的70%部分含杂细胞较少。本方法能够获得高产率的BMECs,重现性较好,操作相对简单,并且所得到的细胞纯度和活力都相对较高,为体外BBB的建立以及对大脑疾病致病机制的研究提供了技术支持和理论指导。
参考文献:
[1] Persidsky Y,Ramirez S H,Haorah J,Kanmogne G D.Blood-brain barrier:structural components and function under physiologic and pathologic conditions[J].J Neuroimmune Pharmacol,2006,1(3):223-36.
[2] 陈剑鸿,刘松青,王章阳,等.药物实验血脑屏障体外模型的建立及评价[J].中国医院药学杂志,2008,28(7):534-7.
[2] Chen JH,Liu Q S,Wang Z Y,et al.Establishment and evaluation of an in vitro model of brain-blood barrier for pharmaceutical experimental research[J].Chin Hosp Pharm J,2008,28(7):534-7.
[3] 赵 琳,郭 虹,康立源,等.脑微血管内皮细胞培养技术的研究进展[J].中国药理学通报,2008,24(8):992-5.
[3] Zhao L,Guo H,Kang L Y.Advance in study of the culture of brain microvascular endothelial cells[J].Chin Pharmacol Bull,2008,24(8):992-5.
[4] 王 艳,汪 宁,林辰雨.脑微血管内皮细胞的原代培养方法概述[J].中国药理学通报,2013,29(2):294-6.
[4] Wang Y,Wang N,Lin CY.Overview of the primitive culture method of brain microvascular endothelial cells[J].Chin Pharmacol Bull,2013,29(2):294-6.
[5] Gaillard P J,Voorwinden L H,Nielsen J L,et al.Establishment and functional characterization of an in vitro model of the bloodbrain barrier,comprising a co-culture of brain capillary endothelial cells and astrocytes[J].Europ J Pharm Sci,2001,12(3):215-22.
[6] Nakagawa S,Deli MA,Kawaguchi H,et al.A new blood-brain barrier model using primary rat brain endothelial cells,pericytes and astrocytes[J].Neurochem Int,2009,54(3):253-63.
[7] Liu Y,Xue Q,Tang Q,et al.A simple method for isolating and culturing the rat brain microvascular endothelial cells[J].Microvascul Res,2013,90(6):199-205.
[8] 刘恺鸣,迟路湘,鲁向辉,何国祥.大鼠脑微血管内皮细胞的原代培养[J].第三军医大学学报,2007,29(20):2011-3.
[8] Liu K M,Chi L X,Lu X H,He G X.Isolation and cultivation of primary rat brain microvaseular endothelial cells[J].J Third Mil Med Univ,2007,29(20):2011-3.
[9] 王义宝,刘云会,刘丽波,等.大鼠脑微血管内皮细胞的原代培养及其生物学行为初步探讨[J].神经解剖学杂志,2006,22(2):224-8.
[9] Wang Y B,Liu Y H,Liu L B,et al.Primary culture of brain microvascular endothelial cell and its biological behavior study[J].Chin J Neuroanat,2006,22(2):224-8.
[10]吴秀芹,梅晓云,吴颢昕,等.大鼠脑微血管内皮细胞的原代培养与鉴定[J].中国实验方剂学杂志,2011,17(3):187-9.
[10]Wu X Q,Mei X Y,Wu H X,et al.Methods of culturing and identifying brain microvascular endothelial cells in rats[J].Chin J Exp Tradit Med Form,2011,17(3):187-9.
[11]李正伟,卞红强,罗正利,等.大鼠脑皮质微血管内皮细胞的原代培养和鉴定[J].华中科技大学学报(医学版),2012,41(5):585-8.
[11]Li Z W,Bian H Q,Luo Z L,et al.Primary culture and identification of rat brain microvascular endothelical cells in vitro[J].Acta Med Univ Sci Technol Huazhong,2012,41(5):585-8.
[12]鹿文葆,秦伟伟,刘淑英,等.大鼠脑微血管内皮细胞的纯化培养与鉴定[J].中国脑血管病杂志,2011,10(8):535-8.
[12]Lu W B,Qin W W,Liu SY,et al.Purified culture and identification of the rat brain microvascular endotheliar cells[J].Chin JCerebrovasc Dis,2011,10(8):535-8.
[13]田林郁,李胜富,周 东.大鼠脑微血管内皮细胞的分离、培养及不同纯化方法的比较[J].四川大学学报(医学版),2010,41(5):869-72.
[13]Tian L Y,Li SF,Zhou D.Separation,culture and purification of rat brain microendothelial cell[J].J Sichuan Univ(Med Sci Edi),2010,41(5):869-72.
[14]Perrière N,Demeuse PH,Garcia E,et al.Puromycin-based purification of rat brain capillary endothelial cell cultures.Effect on the expression of blood-brain barrier-specific properties[J].J Neurochemistry,2005,93(2):279-89.
[15]Duan C G,Xiu R J.Cultivation of endothelial cells from rat brain microvessels[J].Chin Med J,1988,101(9):649-53.

