用乌司他丁抑制炎症反应减轻大鼠移植肝再灌注损伤的实验研究
林 峰,周志军,张晨虹,刘 芳,郭闻渊,魏若菡,陈 慧 (. 台州市第一人民医院, 浙江 台州 3800;. 第二军医大学附属长征医院器官移植科, 上海 00003)
随着外科手术水平的提高、器官保存技术的发展以及新型免疫抑制剂的应用,器官移植已经进入了全面、快速发展的阶段,就肝移植(orthotopic liver transplantation, OLT)而言,其已成为各种终末期肝病唯一、有效的治疗手段。然而,仍有一些难题困扰着OLT的快速发展,移植肝再灌注所激发的炎症反应就是其中之一。一方面,再灌注后炎症反应会诱导肝细胞凋亡、坏死,加重移植肝功能障碍,甚至造成原发性供肝无功能,对于合并脂肪变性或心脏死亡供体肝而言,这种损害可能更加严重;另一方面,这种炎症反应也会造成远隔器官(如肺、肾)的功能损害。因此,寻求减轻移植肝再灌注后炎症反应的干预措施或治疗药物,是目前肝脏外科及器官移植领域的研究热点之一。
乌司他丁(ulinastatin,UTI)是从人尿液中提取、精制的一种糖蛋白水解酶抑制剂,目前已广泛应用于急性胰腺炎、感染等临床领域,显示了良好的抑制全身性炎症反应的作用。然而,乌司他丁对移植肝再灌注所激发的炎症是否有明显的抑制作用,目前国内外相关报道较少。本课题拟在建立大鼠同系肝脏移植模型基础上,研究乌司他丁对移植肝再灌注后炎症反应的影响及机制。
1 材料与方法
1.1实验动物及试剂 4~6周龄的雄性Sprague-Dawley(SD)大鼠,体重200~220 g,购于上海必凯实验动物有限公司,无特殊病原体环境饲养,自由进食、饮水。乌司他丁购自广东天普生化医药股份有限公司(104U/支,生产批号:03120624)。原位凋亡检测试剂盒购自美国Chemicon International Inc.公司,兔抗大鼠F4/80单克隆抗体及蛋白印迹用抗体购自美国Santa Crutz公司,大鼠肿瘤坏死因子(tumor necrosis factor, TNF)-α、白细胞介素(interleukin, IL)-1β 、IL-6、单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)-1酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国eBioscience公司,TNF-α、IL-1β、IL-6、MCP-1引物由上海生工生物有限公司合成。
1.2OLT模型、分组及标本采集 受体大鼠术前禁食12 h,自由进水,供体大鼠不禁食。SD同系大鼠非动脉化OLT模型按照我们实验室已经完善的方法建立[1]。实验大鼠随机分为3组,每组8只:假手术组、对照组和乌司他丁组。假手术组大鼠仅接受麻醉、开腹、肝周韧带游离及关腹操作;乌司他丁组及对照组大鼠接受同系原位肝移植,门静脉开放后,乌司他丁组经尾静脉注射乌司他丁1×104U/kg,对照组大鼠经尾静脉注射等量生理盐水。再灌注后6 h和24 h每组分别处死4只大鼠,获取下腔静脉血标本及肝脏标本。血标本37 ℃恒温箱静置2 h,4 ℃冰箱过夜后以 2 000 r/min离心10 min, 分离并收集血清,置-80 ℃冰箱保存,用于检测转氨酶及细胞因子;部分肝脏标本经液氮迅速冰冻后,冻存于-70℃,用于提取核酸或蛋白;另取部分肝脏标本用10%甲醛(福马林)溶液固定用于组织学检查,部分肝组织冻存于Tissue Teck保存液内用于免疫组化检测;各组实验均完成后,对标本集中进行检测。
1.3实时荧光定量逆转录聚合酶链反应(real-time quantitative RT-qPCR) 肝组织内TNF-α、IL-1β、IL-6、MCP-1的mRNA表达水平采用荧光定量RT-PCR方法检测[1]。建立逆转录PCR反应体系,总量10 μl。所用引物序列如下:TNF- 上游引物:5′-CTT CTC ATT CCT GCT CGT GG T-3′,下游引物:5′-CCT CTG CTT GGT GGT TTG C-3′; IL-1β上游引物:5′-CTT CCT TGT GCA AGT GTC TGA AG C-3′,下游引物:5′-AAG AAG GTG CTT GGG TCC TCA TCG-3′;IL-6上游引物:5′-AGC GAT GAT GCA CTG TCA GA-3′,下游引物:5′-GGT TTG CCG AGT AGA CCT CA-3′; MCP-1上游引物:5′- GAT GCA GTT AAT GCC CCA CT-3′,下游引物:5′- TTC CTT ATT GGG GTC AGC AC-3′;GAPDH上游引物:5′-ACC ACA GTC CAT GCC ATC AC-3′,下游引物:5′-TCC ACC ACC CTG TTG CTG TA-3′。 PCR条件如下:预变性,50 ℃ 2 min, 95 ℃ 5 min;PCR循环(40个),95 ℃ 15 s,60 ℃ 30 s。所用仪器为ABI Step OneTM实时荧光定量RT-PCR仪(Applied Biosystems, USA)。目的基因 mRNA表达水平以相应标本内GAPDH mRNA为基准采用[2△△C(T)]方法计算[2],并将假手术组标本内目的基因表达水平设为1,对其他组标本内目的基因表达水平进行标准化计算(所得结果为1的倍数)[1]。
1.4蛋白质印迹 用冷裂解液匀浆化肝组织,然后向裂解物内加入等体积含十二烷基硫酸钠(SDS)的蛋白质缓冲液,水浴锅内煮沸10 min,于4℃、10 000 r/min离心 10 min,收集上清并采用BCA蛋白质分析试剂盒测定蛋白质浓度。用12%SDS聚丙烯酰胺凝胶电泳分离蛋白质(30 μg/泳道),用转膜系统将蛋白质转移至硝酸纤维素膜上,常温下用含5%脱脂奶粉的TBST(Tris-buffered saline, pH 7.6,含0.05% Tween 20)封闭2 h。经TBST清洗2次后,加入适当稀释的第一抗体,4℃孵育过夜。加入辣根过氧化物酶偶联的第二抗体孵育1 h,最后加入底物并曝光、显影。
1.5ELISA检测 再灌注24 h后血清TNF-α、IL-1β、IL-6、MCP-1含量的测定是采用相应的ELISA试剂盒,并按照说明书操作进行检测。
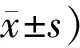
1.7细胞凋亡检测 采用原位末端脱氧核苷酸转移酶介导的 dUTP缺口末端标记法(TUNEL)对肝脏凋亡细胞进行检测。按细胞凋亡检测试剂盒说明书进行操作。计数400×高倍视野下TUNEL阳性细胞数,每组4只小鼠,结果以均数±标准差表示。
1.8统计学处理 计量资料用均数±标准差表示,多组样本均数之间比较采用单因素方差分析,各组间的两两比较采用最小显著性差异法(LSD检验),数据应用SPSS16.0统计软件分析,当P<0.05时,则认为差异有统计学意义。
2 结果
2.1乌司他丁对移植肝功能及病理学损害的影响 再灌注6 h和24 h,血清ALT水平见表1,对照组ALT水平较假手术组均明显升高(P<0.01),而同时间点乌司他丁组ALT水平较对照组明显降低(P<0.01)。

表1 再灌注6 h和24 h各组大鼠血清ALT水平及肝组织Suzuki评分
1)P< 0.01,与假手术组比较;2)P< 0.01,与对照组比较

图1 再灌注24 h各组大鼠肝病理学变化(H-E:200×)
再灌注24 h,各组小鼠肝病理学检查结果如图1。假手术组肝细胞排列整齐,结构完整,无明显病变;对照组标本肝细胞排列紊乱,肝细胞肿胀明显,胞浆疏松化,呈气球样变性,部分肝细胞溶解坏死,肝小叶结构不完整,肝窦内见大量红细胞瘀积;乌司他丁组标本肝细胞损伤较对照组明显减轻,肝组织结构破坏较轻,仅部分肝细胞肿胀呈气球样变。各组肝脏标本组织损伤Suzuki评分结果见表1。结果表明乌司他丁可以显著减轻肝再灌注后肝功能及肝组织害。
2.2乌司他丁对移植肝细胞凋亡影响 细胞凋亡是程序性细胞死亡过程。各组标本肝细胞凋亡情况见表2。与假手术组相比,对照组再灌注6及24 h肝细胞凋亡明显增多(P<0.01),而同时间点乌司他丁组肝细胞凋亡较对照组明显减少(P<0.01)。
2.3乌司他丁对移植肝Kupffer细胞浸润的影响 采用免疫组化的方法检测肝标本内F4/80阳性Kupffer浸润情况,结果见表3。与假手术组相比,对照组标本Kupffer细胞浸润数量明显增多(P<0.01),而同时间点乌司他丁组Kupffer细胞浸润数量较对照组明显减少(P<0.01)。

表2 再灌注6 h和24 h各组大鼠肝细胞凋亡情况
1)P< 0.01,与假手术组比较;2)P< 0.01,与对照组比较

表3 再灌注6及24 h各组大鼠肝组织内Kupffer细胞浸润情况
1)P< 0.01,与假手术组比较;2)P< 0.01,与对照组比较
2.4乌司他丁对肝组织内炎症介质mRNA表达的影响 再灌注6 h,各组肝标本内TNF-α、IL-1β、IL-6、MCP-1的mRNA相对表达水平见图2。与假手术组相比,对照组肝标本内上述炎症介质表达明显升高(P<0.01),而乌司他丁组上述炎症介质mRNA水平显著降低(P<0.01)。
2.5乌司他丁对血清内炎症介质含量的影响 再灌注24 h,各组大鼠血清内TNF-α、IL-1β、IL-6、MCP-1含量见表4。与假手术组相比,对照组大鼠血清内上述炎症介质表达明显升高(P<0.01),而乌司他丁组大鼠血清内上述炎症介质含量显著降低(P<0.01)。

图2 再灌注6 h肝标本内TNF-α、IL-1β、IL-6、MCP-1 mRNA相对表达水平


组别TNF-α(pg/ml)IL-1β(pg/ml)IL-6(pg/ml)MCP-1(pg/ml)假手术组31.8±8.465.5±15.9104.8±20.924.0±7.1对照组157.5±22.21) 714.5±132.31) 1443.5±208.51) 454.3±82.61) 乌司他丁组101.8±16.12) 543.8±74.12) 1038.0±162.32) 315.3±47.52)
1)P< 0.01,与假手术组比较;2)P< 0.01,与对照组比较
2.6乌司他丁对肝组织内转录因子NF-κB活化的影响 再灌注24 h,各组肝标本内NF-κB活性亚单位P65磷酸化水平见图3。与假手术组相比,对照组肝组织内磷酸化P65表达水平明显升高;而乌司他丁组磷酸化P65表达水平较对照组明显降低。半定量灰度分析结果见图4。

图3 再灌注24 h各组肝标本内P65磷酸化水平
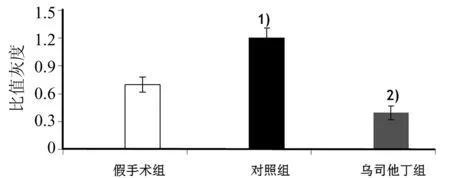
图4 半定量分析各组肝标本内P65磷酸化水平
3 讨论
肝缺血再灌注(ischemia reperfusion, IR)损伤常于肝外科手术如肝部分切除术、肝移植术以及创伤、休克的治疗过程发生,往往具有较高的发病率及病死率,是困扰临床医生的重要难题之一[4]。近年来,大量的研究显示,以固有免疫为主的炎症反应包括炎症细胞浸润、炎性介质表达以及炎性相关转录因子活化等在肝缺血再灌注损伤尤其是移植肝缺血再灌注损伤中具有重要的致病作用[5,6]。因此,靶向抑制移植肝再灌注后的炎症反应是减轻移植肝缺血再灌注损伤的重要途径之一。
乌司他丁又名尿抑制素,是一种从健康成年男性新鲜尿液中分离纯化出来糖蛋白,由143个氨基酸组成,相对分子量约为67 ku[7]。临床研究显示,乌司他丁对急性胰腺炎、重症感染等全身性炎症反应具有明显的抑制作用,其机制包括抑制中性粒细胞释放弹性蛋白酶、组织蛋白酶,并抑制中性粒细胞、单核巨噬细胞释放TNF-α、IL-6等炎性细胞因子,清除氧自由基,稳定溶酶体膜,减少溶酶体膜破裂释放造成的组织损伤等[8-10]。本课题中我们首先研究了乌司他丁对移植肝缺血再灌注损伤的影响,结果显示乌司他丁可以减轻肝再灌注损伤,表现为降低血清ALT等生化酶水平,减轻移植肝组织病理学损害程度并减轻肝细胞凋亡。
鉴于炎症反应在移植肝缺血再灌注损伤中的核心作用,笔者研究了乌司他丁对肝再灌注后炎症反
应的影响。已有研究显示,Kupffer细胞在肝缺血再灌注所激发的炎症反应中具有重要意义[11]。既往的研究也显示,再灌注时Kupffer细胞浸润至肝激发并加重炎症反应,促进组织损伤,而抑制Kupffer细胞功能减轻肝缺血再灌注损伤[12]。本实验结果显示,乌司他丁对肝再灌注后Kupffer细胞浸润有明显的抑制作用。Kupffer细胞产生并加重肝缺血再灌注损伤与下列机制有关。再灌注初始阶段,Kupffer细胞产生形态变化并突入肝窦内,因而阻碍窦腔内血流加重微循环障碍[13];Kupffer细胞活化后释放大量炎性介质如ROS、IL-6、TNF-α等,一方面炎性介质可以直接造成组织损伤,另一方面,炎性介质可促进中性粒细胞向损伤部位浸润[14]。
TNF-α、IL-6、IL-1β、MCP-1是细胞因子网络中非常重要的炎症介质,可由巨噬细胞、单核细胞、中性粒细胞、内皮细胞等释放,能够激发并加重炎症反应,进而加重肝缺血再灌注损伤[15]。乌司他丁能够明显抑制肝再灌注后上述炎症介质的表达。这些炎症介质导致肝损伤的机制主要包括:直接诱导肝细胞凋亡、坏死;促进肝窦内形成微血栓,造成血运障碍;进一步放大炎症介质级联瀑布反应;促进巨噬细胞、中性粒细胞等炎症细胞向损伤部位聚集,加重炎症反应及组织损伤。最后,检测了乌司他丁对肝再灌注后组织内转录因子NF-κB活化的影响。NF-κB主要P65和P55两个亚单位组成,P65是其活性亚单位,NF-κB活化时P65发生磷酸化并与P55分离,进入细胞核内促进多种炎症介质基因转录。实验结果显示,乌司他丁能够明显抑制NF-κB活化,这一机制可以部分解释乌司他丁抑制移植肝再灌注后TNF-α、IL-6、IL-1β、MCP-1表达的作用。
综上所述,本研究表明乌司他丁对移植肝再灌注损伤有保护作用,这种保护作用与抑制再灌注后炎症反应有关。
【参考文献】
[1] Song S, Shen X, Tang Y,etal. Sinomenine pretreatment attenuates cold ischemia/reperfusion injury in rats: the role of heme oxygenase-1[J]. Int Immunopharmacol, 2010, 10(6):679.
[2] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402.
[3] Suzuki S, Toledo-Pereyra LH, Rodriguez FJ,etal. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine[J]. Transplantation,1993, 55(6):1265.
[4] Dogan S, Aslan M. Hepatic ischemia-reperfusion injury and therapeutic strategies to alleviate cellular damage[J]. Hepatol Res,2011, 41(2):103.
[5] Bhogal RH, Sutaria R, Afford SC. Hepatic liver ischemia/reperfusion injury: processes in inflammatory networks——a review[J]. Liver Transpl, 2011,17(1):95.
[6] Yamanouchi K, Eguchi S, Kamohara Y,etal. Glycine reduces hepatic warm ischaemia-reperfusion injury by suppressing inflammatory reactions in rats[J]. Liver Int, 2007, 27(9):1249.
[7] Umeadi C, Kandeel F, Al-Abdullah IH. Ulinastatin is a novel protease inhibitor and neutral protease activator[J]. Transplant Proc, 2008, 40(2):387.
[8] 郑继海, 王金彩, 卢光洲. 乌司他丁与奥曲肽治疗急性胰腺炎的经济学评价[J].药学实践杂志, 2005, 23(2):103.
[9] Hou J, Zhu MW, He XW,etal. Effect of hyperbaric oxygen and ulinastatin on plasma endotoxin, soluble CD14, endotoxin-neutralizing capacity and cytokines in acute necrotizing pancreatitis[J]. Can J Surg, 2010, 53(4):241.
[10] Park KH, Lee KH, Kim H,etal. The anti-inflammatory effects of ulinastatin in trauma patients with hemorrhagic shock[J]. J Korean Med Sci, 2010, 25(1):128.
[11] Wanner GA, Ertel W, Müller P,etal. Liver ischemia and reperfusion induces a systemic inflammatory response through Kupffer cell activation[J]. Shock,1996,5(1):34.
[12] 郭闻渊, 滕 飞, 宋少华, 等. 丹参多酚酸盐抑制库普弗细胞活化减轻肝脏再灌注损伤[J]. 上海医学, 2010, 33(7):644.
[13] Shiratori Y, Kiriyama H, Fukushi Y,etal. Modulation of ischemia-reperfusion-induced hepatic injury by Kupffer cells[J]. Dig Dis Sci, 1994, 39(6):1265.
[14] Hisama N, Yamaguchi Y, Ishiko T,etal. Kupffer cell production of cytokine-induced neutrophil chemoattractant following ischemia/reperfusion injury in rats[J]. Hepatology, 1996, 24(5):1193.
[15] Bezinover D, Kadry Z, McCullough P,etal. Release of cytokines and hemodynamic instability during the reperfusion of a liver graft[J]. Liver Transpl, 2011,17(3):324.

