ICR小鼠自然感染小鼠肝炎病毒后抗原抗体的变化
刘香梅,赵维波,袁 文,王 静,吴玉娥,张 钰
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
小鼠肝炎病毒,冠状病毒科,冠状病毒属,基因由单股RNA构成。主要经呼吸道消化道感染,小鼠感染后,多呈隐性感染,但在实验等应激因素下,可导致免疫抑制或免疫刺激,抑制淋巴球增殖反应,以及小肠淋巴组织Peyer’S Patch中B细胞免疫球蛋白的分泌,对实验结果造成严重干扰。且该病毒在我国广泛流行,血清流行病学调查1982年, 我国普通小鼠群中小鼠肝炎病毒的感染率为20%~100%[1],1997年~1999年,北京地区普通级小鼠肝炎病毒感染率为59%~87%[2],2003年~2007年,广东省6个屏障实验动物饲养设施,5个设施曾先后出现小鼠肝炎病毒感染的情况[3]。小鼠肝炎病毒,是影响我国实验动物质量最常见的微生物项目,也是各实验动物生产单位和实验动物使用单位重点关注的项目。
近2年来,随着实验动物管理者对实验动物质量重要性认识的逐渐提高,实验动物健康监测和哨兵鼠的设置越来越受到重视,但有关哨兵鼠如何设置,何时取样,取什么样检测阳性率更高的问题,我们缺少直接的数据支持。因此,本实验选择50只ICR小鼠,通过更换“脏垫料”的方式在MHV污染的设施内设置哨兵鼠,并对抗原抗体存在情况进行跟踪。为哨兵鼠的检测取样提供数据支持。
1 材料和方法
1.1 实验动物
SPF级ICR小鼠,雌性,50只,6~8周龄,购自湖南斯莱克景达实验动物有限公司【SCXK(湘)2011-0003】。本实验在广东省实验动物监测所负压感染实验室进行【SYXK(粤)2012-0122】。
1.2 “脏垫料”
“脏垫料”即污染源,经携带MHV病毒的小鼠用过的灭菌木屑垫料混合而成。
1.3 仪器和试剂
酶标仪 BIO-RAD680,实时荧光PCR仪 ABI7300。
小鼠肝炎病毒(MHV)抗体检测试剂盒,购自SMART公司。批号:SM908。
1.4 样品的收集
将ICR小鼠以开放笼盒方式饲养在MHV污染的负压屏障实验设施内,每笼饲养5只,放置于笼架的底层位置,每周1次固定时间更换垫料。更换的垫料为设施内MHV携带鼠用过的混合“脏垫料”。分别在实验第2,4,8,14,21,28,35,42,56和84天各剖杀动物5只,采集血液、盲肠内容物、粪便、肝脏以及肺脏检测抗原抗体分布情况。
1.5 血清抗体测定
应用SMART公司的小鼠肝炎抗体检测试剂盒说明书进行。
1.6 病毒测定
荧光定量PCR.具体可参见文献[4]。
2 结果
2.1 血清抗体阳性检出率
实验开始第2天和第4天显示抗体阳性检出率为0,第8天开始,抗体检出阳性,阳性率为100%(5/5),直至实验结束抗体阳性率仍为100(5/5)(表1)。

表1 小鼠肝炎病毒抗体阳性率
2.2 各检测样本抗原阳性检出率
荧光定量PCR方法检测数据显示,实验的第2天,肺脏中开始检测到小鼠肝炎病毒,检出率为20%(1/5),其他脏器中未检出小鼠肝炎病毒;第4天,肺脏、盲肠、粪便和肝脏均检出小鼠肝炎病毒,其中肝脏检出率为60%(3/5),其他脏器均为100%(5/5),检出率明显升高;第8天,肺脏、盲肠、粪便和肝脏仍均检出小鼠肝炎病毒(检出率均为100%);从第14天开始,病毒检出率开始下降,同一时间点比较,盲肠内容物检出率最高,其次是粪便的检出率;84 d后,所有的组织和样本均不能检测到病毒的存在(表2)。
2.3 抗原与抗体间的关联分析
小鼠感染后不同时间点的抗体水平和主要脏器病毒载量(Ct值)动态变化趋势图见图1。脏器载毒量在第2天肺部首次检出,第4天达到最高水平,之后逐步减少,84 d后主要脏器组织中检测不到病毒。抗体产生时间晚于病毒检出时间,在第8天开始检测到较高水平抗体,并持续到试验结束,与预期基本一致,符合抗原抗体产生规律。但抗原持续时间稍微延长。
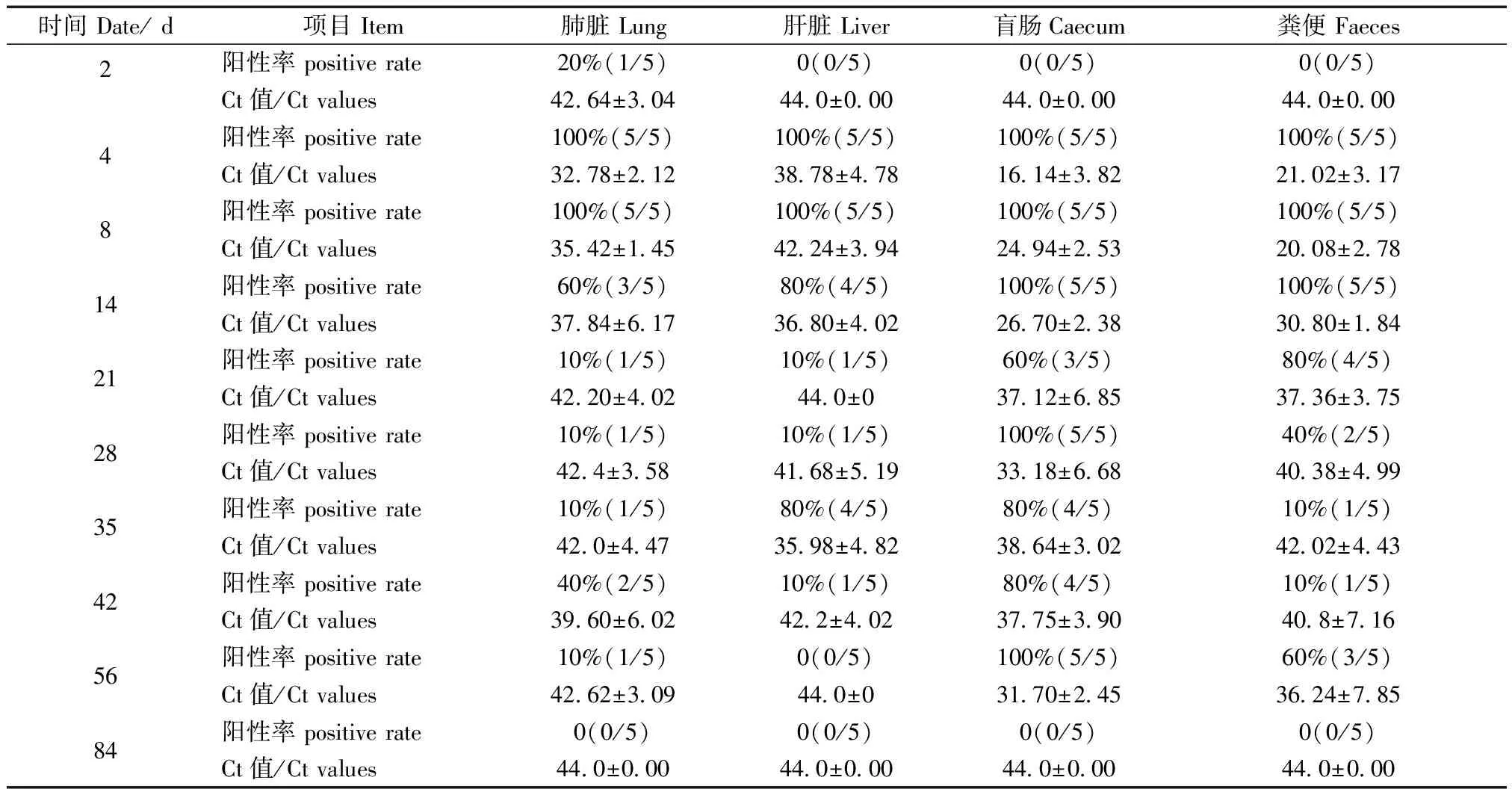
表2 小鼠肝炎病毒阳性检出率情况
3 讨论
近年来,随着基因工程小鼠应用的急剧增长以及实验动物管理者对实验动物质量重要性认识的提高,哨兵小鼠的应用越来越广泛,但关于哨兵鼠如何设置,如何送检,才能到达较高的检出率缺乏相关的数据支持,针对这些问题,本研究分析获得了ICR小鼠自然感染小鼠肝炎病毒后抗原抗体的持续性以及分布性等相关数据。
血清学检测结果显示,实验开始第8天,动物开始检测到较高水平的抗体(阳性率为100%),并持续到试验结束(84 d)未见显著降低,与人工感染小鼠肝炎病毒后抗体反应特征一致[5-7],表明实验动物感染小鼠肝炎病毒后,抗体产生时间周期短,并将会维持较长的时间。
主要组织样本抗原检测结果显示,在接触病原2 d内,实验小鼠在肺脏中检测到了病毒存在,这一结果与病原的感染途径吻合,呼吸系统最早接触潜到病原,从而最早检测到病原存在,随着试验时间的延长,多组织样本中均检测到病毒存在,并且以盲肠内容物最高,其次是粪便,表明消化系统是该小鼠肝炎病毒毒株的主要侵袭目标,同时也证实了小鼠肝炎病毒感染途径的多样性。就病毒的检出时间和检出率来看,自然感染小鼠排毒时间较人工感染小鼠肝炎病毒明显延长[5-8];但与Ferdinand等[9]所描述的小鼠肝炎病毒排毒时间基本相符。分析原因可能与毒株的类型及其毒力强弱有关,也有可能由感染方式所造成。
血清抗体与抗原检测结果的关联性分析显示,实验第2天,抗原检出阳性,第8天,抗体出现较高水平,这说明第2天病毒就经呼吸道感染了小鼠,并刺激机体产生免疫保护反应,抗体产生,并于第8天检出,但是抗原的存在周期较短,随着抗体的产生,动物体内的病毒逐渐被清除,因此抗原只能作为早期检测的辅助手段。而抗体检测则具有较高的稳定性。
综上所述,小鼠肝炎病毒的日常监测样本可以通过更换“脏垫料”的方式设置哨兵动物。哨兵动物的检测早期可以进行抗原检测;但2周后则只能选择血清学方法确认动物是否感染。
参考文献:
[1] 孙靖.实验动物学基础(第一版)[M],北京科学技术出版社,2004.211.
[2] 郭玮,贺争鸣,卫礼,等. 小鼠肝炎病毒抗体检测试剂盒的标准化研究[J].中国实验动物学报,2004,19(4):75-77.
[3] 刘香梅, 张钰, 赵维波,等. 广东省屏障设施小鼠群中小鼠肝炎病毒感染情况[J].中国比较医学杂志,2009,19(10):75-77.
[4] 熊炜,蒋静,张强,等. 小鼠肝炎病毒核酸快速检测方法的建立和应用[J]. 实验动物科学, 2013, 30(4):1-5.
[5] 高俊,孙凤萍,王胜昌,等. 实验小鼠感染小鼠肝炎病毒后的抗体变化[J].上海农业学报,2007,13(1):8-11.
[6] Homberger FR, Barthold SW, Smith AL. Duration and strain-specificity of immunity to enterotropic mouse hepatitis virus [J]. Lab Anim Sci, 1992 ,42 (4) : 347-351.
[7] 刘忠华,刘香梅,闵凡贵,等. 小鼠冠状病毒替代SARS感染模型的建立[J].中华实用医药杂志,2008,6(16):1441-1443.
[8] 王英,邵伟娟,高俊,等.小鼠肝炎病毒以不同途径感染4个品系小鼠的比较[J].上海交通大学学报(农业科学版),2005,23(2):125-133.
[9] Scavizzi F, Raspa M.Tissue distribution and duration of mouse hepatitis virus in naturally infected immunocompetent ICR (CD-1) and immunodeficient athymic nude-nu mouse strains used for ovarian transplantation and in vitro fertili-zation [J].Lab Anim,2004, 38:189-199.

